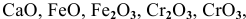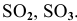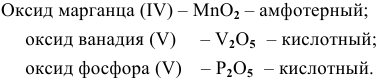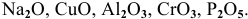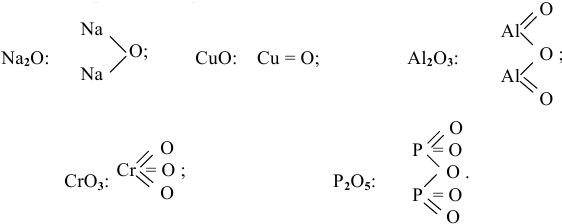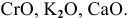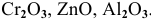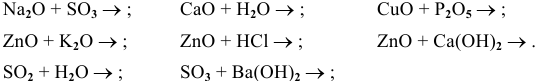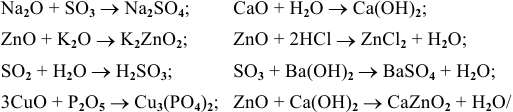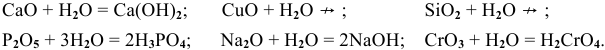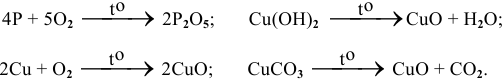Задачи с решениями по оксидам
Типовые задачи с решениями по оксидам
Задача 1
Назвать следующие оксиды:
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 2
Найти эмпирические формулы следующих оксидов: оксид марганца (IV), оксид ванадия (V), оксид фосфора (V). К какой группе оксидов относится каждый из них?
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 3
Привести графические формулы следующих оксидов:
Решение:
Графическая формула показывает порядок, в котором атомы соединены в молекуле. В графической формуле единица химической связи (валентности) изображается черточкой:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 4
К каким типам относятся следующие оксиды: 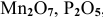
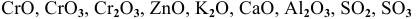
Решение:
К основным оксидам относятся оксиды металлов с ярко выраженными металлическими свойствами, проявляющими низкие валентности, в основном I и II:
К амфотерным оксидам относятся оксиды металлов со слабо выраженными металлическими свойствами. Обычно эти металлы находятся в каждом периоде на границе между неметаллами и металлами с ярко выраженными металлическими свойствами:
К кислотным оксидам относятся оксиды неметаллов, а также оксиды металлов, проявляющих высокие валентности, в основном V, VI, VII: 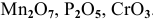
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 5
Составить уравнения следующих химических реакций:
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 6
Какие из перечисленных оксидов будут взаимодействовать с водой: 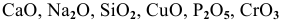
Решение:
С водой взаимодействуют кислотные оксиды, за исключением 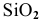
оксид щелочного или щелочно-земельного металла + 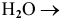
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 7
Какие из оксидов будут реагировать попарно: 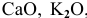
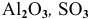
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 8
Как можно получить следующие оксиды: 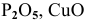
Решение:
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:





















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Источник
Задания для закрепления темы. «Оксиды».
Учитель химии высшей категории Гребенюк Татьяна Николаевна.
ГБОУ СОШ №626 г. Москва. Задания для 8 класса по теме. «Оксиды»
1. Даны формулы веществ: Cu, AI 2 O 3 , CO 2 , BaSO 4 ,CI 2 O 7 , MgO, NaNO 3 , HCI, H 2 SO 3 , O 2 , CaO, HNO 3 , N 2 O 5 , AgCI 3 , Fe. Выпишите формулы основных и кислотных оксидов. Дайте названия оксидам.
2. Определите валентность атомов химических элементов по формулам их оксидов: SO 2 , AI 2 O 3 , NO, Cu 2 O, NO 2 , Na 2 O.
3. Составьте формулы оксидов по их названиям: а) Оксид алюминия, б) оксид серы(VI), в) оксид железа (III), г) оксид азота (IV), д) оксид натрия, е) оксид фосфора (V), з) оксид кальция.
4. Назовите оксиды по их формулам: А) FeO , б) SO 2 , в) BaO , г) NO 2 , д) K 2 O , е) Cu 2 O .
5. Закончите уравнения химических реакций (сера в уравнении 4) проявляет валентность IV ) , расставьте коэффициенты, назовите продукты: 1) P + O 2 → ? 2) AI + O 2 → ? 3) C + O 2 → ? 4) S + O 2 → ? 5) Zn + O 2 →?
6.Закончите уравнения реакций, дайте названия продуктам реакций:
1) Na 2 O + H 2 O → 2) SO 2 + H 2 O → 3) SO 3 + H 2 O →
4) CaO + CO 2 → 5) CaO + P 2 O 5 → 6) K 2 O + SO 3 →
7) Na2O + SO3 → 8) K2O + SO2→ 9) CaO + SO3 →
10) CuO + HCl → 11) Na 2 O + H 3 PO 4 → 12) K 2 O + H 2 SO 3 →
13) ZnO + HCl→ 14) MgO + HCl → 15) BaO + H2SO4 →
16) Na 2 O + H 2 CO 3 → 18) P 2 O 5 + NaOH → 19) CO 2 + KOH
Источник
Урок по химии на тему: «Оксиды» 8 класс
Урок по теме: «Оксиды» 8 класс
Учебник – Рудзитис Г.Е., Фельдман Ф.Г., «Химия. Неорганическая химия».
Цель : — сформировать представление о классе бинарных соединений оксидах, их составе, номенклатуре, свойствах и получении.
— закрепить понятие «оксиды»; изучить основные правила химической номенклатуры оксидов и научиться называть их;
— познакомить с классификацией оксидов; ввести понятия «основный оксид», «кислотный оксид», «амфотерный оксид», «солеобразующий и несолеобразующий оксиды»;
— познакомить с физическими и химическими свойствами оксидов;
— познакомить учащихся с основными способами получения оксидов;
— расширить знания о применении и значении оксидов в природе и жизни человека.
— формировать умения сравнивать, выявлять общие и существенные признаки веществ, делать выводы;
— формировать умение устанавливать взаимосвязь между составом, названием и свойствами веществ;
— формирование коммуникативных качеств обучающихся;
— формирование самостоятельности, познавательного интереса, ценностного отношения к химии как науке и учебному предмету;
Основные понятия : оксиды, основные, кислотные, амфотерные, солеобразующие и несолеобразующие оксиды.
Оборудование и реактивы : компьютер, проектор, презентация, учебник – Рудзитис Г.Е., Фельдман Ф.Г., Химия. Неорганическая химия. 8 класс. – М.: «Просвещение», 2011. Бутылка газированной воды, медная проволока, спиртовка, спички, щипцы.
Здравствуйте. Присаживайтесь. Меня зовут Анна Сергеевна, и сегодня я проведу урок.
Человека окружает огромное количество химических веществ. По составу они делятся на: простые и сложные.
— Вспомните, какие вещества называются простыми?
(Ответ). Простыми – называются вещества, которые образованны атомами одного химического элемента.
— Хорошо. Приведите примеры таких веществ?
— Молодцы. А какие вещества называются сложными?
(Ответ). Сложными – называются вещества, которые образованы атомами разных химических элементов.
— Приведите, пожалуйста, примеры таких веществ?
(Ответ). H 2 O , CO 2 , NaCl , сахар и т.д.
Изучение нового материала
План изложения материала:
Физические свойства оксидов.
Химические свойства оксидов.
Основные способы получения оксидов.
Значение оксидов в природе и жизни человека.
Сложные вещества, в неорганической химии, делят на несколько групп: ОКСИДЫ, КИСЛОТЫ, ОСНОВАНИЯ и СОЛИ.
На нашем уроке мы с вами подробнее познакомимся с классом – ОКСИДЫ. Вы уже с ними начинали немного знакомиться при изучении темы «Кислород».
-Вспомните, что же такое оксиды?
(Ответ). Оксиды – это сложные вещества, которые состоят из 2-х химических элементов, один из которых кислород. (2 слайд)
— Молодцы. Запишем тему нашего урока: «Оксиды».
Можно предположить, что общая формула оксидов имеет следующий вид:
где R – элемент (металл или неметалл), O – кислород, x и y – индексы, которые показывают количество атомов химического элемента и кислорода в оксиде.
— Перед вами перечень веществ, выберите из него оксиды и назовите их.
(После ответа учащихся, включаю следующий слайд).
— По каким признакам вы выбрали оксиды? В чем сходство этих химических соединений?
(Ответ). Наличие кислорода, сложные вещества, состоят из 2-х элементов (бинарные).
— Сходство нашли. Теперь посмотрите внимательно и скажите, чем отличаются выбранные вами оксиды?
(Ответ). Обратите внимание, что в одних оксидах атом кислорода связан с атомом металла ( CaO , CuO ), а в других оксидах – с неметаллом ( CO 2 , H 2 O , SiO 2 ).
— Можно сказать, что оксиды делятся на оксиды металлов и оксиды неметаллов.
(5 слайд). В зависимости от того, с каким химическим элементом связан кислород, различают – КИСЛОТНЫЕ и ОСНОВНЫЕ оксиды. Но есть еще оксиды, которые называются амфотерные (их изучают позже).
НЕМЕТАЛЛЫ – образуют только кислотные оксиды.
МЕТАЛЛЫ – образуют и кислотные и основные оксиды.
Для металлов существует правило: Если валентность (свойство атома химического элемента присоединять или замещать определенное число атомов другого химического элемента) в металлах меньше 4-х , то, как правило, образуются основные оксиды; если валентность больше 4-х – кислотные оксиды. (Пример кислотного оксида для металлов – CrO 3 ( H 2 CrO 4 -хромовая кислота); Mn 2 O 7 ( HMnO 4 – марганцевая кислота).
(6 слайд). В зависимости от того, какие химические свойства проявляют оксиды, их называют:
СОЛЕОБРАЗУЮЩИМИ – оксиды, которые образуют соли (кислотные, основные, амфотерные)
НЕСОЛЕОБРАЗУЮЩИМИ (которые не образуют солей, и не проявляющие кислотных, основных и амфотерных свойств) –
Запишите в тетрадь несолеобразующие оксиды.
Любое из химических соединений имеет определенное название, так и оксиды. Их название начинается со слова «оксид» с добавлением названия второго химического элемента (металла или неметалла).
(7 слайд). Попробуем назвать следующие оксиды:
K 2 O – оксид калия, (основный)
FeO – оксид железа(II), (основный)
SO 2 – оксид серы(IV), (кислотный)
MgO – оксид магния, (основный)
SiO 2 – оксид кремния(IV), (кислотный)
Если элемент проявляет постоянную валентность, ее не указываем. Если же проявляет переменную валентность, то она указывается в скобках, римскими цифрами.
— Посмотрите, какие из предложенных оксидов относятся к кислотным? ( SiO 2 , SO 2 ) К основным
Способы получения оксидов
— Как вы думаете, как можно получить оксиды?
Оксиды получают двумя способами. (8 слайд)
Записываем пример горения простого вещества
Показываю опыт по получению оксида меди .
В процессе демонстрации опыта повторить правила техники безопасности через вопросы:
-Как нужно потушить спиртовку после работы?
(Ответ). Накрыть колпачком.
-Почему проволоку при нагревании необходимо держать щипцами? (Ответ). Чтобы не обжечься.
Описание: медную проволоку скрутить в спираль, закрепить в щипцах и прокалить в пламени спиртовки.
Вопросы к опыту:
-Что произошло с медной проволокой?
— Как вы думаете, почему почернела проволока?
(Ответ). Произошла реакция.
— Связано ли наблюдаемое вами явление с кислородом?
(Ответ). Да. Потому что процесс горения поддерживается кислородом.
Запишем уравнение реакции проведенного опыта.
(В результате реакции горения простых веществ, продуктом является только оксид).
При горении сложных веществ, в результате реакции образуются — оксид и выделяется вода. Запишем примеры получения оксидов:
(9 слайд). Посмотрим получение оксидов из сложных веществ, в результате разложения. (Показываю видео с получением оксида хрома).
( NH 4 ) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 4 H 2 O (Это один из примеров разложения соли).
Разложение нерастворимых оснований: Cu ( OH ) 2 = t CuO + H 2 O
Закрепление способов получения.
— Какие способы получения оксидов вы знаете?
— Какие продукты получаются в результате горения сложных веществ?
— Какие продукты получаются при горении простых веществ?
— Какие продукты реакции получаются при разложении веществ?
Физические свойства оксидов
— Любые вещества обладают физическими и химическими свойствами. Давайте вспомним, что относится к физическим свойствам?
(Ответ). Агрегатное состояние: твердое жидкое и газообразное.
Оксиды могут быть твердыми, жидкими и газообразными веществами, различной окраски, с запахом и без запаха, тяжелее или легче воздуха.
В результате опыта с медной проволокой образовался нагар, который твердый по своим свойствам. Вода — оксид, по агрегатному состоянию – жидкая. Если открыть бутылку воды, то мы слышим шипение и видим пузырьки выделяющегося газа – это оксид углерода (углекислый газ).
Химические свойства оксидов
(10 слайд). Все оксиды, как кислотные, так и основные оксиды обладают разными свойствами. (Объясняю химические свойства, записываем в тетрадь.)
А) взаимодействие с кислотами: CuO + H 2 SO 4 → t CuSO 4 + H 2 O
Li 2 O + 2 HNO 3 = 2 LiNO 3 + H 2 O (получается соль и вода)
Б) взаимодействие с водой: Li 2 O + H 2 O → 2 LiOH
CaO + H 2 O = Ca ( OH ) 2 (получается основание)
А) взаимодействие с основаниями: CO 2 + Ca ( OH ) 2 → CaCO 3 ↓ + H 2 O
SO 3 + 2 NaOH = Na 2 SO 4 + H 2 O (получается соль и вода)
Б) взаимодействие с водой: P 2 O 5 + 3 H 2 O → t 2 H 3 PO 4
N 2 O 5 + H 2 O = 2 HNO 3 (получается кислота)
В) Менее летучие кислотные оксиды вытесняют более летучие из их солей:
Взаимодействие оксидов между собой:
SiO 2 + MgO = MgSiO 3 (образуется соль)
— При взаимодействии чего образуется основание?
— В каких случаях продуктами реакции является соль и вода?
— При взаимодействии чего образуется кислота?
— Основание образуется при взаимодействии каких веществ?
— В каких случаях продуктами реакции является соль и оксид?
Значение оксидов в природе и жизни человека
Значение оксидов в промышленности и быту, а также для природных процессов — велика. (11,12,13 слайд)
В промышленности : Fe 2 O 3 и Fe 3 O 4 – применяют в производстве чугуна (сплав железа с углеродом) и стали; CaO и SiO 2 – производство строительных материалов; CO 2 – в пищевой промышленности для производства газированных напитков; H 2 O – в производственных охладительных системах, для получения новых веществ, в системах орошения, в качестве растворителя и т.д.
В быту : H 2 O – в питьевых и хозяйственных целях; SiO 2 – входит в состав чистящих веществ; ZnO –входит в состав белой краски.
В природных процессах : H 2 O и CO 2 – обеспечивают осуществление процессов фотосинтеза; H 2 O – естественный растворитель, составляет основную часть цитоплазмы животных и растительных клеток и т.д.
Подведение итогов урока. Рефлексия.
— Что такое оксиды? ( сложные вещества, которые состоят из 2-х химических элементов, один из которых кислород)
— С какой класификацией оксидов мы познакомились на уроке? (кислотными, основными, амфотерными)
— Какие оксиды образуют неметаллы? (кислотные)
— Какие оксиды образуют металлы? (основные и кислотные)
— Какими двумя способами получают оксиды? (горение веществ, разложение сложных веществ)
V. Домашнее задание: § 30, упр.1,упр.2 (4, 7, 10 –уравнения).
(14 слайд). В первом упр. вам нужно распределить оксиды по типам (кислотные или основные) и дать им названия. Поможет вам в выполнении задания таблица на странице 90. Во втором упражнении – записать уравнения реакций по схемам.
(15 слайд). На этом наш урок окончен, благодарю за внимание. До свидания!
Источник