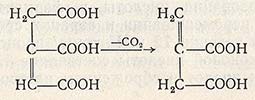Получение итаконовой кислоты биотехнологическим способом
Итаконовая (метиленянтарная) кислота — ненасыщенная двухосновная кислота. Она может быть получена химическим (из лимонной или аконитовой кислоты) или микробиологическим способом.
Свойства продуцента [7, 104, 192]
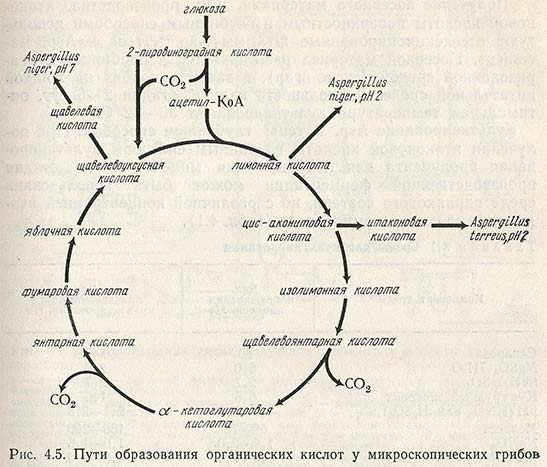
Итаконовая кислота является продуктом метаболизма углеводов грибами рода Aspergillus. Продуцентами кислоты в промышленности являются специально селекционированные штаммы A. terreus, которые в отличие от A. itaconicus не разлагают итаконовую кислоту.
Итаконовая кислота в отличие от лимонной является токсичным для микроорганизмов продуктом. При концентрации ее в среде около 70 г/л наблюдается угнетение роста продуцента и синтеза продукта. Избежать токсичного действия накапливающейся кислоты можно нейтрализацией ее NH4OH. Периодическое введение NH4OH и поддержание значения рН среды на уровне 3,8 обеспечивает накопление до 150–200 г/л итаконовой кислоты.
Другая особенность процесса синтеза итаконовой кислоты с помощью A. terreus — необходимость внесения в среду высоких концентраций ионов таких металлов, как Zn 2+ , Mg 2+ и Cu 2+ .
Для приготовления инокулята споры проращивают в жидкой или плотной среде, содержащей мелассу с конечной концентрацией 15 %, ZnSO4 — 1,5 г, MgSO4 · 7H2О — 5,0 г, CuSO4 · 5H2O — 0,02 г, соевое масло — 0,25 мл, воду — до 1 л. Инкубирование проводят с аэрацией (0,25 объема воздуха/1 объем жидкости) и сильным перемешиванием. В этих условиях споры прорастают, образуется мицелий, рН снижается с 7,5 до 4,0.
В нашей стране разработана технология производства итаконовой кислоты методами поверхностного и глубинного культивирования. В результате многоступенчатой обработки природного штамма мутагенами и последующего отбора селекционирован ряд высокоактивных мутантов A. terreus, один из них (ЭУУ-417) используется для производства итаконовой кислоты на предприятиях.
Для получения высокого выхода итаконовой кислоты необходимым является лимитирование среды по фосфат-ионам.
Основные стадии производства итаконовой кислоты [7, 104, 192]
Процесс синтеза итаконовой кислоты аналогичен процессу получения ЛК. Лучшими субстратами для культивирования являются глюкоза и сахароза, однако в промышленности используют в основном мелассу, предварительно обработанную ионитами или ферроцианидом, а также гидролизованный крахмал. Процесс проводят в условиях ограничения роста гриба минеральными компонентами среды (обычно железом и фосфором) при низком рН среды и достаточном обеспечении кислородом. Оптимальная температура культивирования составляет 37 °С. Чаще используется глубинный метод.
В качестве посевного материала при поверхностном и глубинном методах ферментации в промышленности используют сухие конидии гриба, отделенные от мицелия и смешанные с активным углем или стерильной почвой.
При поверхностном способе процесс ферментации осуществляется в кюветах по бессменному варианту без долива или с доливом. В качестве источника углерода используют свекловичную мелассу или гидролизат древесины — двойное соединение глюкозы с NaCl. Рациональная концентрация сахара 8 %. Кроме того, среда содержит NH4NO3, MgSO4 · 7H20, ZnSO4 · 7H2O, K4Fе(СN)6 и кукурузный экстракт. Начальное значение рН среды — 5,0. Важным фактором является воздушный режим в «бродильной камере».
При глубинном способе процесс осуществляется последовательно в двух ферментаторах. Среда в посевном ферментаторе засевается спорами гриба. В конце экспоненциальной фазы роста мицелий передается из посевного в основной аппарат. Ферментационная среда содержит 15 % сахара мелассы (состав солей тот же, что и при поверхностном методе), рН среды поддерживается на оптимальном для синтеза итаконовой кислоты уровне 2,1–2,3. В течение ферментации осуществляется интенсивное перемешивание и аэрация среды. В конце процесса концентрация кислоты достигает 85 г/л. Биосинтез итаконовой кислоты в глубинных условиях происходит намного интенсивнее, чем при поверхностном культивировании.
После окончания процесса ферментации КЖ освобождают от мицелия, осветляют активированным углем и упаривают под вакуумом. Итаконовая кислота кристаллизуется из упаренного раствора. Маточный раствор можно обработать активным углем и экстрагировать оставшуюся итаконовую кислоту, например амиловым спиртом.
Источник
Итаконовая кислота
Итаконовая кислота С5Н6О4 является ненасыщенной двухосновной кислотой. Наличие в молекуле двух карбоксильных групп и активной метиленовой группы определяет высокую активность полимеризации итаконовой кислоты и участие в различных реакциях присоединения.
Итаконовая кислота представляет собой белый кристаллический порошок, хорошо растворимый в воде и некоторых органических растворителях, имеет молекулярную массу 130,1, плотность 1,63 и температуру плавления 167-168 °С.
Итаконовая кислота находит применение в производстве синтетических волокон и смол, поверхностно-активных веществ, красителей и ряда других сложных органических соединений. Итаконовую кислоту могут синтезировать некоторые штаммы микроскопических грибов рода Aspergillus (Asp. terreus, Asp. itaconicus), выращиваемые глубинным или поверхностным способами на питательных средах, содержащих сахарозу, мелассу и даже продукты гидролиза древесины.
Производство итаконовой кислоты включает следующие основные технологические стадии: получение посевного материала, культивирование продуцента глубинным способом, выделение итаконовой кислоты.
Биосинтез итаконовой кислоты связан с реакциями цикла Кребса (рис. 4.5). При декарбоксилировании исходного продукта – цис-аконитовой кислоты — образуется итаконовая кислота. Во время реакции в углеродном скелете происходит перемещение электронов, в результате двойная связь переходит из положения 2,3 в положение 3,4
Получение посевного материала
Для производства итаконовой кислоты поверхностным и глубинным способами используют отселекционированные штаммы Asp. terreus и Asp. itaconicus. Посевной материал размножается в пробирках с агаризованной средой (сусло-агар), а затем в колбах на жидкой питательной среде. Длительность каждой стадии 2-6 сут, оптимальная температура культивирования 30-32 °С.
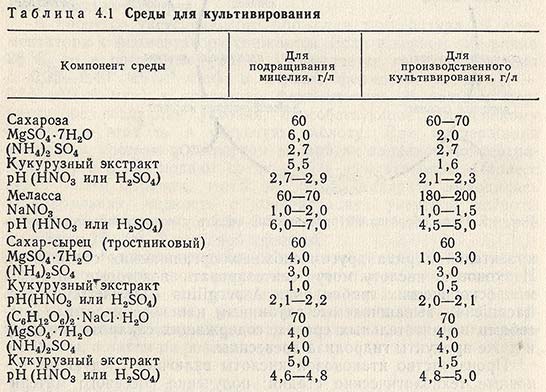
Культивирование Asp. terreus глубинным способом. При получении итаконовой кислоты глубинным способом культивирования продуцента для подращивания мицелия и на стадии производственной ферментации может быть использована среда одинакового состава, но с различной концентрацией входящих в ее состав компонентов (табл. 4.1).
Питательную среду для подращивания мицелия целесообразно засевать предварительно (за 10-12 ч) замоченными в среде конидиями из расчета 0,75 г конидий на 1 м3 среды.
Биосинтез итаконовой кислоты протекает наиболее интенсивно при засеве производственного ферментатора культурой, находящейся в конце логарифмической фазы роста, что соответствует примерно 30 ч роста.
Процесс образования кислоты в ферментаторе протекает при постоянном перемешивании и аэрации среды при температуре 33-36 °С в течение 72 ч. К концу процесса ферментации содержание итаконовой кислоты составляет 37-38 г/л при общем содержании кислот в сброженном растворе 38,5-39,0 г/л.
В условиях поверхностного способа сбраживания раствора сахарозы (слой 12 см) культурой Asp. terreus за 10-12 сут образуется 56-58% итаконовой кислоты в пересчете на сахар, причем итаконовая кислота составляет 94-97% от суммы всех образовавшихся кислот (фумаровой, щавелевой, янтарной).
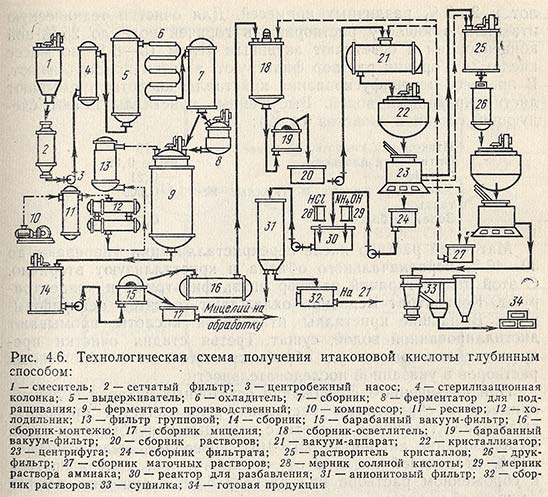
Технологическая схема получения итаконовой кислоты глубинным способом представлена на рис. 4.6.
В сброженных растворах в среднем содержится от 3 до 6% итаконовой кислоты, 0,5-1,5% несброженных сахаров, 0,3-0,6% других органических кислот и небольшое количество различных солей и красящих веществ.
Выделение итаконовой кислоты
Кипящий сброженный раствор, освобожденный от грибного мицелия, обрабатывают активным углем (0,3-0,5%) и фильтруют. Фильтрат упаривают при температуре 50-60 °С до 1/4-1/10 первоначального объема. Упаренный раствор подается в кристаллизатор, где охлаждается до 13-15°С. Кристаллизуется итаконовой кислоты 75-80% от ее содержания в растворе.
Техническая итаконовая кислота отделяется на центрифуге. Она содержит 3-6% влаги, 1-3% других органических кислот и 2-5% различных примесей. Для очистки техническую итаконовую кислоту растворяют в горячей воде до 25%-ной концентрации и осветляют активным углем (5-8% по массе кислоты). Горячий раствор фильтруют, а затем кристаллизуют. В процессе центрифугирования кристаллы кислоты промывают дистиллированный водой. Высушенные кристаллы имеют следующий состав и свойства (в %):
Маточный раствор после перекристаллизации упаривают до 30-40% первоначального объема и кристаллизуют вторично. С этой целью горячий раствор вновь фильтруют и концентрируют. Концентрат медленно охлаждают, а затем центрифугируют. Выпавшие кристаллы итаконовой кислоты промывают дистиллированной водой, сушат. Третья стадия очистки предусматривает совместную обработку маточных и сброженных растворов в указанной последовательности.
При повышенном содержании остаточных сахаров и других примесей в сброженных растворах рекомендуется проводить выделение итаконовой кислоты с помощью ионообменных смол. Использование анионита ЭДЭ-10П позволяет выделить 94-100% итаконовой кислоты от ее количества, содержащегося в сброженном растворе при расходе 5-8 г анионита на 1 г очищенной кислоты.
Регенерация отработанного ионита осуществляется соляной кислотой, а перевод в основную форму — раствором аммиака.
Источник
Способ производства итаконовой кислоты
ИЗОБРЕТЕНИЯ (6! ) Дополнительное к авт. саид-ву— (22) Заявлено 261277 (21) 2560084/28-13 с присоединением заявки ¹ (23) Приоритет
Опубликовано 0505.80 Бюллетень ¹ 17
Дата опубликования описания ц 50580 (51)М. Кл.2
СССР по делам изобретений и открытий (72) Авторы изобретения
A.Ã. Петухов, Н.Г. Чернова, В.A. Тищенко и Н. К. Беленькая (71) Заявитель (54) СПОСОБ ПРОИЗВОДСТВА HTAKOHOBOA
Наиболее близким к изобреТению по технической сущности и достЪ гаемому эффекту является способ производства итаконовой кислоты путем поверхностного выращивания продуцирующих ее микроорганизмов на питательной среде, с.одержащей источник углерода с добавлением необходимых для роста минеральных солей, кукурузного экстракта и минеральных кислот, с последующим выделением продукта упариванием раствора, фильтрующей кри ст алли з аци ей, выделением кристаллов и сушкой (3) .
Недостатком известного способа является недостаточно высокий выход кислоты, наличие остаточного сахара в пленке мицелия, что приводит к ее быстрому разрыву и затрудняет съем мицели я с кювет бродильных камер.
Белью изобретения является увеличени е выхода ит аконовой кислоты, снижение содержания остаточного сахара в сброженных растворах и тем самым упрощение процесса благодаря получению более эластичной;и легко снимаемой пленки мицелия с меньшим количеством биомассы, что облегчает
Известны способы производства итаконовой кислоты путем поверхностного выращивания продуцирующих ее ми кроор гани з мов, н апример Aspergi I I us
ter reu s, н а пи т ател ьных средах, содержащих в качестве источника углерода мелассу (1), сахар-сырец (тростниковый) (2) и другие необходимые минеральные соли, кислоты, с последующим выделением целевого
Однако применение, например, мелассы, требует дополнительных затрат на обеспечение. стерильности производства, поскольку заражение посто-2с ронней микрофлорой ведет с снижению выхода киспоты.
Использование дорогостоящего сахара-сырца приводит к повышению себестоимости целевого продукта.
Изобретение относится к микробиологической промышленности, а именно к способу производства итаконовой кислоты, используемой для изготовления моющих средств, ионитов, инсектицидов, присадок, красителей и ряда сложных органических соединений. (53) УДК 661. 733,547.
732 379 сбор мицелия по окончании ферментации.
Поставленная цель достигается тем, что в качестве источника углерода используют технический гликокол в количестве 50-759 в пересчете на сахаристые вещества.
Смесь сахара-песка 35 r, технического гликокола, отмытого от хлоридов 35 г, аммиачной селитры 2,5 г, кукурузного экстракта 0,2 г, цинка сернокислого 0,0044 r калия фосфорно-кислого однозамещенного 0,001 r помещают в колбу на 1 л, доводят до метки водопроводной водой и тщательно перемешивают, Подкисляют концентрированной азотной кислотой до рН 2,1 (предел 2,02,3), закрывают ватно-марлевой пробкой и стерилизуют (на электроплитке о кипятят 10 мин) . Охлаждают до 40 С и разливают в стерильные стаканы, 20 предварительно обработав инструменты и рабочий1 ci oë 70%-ным спиртом гидролизным высшей очистки, Параллельно готовят контрольный раствор, используя 70 г/л .сахара-песка и те же количества остальных реактивов, но без добавки гликокола °
Разливают питательно-бродильные растворы в стерильные стаканы .по четыре стакана на каждый опыт (четыре параллели) ° Растворы разливают быстро, обжигая над спиртовкой края колб, стаканов и цилиндров. Раствор из цилиндра выливают в каждый стакан по
170 мл, чуть приподнимая края ватником.
Затем быстро над горячей спиртовкой и факелом производят посев спор гриба AspergiIIus terreus с помощью пульверизатора. Стаканы, закрытые 40 ватником, ставят на протертый спиртом поднос, заносят в термокамеру и ставят на стеллажи. (При заходе в термокамеру соблюдаются все правила стерильности) . 45
Термокамера предназначена для проведения ферментации (сбраживания) бродильных растворов в лабораторных услови ях .
В термокамере поддерживают постоянную температуру 35-37 С. 3-кратный обмен воздуха по объему камеры.
После сформировывания нормального мицИлия (через двое суток на третьи) производят долив раствора под пленку целия.
55 я этого готовят по 2 л испытуемого и контрольного растворов.
Контрольный раствор, используемый для долива содержит сахар-песок кристаллический, пищевой 120 г/л, <) магний хлористый 0,75 г/л и азотную кислоту до рН 2,1.
Подготовку растворов для долива и их стерилизацию производят, как и приготовление растворов при наливе. о
Затем растворы охлаждают до 30-32 С т.е. ниже температуры, чем при наливе, чтобы не обжечь живой мицелий.
Долив производят в термокамере стерильно. Для этого со стаканов снимают ватники и быстро, но осторожно, наклонив и поворачивая стакан, чтобы не повредить мицелий на поверхности, производят долив до
340 мл в каждый стакан, что соответствует высоте слоя 8 см.
В течение последующих дней визуально наблюдают за ростом мицелия.
Если в каком-либо стакане появится заражение, его накрывают ватйиком, выносят из термокамеры и автоклавируют.
Во время ферментации заражения и,спытуемых образцов не было.
Иицелий серовато-белого цвета мелко извилистый, эластичный, тонкий, мало биомассы, расхождения в характеристиках мицелия в параллелях опыта нет.
После первых анализов иэ термокамеры (на. восьмые-девятые сутки) определяют возможность проведения дополнительного долива (подлив под мицелий) .
В случае плотного незараженного мицелия и при нормальном кислотообразовании (определяют на анализу пробы при заходе) делают подлив следующего состава, мл/л: сахар-песок 25, гликокол 25.
Спустя 13-15 суток от начала брожения цикл кислотообразования заканчивают.
По окончании опыта сброженный раствор из каждого стакана сливают отдельно и проводят контрольные анализы.
Количественное опредеЛение содержания итаконовой кислоты ведут по методу Фридкина, основанному на изменении поглощения брома итаконовой кислотой в забуферной бромной воде; определение общей кислотности — по методу нейтрализации в сброженном растворе итаконовой кислоты 0,1 N н. едким натром в присутствии фенолфталеина; определение сахара — по методу окисления сахара испытуемого раствора в щелочной среде окисью меди путем обратного титрования (реактив-окислитель, содержащий медь, Фелингова жидкость).
Источник