2)Показать этажи таза. Синтопию органов малого таза. Зоны «хирургического» риска.
Большой таз образован позвоночником и крыльями подвздошных костей. В нем содержатся органы брюшной полости: слепая кишка с червеобразным отростком, сигмовидная кишка, петли тонкой кишки.
Малый таз представляет собой полость цилиндрической формы и имеет верхнее и нижнее отверстия. Верхняя апертура таза представлена пограничной линией. Нижняя апертура таза ограничена сзади копчиком, по бокам — седалищными буграми, спереди — лонным сращением и нижними ветвями лобковых костей. Внутреннюю поверхность таза выстилают пристеночные мышцы: подвздошно- поясничная (m. iliopsoas), грушевидная (m. piriformis), внутренняя запирательная (m. obturatorius internus). Грушевидная мышца выполняет большое седалищное отверстие. Над и под мышцей имеются щелевидные промежутки — над- и подгрушевидные отверстия (foramina supra — et infrapiriformes), через которые выходят кровеносные сосуды и нервы: верхняя ягодичная артерия в сопровождении вен и одноименного нерва через надгрушевидное отверстие; нижние ягодичные сосуды, нижний ягодичный, седалищный нервы, задний кожный нерв бедра, внутренние половые сосуды и половой нерв — через подгрушевидное отверстие.
Дно малого таза образуют мышцы промежности. Они составляют тазовую диафрагму (diaphragma pelvis) и мочеполовую диафрагму (diaphragma urogenitale). Диафрагма таза представлена мышцей, поднимающей задний проход, копчиковой мышцей и покрывающими их верхней и нижней фасциями диафрагмы таза. Мочеполовая диафрагма расположена между нижними ветвями лобковых и седалищных костей и образована глубокой поперечной мышцей промежности и сфинктером уретры с покрывающими их верхним и нижним листками фасции мочеполовой диафрагмы.
Полость малого таза делят на три этажа: брюшинный, подбрюшинный и подкожный (рис. 16.1).
Брюшинный этаж таза (cavum pelvis peritoneale) — верхний отдел полости малого таза, заключенный между париетальной брюшиной малого таза; является нижним отделом брюшной полости. Здесь
содержатся покрытые брюшиной органы или части органов малого таза. У мужчин в брюшинном этаже таза располагаются часть пря- мой кишки и часть мочевого пузыря. У женщин в этом этаже таза помещаются те же части мочевого пузыря и прямой кишки, что и у мужчин, большая часть матки, маточные трубы, яичники, широкие связки матки, верхняя часть влагалища. Брюшина покрывает мочевой пузырь сверху, частью с боков и спереди. При переходе с передней брюшной стенки на мочевой пузырь брюшина образует поперечную пузырную складку (plica vesicalis transversa). Позади мочевого пузыря у мужчин брюшина покрывает внутренние края ампул семявыносящих протоков, верхушки семенных пузырьков и переходит на прямую кишку, образуя прямокишечно-пузырное углубление (excavatio rectovesicalis), ограниченное по бокам прямокишечно-пузырными складками брюшины (plicae rectovesicales). У женщин при переходе с мочевого пузыря на матку и с матки на прямую кишку брюшина обра- зует переднее — пузырно-маточное углубление (excavatio vesicouterina) и заднее — прямокишечно-маточное углубление, или дугласово пространство (excavatio rectouterina), которое является наиболее низким местом брюшной полости. Оно ограничено с боков прямокишечно-маточными складками (plicae rectouterinae), идущими от матки к прямой кишке и крестцу. В углублениях таза могут скапливаться воспалительные экссудаты, кровь (при ранениях органов брюшной полости и таза, разрывах трубы при внематочной беременности), желудочное содержимое (перфорация язвы желудка), моча (ранения мочевого пузыря). Скопившееся содержимое дугласова углубления можно определить и удалить пункцией заднего свода влагалища.
Подбрюшинный этаж таза (cavum pelvis subperitoneale) — отдел полости малого таза, заключенный между париетальной брюшиной таза и листком тазовой фасции, покрывающей сверху мышцу, поднимающую задний проход. В подбрюшинном этаже малого таза у мужчин находятся внебрюшинные отделы мочевого пузыря и прямой кишки, предстательная железа, семенные пузырьки, тазовые отделы семя- выносящих протоков с их ампулами, тазовые отделы мочеточников, а у женщин — те же отделы мочеточников, мочевого пузыря и прямой кишки, а также шейка матки и начальный отдел влагалища. Органы малого таза занимают срединное положение и не соприкасаются непосредственно со стенками таза, от которых их отделяет клетчатка. Кроме органов в этой части таза расположены кровеносные сосуды, нервы и лимфатические узлы таза: внутренние подвздошные артерии
с париетальными и висцеральными ветвями, париетальные вены и венозные сплетения органов таза (plexus venosus rectalis, plexus venosus vesicalis, plexus venosus prostaticus, plexus venosus uterinus, plexus venosus vaginalis), крестцовое нервное сплетение с возникающими из него нервами, крестцовый отдел симпатического ствола, лимфатические узлы, лежащие по ходу подвздошных артерий и на передней вогнутой поверхности крестца.
Пересечение мочеточников с подвздошными артериями относится к первой зоне «хирургического риска». В подбрюшинном отделе таза мочеточники спускаются вниз и впереди внутренних подвздошных артерии и впереди маточной артерии — у места ее отхождения (зона «хирургического риска). На уровне седалищной ости мочеточник поворачивает медиально и кпереди, проходит под основание широкой связки матки, где вторично пересекает маточную артерию, располагаясь сзади от нее, на расстоянии 1-3 см (наиболее важный перекрест мочеточника с маточной артерией — зона «хирургического риска»). Такая близость мочеточника и маточной артерии является важным анатомическим фактом, который необходимо учитывать пр выполнении операции в этой области, чтобы избежать травм мочеточника, особенно при выполнении эндоскопической надвлагалищной ампутации матки или экстерпации матки и др. На уровень расположения зон «хирургического риска» влияет изменчивость топографии маточной артерии, варианты положения мочевого пузыря относительно матки. При относительно низком расположении мочевого пузыря место перекреста мочеточника с маточной артерией приближено к ребру матки. При высоком расположении мочевого пузыря — на уровне дна матки или выше — перекрест мочеточника с маточной артерией будет находиться на некотором расстоянии от ребра матки.
3)Доступ к внутренней подвздошной артерии и ее перевязка.К внутренней подвздошной артерии можно проникнуть внутрибрю
шинным путем (срединной лапаротомией) или внебрюшинный.
Внебрюшинный доступ по Н. И. Пирогову. После обнажения наруж
ной подвздошной артерии, как описано выше, вдоль ее постепенно про
никают в клетчатку малого таза до бифуркации общей подвздошной
артерии и далее выделяют ствол внутренней подвздошной артерии.
Внебрюшинный доступ по Кремптону — В. Н. Шевкуненко. Другообраз-
ный разрез длиной 12—15 см начинают от конца XII ребра, ведут к перед
ней верхней подвздошной ости и выше нее на 3—4 см в медиальную сто
рону до латерального края прямой мышцы живота. Рассекают кожу, под
кожную клетчатку и поверхностную фасцию. Поверхностные сосуды пе
ревязывают. Послойно рассекают апоневроз наружной мышцы живота,
внутреннюю косую и поперечную мышцы. Разделяют хорошо заметную по
перечную фасцию и проникают в предбрюшинную клетчатку. Брюшинный
мешок вместе с мочеточником тупо отслаивают медиально и вверх. Раз
деляют клетчатку и, ориентируясь на медиальный край подвздошно-пояс
ничной мышцы, выделяют наружную подвздошную артерию у ее начала.
Внутренняя подвздошная артерия находится позади наружной на боковой
стенке малого таза.
Перевязка внутренней подвздошной артерии
Перевязку внутренней подвздошной артерии чаще всего производят при повреждении маточной артерии во время гипотонического кровотечения, разрыва матки или расширенной экстирпации матки с придатками. Для определения места прохождения внутренней подвздошной артерии используют мыс. Приблизительно на 30 мм в сторону от него пограничную линию пересекает внутренняя подвздошная артерия, спускающаяся в полость малого таза с мочеточником по крестцово-подвздошному суставу.
Для лигирования внутренней подвздошной артерии заднюю париетальную брюшину рассекают от мыса книзу и наружу, затем с помощью пинцета и желобоватого зонда тупым способом отделяют общую подвздошную артерию и, спускаясь по ней книзу, находят место ее деления на наружную и внутреннюю подвздошные артерии.
Над этим местом тянется сверху вниз и снаружи внутрь светлый тяж мочеточника, который легко узнать по розовому цвету, способности сокращаться (перистальтировать) при прикосновении и издавать характерный хлопающий звук при выскальзывании из пальцев. Мочеточник отводят медиально, а внутреннюю подвздошную артерию иммобилизируют от соединительнотканной оболочки, перевязывают кетгутовой или лавсановой лигатурой, которую подводят под сосуд при помощи тупоконечной иглы Дешана.
Подводить иглу Дешана следует очень осторожно, чтобы не повредить ее кончиком сопутствующую внутреннюю подвздошную вену, проходящую в этом месте сбоку и под одноименной артерией. Желательно лигатуру накладывать на расстоянии 15-20 мм от места деления общей подвздошной артерии на две ветви.
Безопаснее, если перевязывают не всю внутреннюю подвздошную артерию, а только ее переднюю ветвь, но ее выделение и подведение под нее нитки выполнить технически намного сложнее, чем сделать лигирование основного ствола. После подведения лигатуры под внутреннюю подвздошную артерию иглу Дешана вытягивают назад, а нитку завязывают.
После этого врач, присутствующий на операции, проверяет пульсацию артерий на нижних конечностях. Если пульсация есть, то внутренняя подвздошная артерия пережата и можно завязывать второй узел; если пульсация отсутствует, то, значит, лигирована наружная подвздошная артерия, поэтому первый узел необходимо развязать и опять искать внутреннюю подвздошную артерию.
4)Наложить надлобковый свищ мочевого пузыря. Надлобковая цистостомия производится для отведения мочи в обход мочеиспускательного канала при его ранении или препятствии нормальному оттоку мочи (аденома простаты, стриктура уретры и др.). Нижним срединным разрезом (не путать с нижней срединной лапаротомией!) рассекают кожу, подкожную клетчатку и белую линию живота. Раздвигают края прямых мышц, вскрывают поперечную фасцию. Рассекают висцеральную (предпузырную) фасцию, рыхлую околопузырную клетчатку с венами раздвигают и обнажают переднюю стенку мочевого пузыря, которая имеет характерный розоватый цвет. Между двумя пинцетами в мочевой пузырь вводят троакар. После удаления мандрена через троакар вводят катетер, тубус троакара удаляют. Катетер можно ввести и в небольшой разрез в стенке пузыря. На стенку пузыря около катетера накладывают 1-2 шва. Можно предварительно наложить на стенку мочевого пузыря кисетный шов, ввести катетер и шов затянуть. После этого рану послойно ушивают наглухо. Катетер фиксируют к коже одним швом.
Источник
Пациенты высокого периоперационного риска: два подхода к стратификации
И.Б. Заболотских, Н.В. Трембач
ФГБОУ ВО « Кубанский государственный медицинский университет » МЗ РФ , Краснодар , Россия
Для корреспонденции: Заболотских Игорь Борисович — д-р мед. наук, профессор, заведующий кафедрой анестезиологии, реаниматологии и трансфузиологии ФПК и ППС ФГБОУ ВО КубГМУ Минздрава России, Краснодар; e-mail: pobeda_zib@mail.ru
Для цитирования: Заболотских И.Б., Трембач Н.В. Пациенты высокого периоперационного риска: два подхода к стратификации. Вестник интенсивной терапии им. А.И. Салтанова. 2019;4:34–46. DOI: 10.21320/1818-474X-2019-4-34-46
Несмотря на успехи современной медицины, оперативные вмешательства не стали абсолютно безопасными, до сих пор частота послеоперационных осложнений и летальность остаются высокими, а послеоперационная летальность вышла на третье место среди причин смерти после ишемической болезни сердца и инсульта. Проблема оценки периоперационного риска постоянно привлекает внимание специалистов, поскольку выявление пациентов высокого риска является основой профилактики неблагоприятного исхода. Тем не менее, несмотря на всю важность, проблема эта далека от решения. Данный обзор посвящен двум подходам к стратификации риска: оценке риска летальности и риска осложнений. Анализ литературы показывает, насколько противоречивы оба этих подхода: отсутствие общепринятых определений летальности и осложнений, разнообразие критериев выделения высокого риска — все это приводит к отсутствию единого представления о высоком периоперационном риске. Существующие на данный момент системы оценки риска не лишены значительных недостатков и обладают ограниченной прогностической ценностью. Тем не менее в вопросе стандартизации исследований по стратификации риска наметился прогресс за последнее десятилетие: появляются единые определения летальности и осложнений, создаются национальные регистры — все это позволяет надеяться на улучшение качества прогноза.
Ключевые слова: стратификация периоперационного риска, летальность, осложнения
Поступила: 11.10.2019
Принята к печати: 05.11.2019
С медицинской точки зрения периоперационный риск — это многофакторное понятие, характеризующее вероятность развития неблагоприятного исхода (летального исхода, развитие осложнения) в течение определенного периода после операции или во время операции.
Для чего нужна точная оценка периоперационного риска? Во-первых, это помогает лучше информировать пациентов о необходимости и оправданности тех или иных решений в периоперационный период. Во-вторых, оценка периоперационного риска может помочь определить необходимость в дополнительном обследовании, предоперационной оценке легочной функции, стресс-тестах для оценки состояния сердечно-сосудистой системы и т. д. В европейских руководящих принципах оценка функционально- го состояния пациента является ключевым фактором, определяющим, рекомендуется ли дальнейшее специализированное предоперационное кардиологическое обследование [1]. В частности, показано, что пациенты, функциональные возможности которых были более 4 метаболических единиц при объектив- ном тестировании, имели более низкий периоперационный риск [2].
В-третьих, информация о риске может помочь определиться с тактикой периоперационного ведения. Обсервационные исследования показали, что периоперационное применение бета-блокаторов связано со снижением частоты осложнений у пациентов с более высоким сердечно-сосудистым риском, в то время как у лиц с низким риском может даже увеличить вероятность их развития [3, 4].
В-четвертых, информация о рисках может помочь указать требуемый уровень периоперационного мониторинга, а также то, требуется ли применение инвазивного контроля гемодинамики или перевод в отделение интенсивной терапии. Роль оценки периоперационного риска в выборе стратегии послеоперационного ведения является особенно важной, поскольку лечение в отделении реанимации является дорогостоящим, а свободные реанимационные койки — дефицитом. Расширенный и целенаправленный послеоперационный мониторинг способствует более раннему выявлению и своевремен- ному лечению осложнений, что позволяет улучшить результат лечения пациентов высокого риска [5]. Информация о риске неблагоприятных событий также может быть полезной для сравнения показателей деятельности отдельных специалистов и клиник [6, 7].
В настоящее время наиболее распространены два подхода к оценке риска: выделение группы пациентов с высоким риском летального исхода и пациентов с высоким риском развития осложнений (табл. 1).
Таблица 1. Критерии исходов хирургического лечения, детерминирующие высокий периоперационный риск
Исход
Примеры
Летальный исход во время анестезии Суточная летальность
Госпитальная летальность 30-дневная летальность 90-дневная летальность
Летальность в течение 1 года
□ Тромбоэмболия легочной артерии
□ Послеоперационная когнитивная дисфункция
□ Хирургические осложнения, специфичные для данного вида операции
□ Послеоперационная тошнота и рвота
Пациенты высокого периоперационного риска: стратификация по летальному исходу
Традиционно внимание анестезиологов-реаниматологов приковано к риску летального исхода, связанного с оперативным лечением. Успехи современной анесте- зиологии позволили значительно снизить риск анестезии по сравнению с прошлым веком, однако уровень периоперационной внутрибольничной летальности после плановых операций на данный момент составляет в среднем около 0,5 % [8]. Weiser et al. [9] подсчитали, что более 313 миллионов взрослых пациентов во всем мире ежегодно подвергаются оперативным вмешательствам. Таким образом, количество летальных исходов может в результате составлять несколько миллионов каждый год. Несмотря на успехи современной анестезиологии и периоперационной медицины, летальный исход в связи с операцией и анестезией продолжает быть крайне актуальной проблемой, занимая третье место среди всех причин смерти [10].
В определении периоперационной летальности нет единого подхода, в частности, в различных исследованиях под этим понятием подразумевают летальный исход в разные сроки периоперационного периода (табл. 2). Подобные разночтения в понятии летальности создают трудности при сравнении данных различных исследований и ведут к потенциальным ошибкам в трактовке, поскольку летальность, ограниченная коротким сроком наблюдения, может не охватывать случаи, обусловленные отдаленными последствиями операции и анестезии, а долгосрочный летальный исход может быть вызван причинами, не связанными с проведенным лечением.
Таблица 2. Временные характеристики периоперационной летальности
Срок летального исхода
Частота летальности,
Источник
В ходе анестезии
В течение 5 суток
В течение 6 суток
В течение двух лет
Один из наиболее распространенных способов оценки периоперационного риска — шкала физического статуса ASA — основан на субъективном мнении врача относительно общего состояния здоровья пациента. Известно, что эта шкала в высокой степени субъективна и не включает хирургические риски [19]. Многочисленные исследования показали, однако, увеличение летальности с увеличением класса по ASA (табл. 3).
Таблица 3. Влияние физического статуса на летальность
Класс
Летальность, %
Госпитальная
n = 6300
[20]
7-дневная
n = 897,733
[21]
30-дневная
n = 2,297,629
[22]
30-дневная
n = 1206
[17]
В настоящее время на основании оценки физического статуса пациентов высокого риска выделяют эмпирически — с 3-го класса и выше. Анализ, представленный в таблице, показывает, что с ухудшением статуса до 3-го класса происходит скачкообразное увеличение летальности. Следует отметить, что применение указанной системы приводит к выделению значительной части пациентов (до 58 %) в группу высокого риска, летальность в которой составляет 7,7 % [17].
Работа Visnjevac [23] показала, что разделение классов на подклассы по наличию функциональной зависимости (способности к самообслуживанию и зависимости от посторонней помощи) значительно изменяет структуру летального исхода на всех этапах 10-летнего наблюдения, начиная с 1-го месяца. Таким образом, внутри одного класса популяция крайне неоднородна и риск находится под влиянием такого фактора, как функциональная зависимость.
Несмотря на свою субъективность и неоднородность групп, шкала ASA демонстрирует приемлемую прогностическую ценность в оценке риска летального исхода (табл. 4).
Таблица 4. Прогностическая ценность шкалы ASA в оценке риска летальности
Летальность
Площадь под ROC-кривой
Источник
Работа Shoemaker [27] убедительно показала эффективность целенаправленной интенсивной терапии в группе риска, имеющей конкретные критерии: пред- шествующие тяжелые кардиореспираторные заболевания (инфаркт миокарда, хроническая обструктивная болезнь легких, инсульт), заболевания сосудов на последних стадиях, включая аорту, возраст более 70 лет с ограничением функциональных резервов одного или более органов, операции по поводу карциномы, абдоминальные «катастрофы» на фоне нестабильной гемодинамики (например, перитонит), массивная кровопотеря (более 8 ЕД крови), септицемия, дыхательная недостаточность, острая почечная недостаточность. Госпитальная летальность в группе риска составила 28 %.
Сопоставимые цифры летальности при применении указанных критериев получили Wilson [28] и Lobo [29], при этом в группах пациентов, интенсивная терапия которых была оптимизирована, получено снижение как госпитальной (с 17 до 3 %), так и 30-дневной (с 33 до 15,7 %) летальности.
Некоторые из интегральных шкал периоперационного риска были первоначально разработаны для других целей и впоследствии адаптированы к прогнозированию периоперационного риска. Индекс коморбидности Чарлсона, предлагаемый для прогнозирования кратко- срочных послеоперационных исходов после хирургических вмешательств, первоначально был разработан для предсказания долгосрочной летальности среди стационарных больных [30] и лишь затем валидизирован для прогноза долгосрочной летальности у пациентов с сахарным диабетом и гипертонической болезнью после плановых оперативных вмешательств [31].
Исследования, направленные на изучение вклада коморбидности в развитие неблагоприятного исхода и применявшие шкалу Чарлсона, выявили значительную корреляцию между летальностью и баллами по шкале. При этом 30-дневная летальность значительно увеличивалась у пациентов с количеством баллов более 4 [16], что позволило выделить группу риска с летальностью 14,9 %. В целом пациенты группы высокого периоперационного риска при использовании этой шкалы составляют 26 % всех пациентов и в структуре летальности занимают 91 %. Прогностическая ценность шкалы в прогнозировании летальности колеблется от отсутствия таковой до хорошей (табл. 5).
Таблица 5. Прогностическая ценность шкалы Чарлсона в оценке риска летальности
Летальность
Площадь под ROC-кривой
Источник
Одной из шкал, непосредственно разработанных для оценки риска летального исхода и развития послеоперационных осложнений, является шкала POSSUM (Physiological and Operative Severity Scoring System for Enumeration of Morbidity and Mortality). В ее основе лежат 12 параметров, которые необходимо регистрировать в предоперационный период, включая возраст, наличие симптомов кардиореспираторных заболеваний и некоторых лабораторных маркеров. Уравнение регрессии, включающее все переменные, позволяет рассчитать риск госпитальной летальности у конкретного пациента. Эмпирически была выделена группа высокого периоперационного риска выше 5 %. Анализ показал, что данному критерию соответствовали примерно 10 % всех пациентов; при этом госпитальная летальность составила около 12 % (табл. 6).
Таблица 6. Летальность в группе пациентов высокого риска по шкале POSSUM
Пациенты высокого риска,%
Госпитальная летальность в группе риска, %
Вклад высокого риска в общую летальность, %
Источник
В настоящее время известно несколько модификаций этой шкалы, в зависимости от области хирургии. Специфические шкалы показывают лучшую прогностическую ценность в оценке риска летальности, чем исходная шкала (табл. 7).
Таблица 7. Прогностическая ценность модификаций шкалы POSSUM в оценке риска летальности после операций по поводу рака желудка
Шкала
Площадь под ROC-кривой
0,62 (95% ДИ 0,73–0,81)
0,76 (95% ДИ 0,44–0,71)
0,88 (95% ДИ 0,81–0,95)
Шкала P-POSSUM, разработанная в Великобритании, была затем валидизирована в нескольких странах: Японии, Австралии и Италии. Данная модификация является наиболее часто используемой моделью. С одной стороны, шкала обладает высокой точностью. Так, два исследования, изучавшие 30-дневную летальность после обширных оперативных вмешательств, выявили высокую прогностическую значимость шкалы [36, 37] (AUROC 0,9 и 0,92), Donati et al. получили подобные данные для госпитальной летальности (AUROC 0,91) [25]. Однако у шкалы есть недостатки — она включает в себя интраоперационные факторы и потому не может считаться предоперационным методом оценки риска: не- которые переменные достаточно субъективны, а их количество велико (18 параметров).
Шкала хирургического риска (Surgical Risk Scale) до недавнего времени наряду с P-POSSUM являлась одной из наиболее часто используемых в оценке риска неблагоприятного исхода. Заключая в себе данные о тяжести операции, виде операции и физическом статусе по ASA (в сумме от 3 до 14 баллов), шкала удобна в применении в предоперационный период. Два исследования показали хорошую прогностическую ценность в оценке риска 30-дневной летальности (AUROC — 0,85 и 0,89) [36, 37] и одно — в оценке госпитальной летальности (AUROC 0,95) [24]. Тем не менее применение шкалы ASA приводит к некоторой субъективизации, а классификация тяжести операций трудна в рутинном использовании. Наконец, шкала не была валидизирована на большой популяции.
Шкала POSPOM (Preoperative Score to Predict Postoperative Mortality) является одной из наиболее со- временных систем оценки риска послеоперационной летальности [38]. В основу модели легли данные почти трех миллионов пациентов из 479 центров, при этом валидизация проводилась на схожей по численности когорте из тех же 479 центров. Оценка включала в себя как факторы, обусловленные состоянием пациента, так и факторы, связанные с оперативным вмешательством. Авторы отметили, что летальность значительно возрастает у пациентов с количеством баллов более 30. На основании этого факта эмпирически было предложено выделить группу высокого периоперационного риска, включающую около 20 % всех пациентов, при этом 30-дневная и 90-дневная летальность составила 3,9 и 11,3 % соответственно [39].
Kim M. et al. [40] на основании кластерного анализа выделили пять классов латентного риска, внутри которых пациенты обладают характерными свойствами (лабораторные показатели, гендерные характеристики, наличие сопутствующих заболеваний):
- Молодые ( 60 лет) пациенты с кардиоваскулярными заболеваниями, острой почечной недостаточностью, требующие экстренной хирургии.
- Пожилые (> 50 лет) пациенты с тяжелыми сопутствующими заболеваниями, функционально зависимые, на фоне сепсиса.
От 1-го к 5-му классу 30-дневная летальность увеличивается с 0,06 до 22 %, при этом система показывает хорошую прогностическую ценность (AUROC 0,87 при 95 % ДИ 0,866–0,872), а включение в прогностическую модель функционального класса по ASA и характеристик хирургического вмешательства увеличивает ценность еще больше (AUROC 0,915 при 95% ДИ 0,913–0,917).
Еще одной разработанной не так давно системой оценки периоперационного риска является шкала, полученная в результате анализа результатов лечения 211 тысяч пациентов из 250 госпиталей США в рамках национальной программы по улучшению качества хирургической помощи (NSQIP). Целью данной про- граммы служили выявление факторов риска 30-дневной летальности после оперативного вмешательства и раз- работка калькулятора расчета ее риска. В результате анализа более миллиона анестезий такой калькулятор был создан и в настоящее время является системой оценки 21 предоперационного фактора, которые компьютерная программа включает в уравнение логистической регрессии. Результат представляет собой риск 30-дневного летального исхода, выраженный в процентах [41]. Рассчитанный индивидуально риск сравнивается с частотой летальности, полученной в исследуемой популяции (в настоящее время в регистре содержится информация о более чем миллионе пациентов из почти 400 клиник со средней летальностью 1,6 %), таким образом, пациента с риском летального исхода более 1,6 % относят к пациентам высокого риска. Разработанная модель является надежным инструментом оценки риска летальности (C-statistic = 0,944).
Исходя из вышесказанного, становятся понятными различия в полученных цифрах летальности, на которую оказывают влияние принцип выделения группы риска, период, в течение которого регистрируется летальный исход, а также год проведения исследования (табл. 8).
Таблица 8. Летальность в группе высокого риска в зависимости от применяемого критерия
Шкалы
Летальность в группе высокого риска, %
Год
Источник
Исходя из вышесказанного, согласно данному под- ходу, высокий периоперационный риск — это высокая вероятность развития летальности у конкретно- го пациента, определенная одной из систем оценки. И 30-дневная, и госпитальная летальность являются приемлемыми и надежными определениями неблагоприятного исхода. Стратификация пациентов высокого периоперационного риска чаще всего основана на эмпирическом выборе порогового значения шкал ASA-PS, POSSUM, POSCOM и NSQIP, выше которого пациент относится к группе высокого риска, при этом за 30 лет «пороговая» величина послеоперационной летальности в группах высокого риска существенно снизилась. При верификации пациентов высокого периоперационного риска целесообразно указывать шкалу, на основании которой определен риск летального исхода, а для уточнения степени высокого риска важно использовать валидизированные с этой целью факторы.
Пациенты высокого периоперационного риска: стратификация по послеоперационным осложнениям
Вторым подходом к верификации высокого периоперационного риска является оценка вероятности развития существенных и второстепенных послеоперационных осложнений. При этом оценивается как риск осложненного послеоперационного периода в целом (наличие одного или нескольких осложнений, различия по тяжести осложнений), так и риск конкретного осложнения. Частота послеоперационных осложнений колеблется в широком диапазоне, составляя от 3 до 18 % [42–44]. Различия в данных объясняются отсутствием четких определений осложнений и различием в дизайне исследований. В работах, посвященных анализу развития осложнений и выявлению группы риска, также отсутствует единый подход к регистрируемым исходам.
Существенное количество исследований регистрируют некоторый перечень осложнений [27–29] или композитных исходов [40], иногда независимо от тяжести. Ряд авторов выделяет группы осложнений, что позволяет отделить риск серьезных жизнеугрожающих событий [17, 45]. В то же время нередко регистрируемые исходы имеют различное определение от исследования к исследованию, а иногда оно и вовсе отсутствует, что вызывает затруднения в оценке частоты исходов и факторов риска, а также делает сложным сравнение разных исследуемых выборок.
Вид осложнения и его тяжесть — основные характеристики исхода. К настоящему времени разработано несколько классификаций осложнений. В 1992 г. Clavien et al. предложили классификацию тяжести осложнений, состоящую из 4 степеней [46]. В 2005 г. Dindo et al. [47] предложили модификацию этой шкалы. Второй пересмотр расширил классификацию до 5 классов, содержащих 7 уровней тяжести (табл. 9). Вторая измененная классификация добавила точности, включая информацию о том, было ли вмешательство по поводу осложнения связано с общей анестезией, была ли необходима госпитализация в отделение интенсивной терапии по поводу органной недостаточности, и если да, то осложнения подразделялись по степени наличия органной недостаточности.
На основе анализа многочисленных исследований o применении шкалы Clavien—Dindo авторы системы пришли к заключению, что система требует изменений.
Таблица 9. Классификация осложнений по тяжести Clavien—Dindo
Степень тяжести
Критерий
Любые отклонения от нормального послеоперационного течения, не требующие медикаментозного лечения или хирургического, радиологического вмешательства. Разрешается терапевтическое лечение: антипиретики, анальгетики, диуретики, электролиты, физиотерапия. Лечение раневой инфекции
Требуется лечение в виде гемотрансфузии, энтерального или парентерального питания
Требуется хирургическое, эндоскопическое или радиологическое вмешательство без общего обезболивания
Вмешательство под общим обезболиванием
Жизнеугрожающие осложнения (включая осложнения со стороны центральной нервной системы), требующие интенсивной терапии, наблюдения в реанимации, резекции органа. Недостаточность одного органа
Цель этих изменений заключается в том, чтобы создать классификацию, которая могла бы легко использоваться как для небольших исследований, так и для более крупных, чтобы она могла стать более понятной и удобной для создания автоматической отчетности [48]. Результатом этой работы стала гибкая классификационная система, называемая системой Accordion (иногда именуемая классификацией Clavien—Dindo—Strasberg), включающая сокращенную и расширенную версии. Первая состоит из 4 степеней тяжести и предназначена для небольших исследований, вторая — из 6 степеней и разработана для больших исследований, особенно включающих обширные оперативные вмешательства. Расширенная классификация более подробно описывает тяжелые осложнения, кроме того, в ней определены четкие критерии органной дисфункции, что соответствует 5-й степени тяжести [48]. Несмотря на то что классификация уже 10 лет с успехом применяется, по- пытки усовершенствовать и оптимизировать ее продолжаются до настоящего времени [49].
Учитывая потребность в единстве определений, в первую очередь для будущих исследований по оценке риска осложнений, в 2016 г. совместной рабочей группой Европейских обществ по анестезиологии и по интенсивной терапии была разработана классификация послеоперационных исходов [50]. Классификация послеоперационных исходов представлена 22 индивидуальными осложнениями с подробным описанием критериев, с помощью которых необходимо установить тот или иной диагноз, а также оценить тяжесть осложнения:
1.1 Острое повреждение почек
1.2 Острый респираторный дистресс-синдром
1.3 Несостоятельность анастомоза
1.5 Остановка сердца
1.6 Кардиогенный отек легких
1.7 Тромбоз глубоких вен
1.9 Желудочно-кишечное кровотечение
1.10 Инфекция без определенного источника
1.11 Лабораторно подтвержденная бактериемия
1.12 Инфаркт миокарда
1.13 Повреждение миокарда после некардиальных операций
1.15 Паралитическая кишечная непроходимость
1.16 Послеоперационное кровотечение
1.17 Тромбоэмболия легочной артерии
1.18 Острое нарушение мозгового кровообращения
1.19 Послеоперационная раневая инфекция (поверхностная)
1.20 Послеоперационная раневая инфекция (глубокая)
1.21 Послеоперационная инфекция (орган/пространство)
1.22 Инфекция мочевыводящих путей
Кроме того, классификация выделяет 4 составные характеристики послеоперационного исхода: большие кардиоваскулярные события, послеоперационные легочные осложнения, анкетирование послеоперационной заболеваемости, качество восстановления. Каждый исход содержит в себе несколько осложнений с критериями их диагностики. Для оценки степени тяжести осложнений рекомендуется применять классификацию Clavien в любой модификации.
Разработка данных дефиниций позволила унифицировать процесс регистрации исходов в проводимых в настоящее время эпидемиологических исследованиях [8, 51]. Тем не менее такой подход имеет свои слабые стороны, поскольку строгое соблюдение номенклатуры приводит к недооценке частоты встречаемости некоторых осложнений вследствие отсутствия в некоторых клиниках необходимых ресурсов для подтверждения соответствия развившегося события критериям исхода [51].
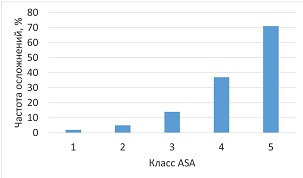
Шкала ASA применялась также для оценки риска осложнений. Ухудшение физического статуса по ASA коррелирует с увеличением риска периоперационных осложнений. Так, в исследовании Hackett et al. [22] участвовало более двух миллионов пациентов (11,7 % операций — экстренные) в некардиальной хирургии. Авторы регистрировали послеоперационные осложнения, развившиеся в течение 30-дневного периода (одно осложнение и более: тромбоз глубоких вен; тромбоэмболия легочной артерии; дыхательная недостаточность, потребовавшая реинтубации; продленная искусственная вентиляция легких; почечная недостаточность; кома; инсульт; остановка кровообращения; инфаркт миокарда; пневмония; инфекция мочевыводящих путей; сепсис; септический шок). В результате анализа количество осложнений прогрессивно возрастало с увеличением класса (рис. 1).
Рис. 1. Частота послеоперационных осложнений в зависимости от физического статуса (цит. по [22])
Наиболее частыми осложнениями являлись: дыхательная недостаточность, потребовавшая проведения продленной искусственной вентиляции легких (> 48 ч) (15,9 %) или реинтубации (10 %), сепсис (15 %), пневмония (12,7 %) и инфекция мочевыводящих путей (14 %).
Следует отметить, что частота осложнений у пациентов 2-го класса ASA и более была в 4 раза выше (16,9 vs 4,3 %); 74 % всех осложнений развились именно в группе высокого риска, при этом данная тенденция оставалась неизменной независимо от вида оперативного вмешательства [22].
Частота периоперационных осложнений всех классов по классификации Clavien—Dindo была выше в группе пациентов со статусом по ASA ≥ 3 (p 48,9*
**Тяжелые осложнения (3–5-я степень по Clavien—Dindo).
Существует два фактора, обусловливающих клиническую ценность шкал оценки периоперационного риска — прогностическая ценность и удобство в еже- дневной рутинной клинической практике. Очевидно, что прогностическая ценность должна стремиться к 100 %, однако очень часто ее увеличение перевешивается трудностью применения. Системы оценки риска, заключающие в себе большое количество независимых предикторов неблагоприятного исхода, обычно более точны в оценке риска, но с большим трудом могут быть встроены в рутинную предоперационную оценку. Более того, клинический опыт подсказывает, что специалисты неохотно пользуются «громоздкими» формулами [62], отдавая предпочтение простым способам стратификации высокого периоперационного риска. Очевидным доказательством этого тезиса является не снижающаяся популярность такой субъективной и не самой точной шкалы, как шкала ASA.
Из вышесказанного следует, что под периоперационным риском также подразумевают вероятность развития послеоперационных осложнений. Основной проблемой, связанной с данным подходом, является отсутствие единой системы классификации и определений послеоперационных осложнений. В настоящее время наиболее часто применяются классификация ESA- ESICM и классификация NSQIP, оценку тяжести осложнений рекомендуется проводить с помощью шкалы Clavien—Dindo. Для определения высокого риска чаще всего применяются те же «пороговые» значения, что и в случае с летальностью, однако такой подход обладает недостатками. Известные системы прогнозирования риска, демонстрировавшие на момент создания хорошую прогностическую ценность в оценке риска осложнений, в настоящее время по ряду причин уже не обладают прежней ценностью; выделение с их по- мощью групп риска вызывает трудности и чревато как недооценкой, так и переоценкой риска. Наибольшей точностью обладают системы, включающие в себя комбинации факторов риска, связанных с состоянием пациента и характеристиками оперативного вмешательства.
Заключение
Оценка периоперационного риска является одним из наиболее важных элементов в работе врача, поскольку позволяет индивидуализировать и рационализировать периоперационное ведение пациента. Однако выявление пациента высокого риска — нетривиальная задача и сопряжено с рядом трудностей. Несмотря на интуитивную простоту понятия «периоперационный риск», каждый понимает под ним что- то свое, и причин этому несколько. Во-первых, отсутствует единый подход к определению исхода, как летальности, так и осложнений. Во-вторых, разработанные на одной когорте пациентов шкалы чаще всего не демонстрируют заявленную прогностическую ценность на другой. В-третьих, большая часть «пороговых» величин в системах оценки риска являются субъективными. Наконец, разработанные несколько десятилетий назад шкалы не отражают реальное состояние медицины, и их эффективность значительно ниже, чем в момент создания. Тем не менее попытки улучшить прогноз ведутся постоянно и небезуспешно. Разработка единых определений исхода, набор больших регистров, позволяющих получить достоверные предикторы неблагоприятного исхода, — все это перспективные направления, которые позволят в будущем точно сказать, кто такой пациент высокого риска.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Заболотских И.Б. — разработка плана статьи, литературный поиск, анализ литературных источников, редакция статьи, подготовка окончательного варианта работы; Трембач Н.В. — литературный поиск, анализ литературных источников, оформление окончательного варианта статьи.
Источник