- Способы решения задач по химии для обучающихся 9 класса материал для подготовки к егэ (гиа) по химии (9 класс) на тему
- Скачать:
- Предварительный просмотр:
- Задачи химия 9 класс способы решения
- Алгоритм № 2. Вычисление объема вещества по известной массе другого вещества, участвующего в реакции.
- Алгоритм № 3. Расчет по химическому уравнению объемных отношений газов
- Алгоритм № 4. Вычисление относительной плотности газа по другому газу
- Алгоритм № 5. Вычисление массовой доли вещества в растворе
- Алгоритм № 6. Вычисление массы вещества в растворе по массе раствора и массовой доле растворенного вещества.
- Алгоритм № 7. Расчеты по термохимическим уравнениям. Вычисление количества теплоты по известной массе вещества.
- Алгоритм № 8. Расчеты по термохимическим уравнениям. Вычисление массы вещества по известному количеству теплоты.
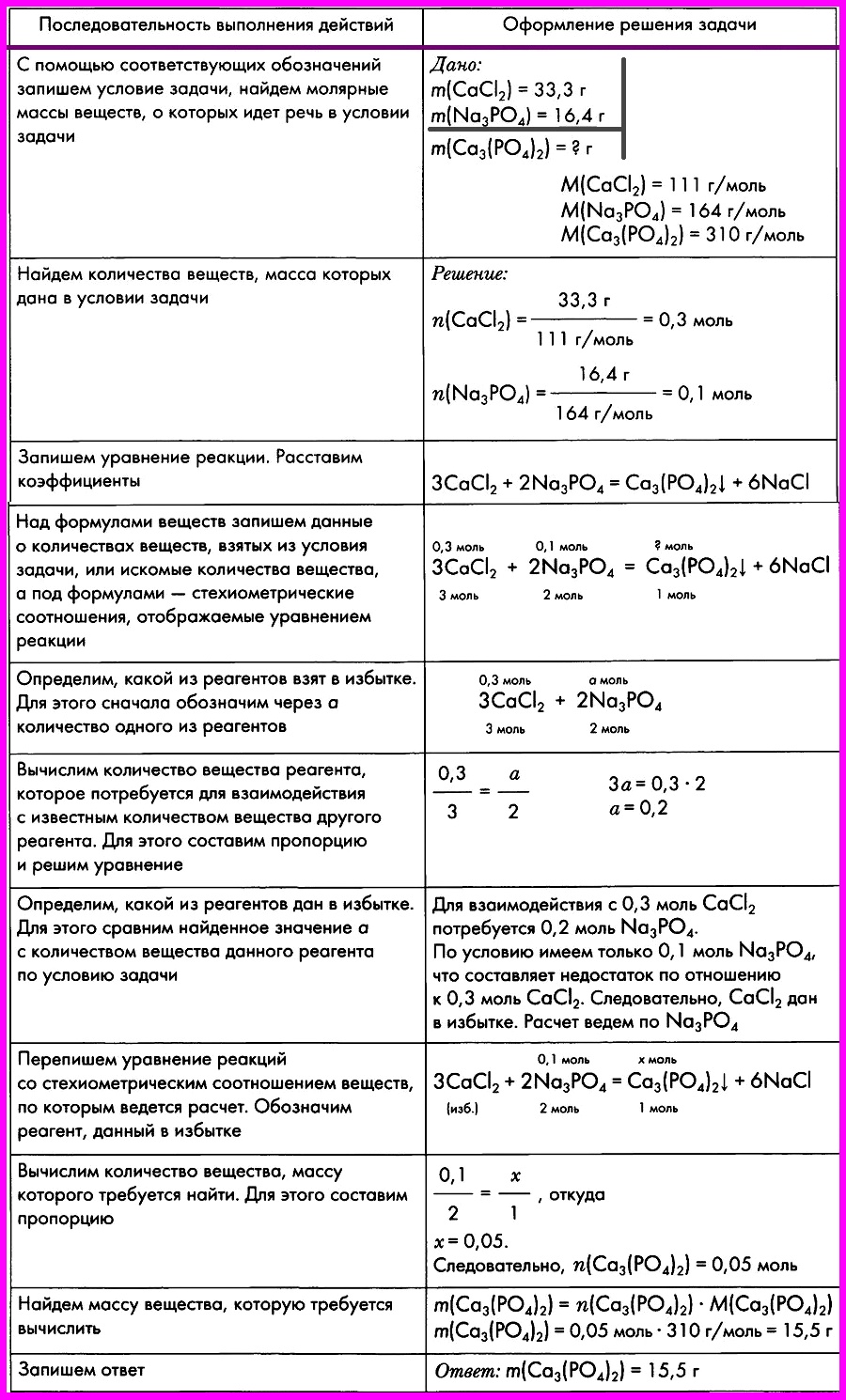
- Алгоритм № 9. Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке.
- Разбор заданий ОГЭ по химии
- 1 вид
- Решение задач по химии 9 класс материал для подготовки к егэ (гиа) по химии (9 класс) на тему
- Скачать:
- Предварительный просмотр:
- Подготовка к ОГЭ по химии 9 класс
- Решение задач на расчёт по уравнению реакции.
Способы решения задач по химии для обучающихся 9 класса
материал для подготовки к егэ (гиа) по химии (9 класс) на тему
ВЫЧИСЛЕНИЕ МАССЫ ОДНОГО ИЗ ИСХОДНЫХ ВЕЩЕСТВ, НЕОБХОДИМОЙ ДЛЯ ПОЛУЧЕНИЯ УКАЗАННОГО КОЛИЧЕСТВА ПРОДУКТА РЕАКЦИИ
Скачать:
| Вложение | Размер |
|---|---|
| vychislenie_massy_odnogo_iz_iskhodnykh_veshchestv.doc | 82.5 КБ |
Предварительный просмотр:
ВЫЧИСЛЕНИЕ МАССЫ ОДНОГО ИЗ ИСХОДНЫХ ВЕЩЕСТВ, НЕОБХОДИМОЙ ДЛЯ ПОЛУЧЕНИЯ УКАЗАННОГО КОЛИЧЕСТВА ПРОДУКТА РЕАКЦИИ
Задача 1. Вычислить массу раствора серной кислоты с массовой долей вещества 20%, необходимую для получения сульфата бария количеством 0,2 моля при взаимодействии её с избытком раствора хлорида бария.
w(H 2 SO 4 )=20% = 0,2 моль
v(BaSO 4 ) = 0,2 моль
m р-ра (H 2 SO 4 ) — ?
M(H 2 SO 4 )=98 г/моль
M(BaSO 4 )=233 г/моль
При взаимодействии раствора хлорида бария образуется сульфат бария BaSO 4 , который выпадает в виде белого кристаллического осадка. Этот осадок не растворим в воде и кислотах, поэтому указанная реакция является качественной на серную кислоту и её соли — сульфаты, а также на соли бария.
Решение задачи основано на использовании уравнения реакции. Рассмотрим два способа решения задачи.
I способ. Используем при решении задачи величину v — количество вещества и уравнение химической реакции:
Из уравнения химической реакции определим количество серной кислоты, необходимое для получения сульфата бария количеством 0,2 моль.
1 моль H 2 SO 4 (из уравнения реакции)
X моль H 2 SO 4 (из условия задачи)
Из этой пропорции находим неизвестную величину:
x = 0,2 моль * 1 моль / 1 моль = 0,2 моль
То есть v(H 2 SO 4 ) = 0,2 моль
Рассчитаем теперь массу серной кислоты количеством 0,2 моль.
m(H 2 SO 4 ) = v(H 2 SO 4 ) * M(H 2 SO 4 ) = 0,2 моль * 98 г/моль = 19,6 г
m(H 2 SO 4 ) = 19,6 г
Найденная величина представляет собой массу чистой серной кислоты. По условию задачи необходимо вычислить массу её раствора.
Используя выражение массовой доли w = m в-ва / m р-ра * 100%, определим массу раствора серной кислоты:
m р-ра (H 2 SO 4 ) = m(H 2 SO 4 ) * 100% / w(H 2 SO 4 ) = 19,6 г * 100% / 20% = 98 г
Ответ: m р-ра (H 2 SO 4 ) = 98 г .
Расчеты по массе продукта реакции. Поэтому определим массу сульфата бария количеством 0,2 моль.
m(BaSO 4 ) = v(BaSO 4 ) * M(BaSO 4 ) = 0,2 моль * 233 г/моль = 46,6 г
Итак, M(BaSO 4 ) = 46,6 г
Используем уравнение химической реакции:
Источник
Задачи химия 9 класс способы решения
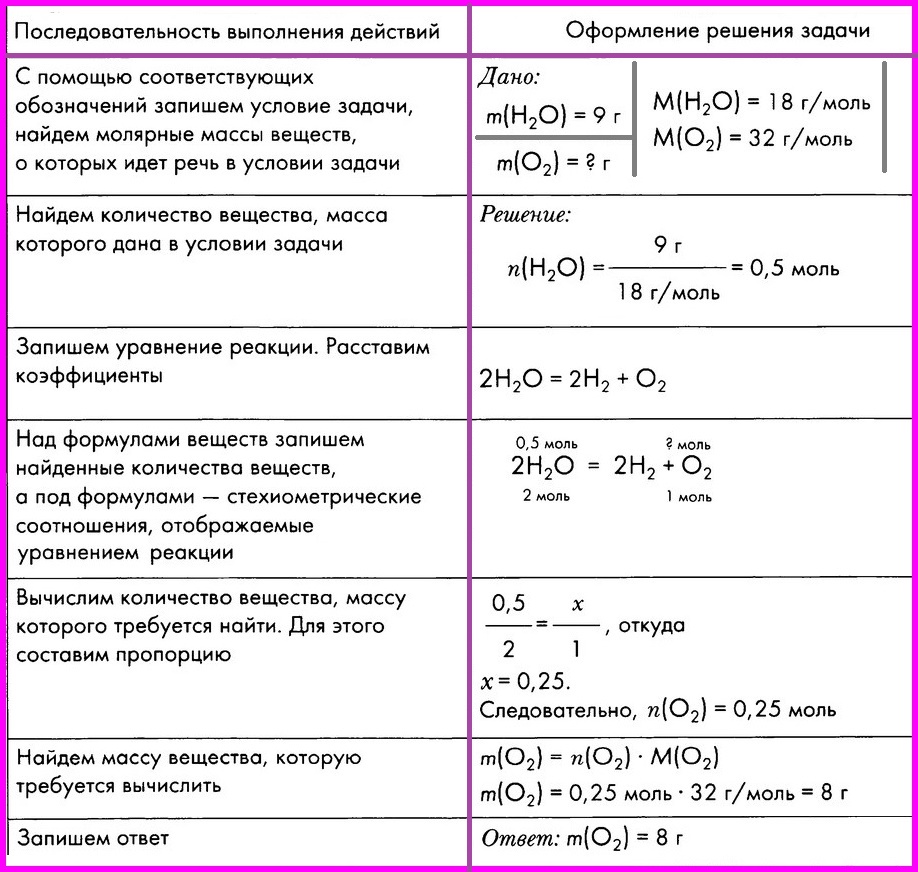
ЗАДАЧА: Вычислите массу кислорода, выделившегося в результате разложения порции воды массой 9 грамм.
Алгоритм № 2. Вычисление объема вещества по известной массе другого вещества, участвующего в реакции.
ЗАДАЧА: Вычислите объем кислорода (н.у.), выделившегося в результате разложения
порции воды массой 9 г.
Алгоритм № 3. Расчет по химическому уравнению объемных отношений газов
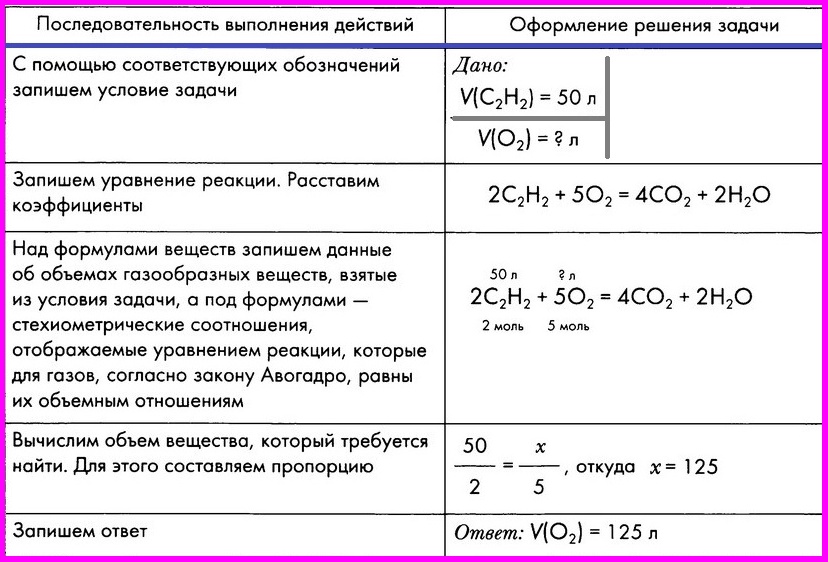
ЗАДАЧА: Вычислите объем кислорода, необходимого для сжигания порции ацетилена объемом 50 л.
Алгоритм № 4. Вычисление относительной плотности газа по другому газу
ЗАДАЧА: Вычислите плотность кислорода а) по водороду; 6) по воздуху.
Алгоритм № 5. Вычисление массовой доли вещества в растворе
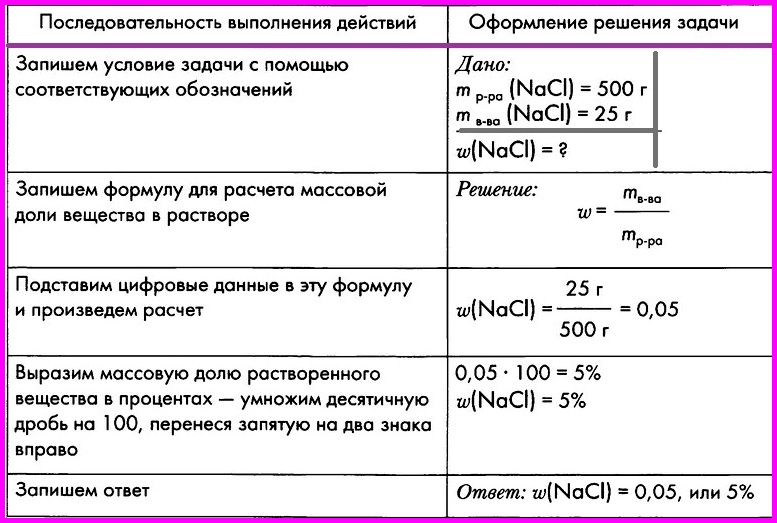
ЗАДАЧА: При выпаривании раствора массой 500 г образовалось 25 г кристаллической соли — хлорида натрия. Вычислите массовую долю соли в исходном растворе.
Алгоритм № 6. Вычисление массы вещества в растворе по массе раствора и массовой доле растворенного вещества.
ЗАДАЧА: Вычислите массу гидроксида натрия, необходимого для приготовления 400 г 20%-ного раствора гидроксида натрия.
Алгоритм № 7. Расчеты по термохимическим уравнениям. Вычисление количества теплоты по известной массе вещества.
ЗАДАЧА: По термохимическому уравнению 2Сu + O2 = 2СuO + 310 кДж вычислите количество теплоты, выделившейся в результате окисления порции меди массой 16 г.
Алгоритм № 8. Расчеты по термохимическим уравнениям. Вычисление массы вещества по известному количеству теплоты.
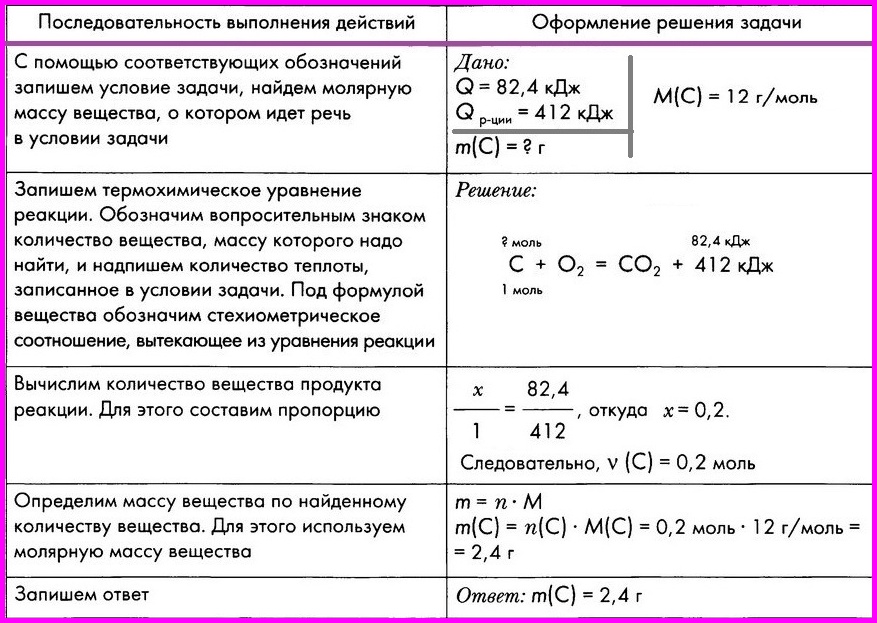
ЗАДАЧА: По термохимическому уравнению С + O2 = СO2 + 412 кДж вычислите массу сгоревшего угля, если количество теплоты, выделившееся в результате реакции, составляет 82,4 кДж .
Алгоритм № 9. Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке.
ЗАДАЧА: Смешали два раствора, один из которых содержал 33,3 г хлорида кальция, а другой — 16,4 г фосфата натрия. Вычислите массу образовавшегося фосфата кальция.
Вы смотрели Справочник по химии «Алгоритмы решения типовых задач». Выберите дальнейшее действие:
Источник
Разбор заданий ОГЭ по химии
Вопрос № 21 экзаменационных материалов ОГЭ по химии представляет собой задачу по уравнению химической реакции. В Спецификации контрольных измерительных материалов для проведения в 2018 году основного государственного экзамена по химии указаны следующие проверяемые умения и способы действий при выполнении данного задания: «Вычисление массовой доли растворенного вещества в растворе. Вычисление количества вещества, массы или объема вещества по количеству вещества, массе или объему одного из реагентов или продуктов реакции». Анализ демонстрационных работ и заданий открытого банка позволил выделить три разновидности задач, используемых в экзаменационных работах. При подготовке к ОГЭ решаю с учащимися примеры задач каждого вида и предлагаю для самостоятельного решения подобранные из открытого банка аналогичные задания. При решении задач по уравнениям химических реакций использую алгоритм, представленный в учебнике по химии 8 класса О.С.Габриеляна.
1 вид
Дана масса раствора продукта или одного из исходных веществ реакции. Вычислить массу (объем) исходного вещества или продукта реакции.
1 действие: вычисляем массу продукта или одного из исходных веществ реакции.
2 действие: вычисляем массу или объем исходного вещества по алгоритму.
Пример задачи: К раствору хлорида алюминия массой 53,2 г и массовой долей 5% прилили избыток раствора нитрата серебра. Вычислите массу образовавшегося осадка.
Источник
Решение задач по химии 9 класс
материал для подготовки к егэ (гиа) по химии (9 класс) на тему
ВЫЧИСЛЕНИЕ ВЫХОДА ПРОДУКТА РЕАКЦИИ В ПРОЦЕНТАХ ОТ ТЕОРЕТИЧЕСКИ ВОЗМОЖНОГО, ЕСЛИ ИЗВЕСТНЫ МАССЫ ИСХОДНОГО ВЕЩЕСТВА И ПРОДУКТА РЕАКЦИИ
Скачать:
| Вложение | Размер |
|---|---|
| vychislenie_vykhoda_produkta_reaktsii_v_protsentakh_ot_teoreticheski_vozmozhnogo.doc | 78.5 КБ |
Предварительный просмотр:
ВЫЧИСЛЕНИЕ ВЫХОДА ПРОДУКТА РЕАКЦИИ В ПРОЦЕНТАХ ОТ ТЕОРЕТИЧЕСКИ ВОЗМОЖНОГО, ЕСЛИ ИЗВЕСТНЫ МАССЫ ИСХОДНОГО ВЕЩЕСТВА И ПРОДУКТА РЕАКЦИИ
Задача 1. Через известковую воду, содержащую 3,7 г гидроксида кальция, пропустили углекислый газ. Выпавший осадок отфильтровали, высушили, взвесили. Его масса оказалась равной 4,75 г. Вычислить выход продукта реакции (в процентах) от теоретически возможного.
m[Ca(OH) 2 ] = 3,7 г
m(CaCO 3 ) = 4,75 г
w вых. (CaCO 3 ) — ?
M[Ca(OH) 2 ] = 74 г/моль
M(CaCO 3 ) = 100 г/моль
Известковая вода — это водный раствор гидроксида кальция Ca(OH) 2 . При пропускании через нее углекислого газа CO 2 выпадает осадок карбоната кальция с диоксидом углерода (качественная реакция на углекислый газ). Эту задачу можно решить либо с использованием величины количества вещества , либо через массы указанных веществ .
Определим количества приведенных в условии задачи веществ:
v[Ca(OH) 2 ] = m[Ca(OH) 2 ] / M[Ca(OH) 2 ] = 3,7 г / 74 г/моль = 0,05 моль;
v[Ca(OH) 2 ] = 0,05 моль
v(CaCO 3 ) = m(CaCO 3 ) / M(CaCO 3 ) = 4,75 г / 100 г/моль = 0,0475 моль;
v(CaCO 3 ) = 0,0475 моль
Запишем уравнение химической реакции:
Из уравнения химической реакции следует, что из 1 моль Ca(OH) 2 образуется 1 моль CaCO 3 , а значит, из 0,05 моль Ca(OH) 2 теоретически должно получиться столько же, то есть 0,05 моль CaCO 3 . Практически же получено 0,0475 моль CaCO 3 , что составит:
w вых. (CaCO 3 ) = 0,0475 моль * 100 % / 0,05 моль = 95 %
w вых. (CaCO 3 ) = 95 %
Ответ: выход карбоната кальция составляет 95 % от теоретически возможного.
Принимаем во внимание массу исходного вещества (гидроксида кальция) и уравнение химической реакции:
Рассчитаем по уравнению реакции, сколько теоретически образуется карбоната кальция.
100 г CaCO 3 (из уравнения реакции)
х г CaCO 3 (из условия задачи)
Отсюда х = 3,7 г * 100 г / 74 г = 5 г, m(CaCO 3 ) = 5 г
Это означает, что из данных по условию задачи 3,7 г гидроксида кальция теоретически (из расчётов) можно было бы получить 5 г карбоната кальция, а практически получено лишь 4,75 г продукта реакции. Из этих данных определим выход карбоната кальция (в %) от теоретически возможного:
5 г CaCO 3 составляют 100% — ный выход
4,75 г CaCO 3 составляют х %
x = 4,75 моль * 100 % / 5 г = 95 % ;
w вых. (CaCO 3 ) = 95 %
Ответ: выход карбоната кальция составляет 95 % от теоретически возможного.
Задача 2. При взаимодействии магния массой 36 г с избытком хлора получено 128,25 г хлорида магния. Определить выход продукта реакции в процентах от теоретически возможного.
m(Mg) = 36 г
m(MgCl 2 ) = 128,25 г
w вых. (MgCl 2 ) — ?
M(Mg) = 24 г/моль
M(MgCl 2 ) = 95 г/моль
Указанная масса (m = 128,25 г) продукта реакции MgCl 2 — это есть практически полученная масса вещества. Из 36 г магния теоретически можно получить больше хлорида магния, чем его получено. В задачах такого типа и требуется рассчитать, какую долю (в %) составляет практически полученная масса продукта реакции от той массы, которую можно было бы получить теоретически, т.е. из расчётов по уравнению реакции. Эту долю, выраженную в процентах, и называют выходом продукта от теоретически возможного.
Рассмотрим два способа решения этой задачи: с использованием величины количества вещества и массы вещества .
Из данных по условию задачи значений масс магния и хлорида магния рассчитаем значения количества этих веществ:
v(Mg) = m(Mg) / M(Mg) = 36 г / 24 г/моль = 1,5 моль; v(Mg) = 1,5 моль
v(MgCl 2 ) = m(MgCl 2 ) / M(MgCl 2 ) = 128,25 г / 95 г/моль = 1,35 моль;
v(MgCl 2 ) = 1,35 моль
Источник
Подготовка к ОГЭ по химии 9 класс
Решение задач на расчёт по уравнению реакции.
Для выполнения расчётов по уравнениям химических реакций необходимо учитывать коэффициенты, стоящие перед формулами реагентов и продуктов реакции, т.к. они связаны с количествами реагирующих веществ: отношение количества вещества к коэффициенту перед его формулой в уравнении химической реакции одинаково для всех участников реакции.
Объём любого газа пропорционален количеству вещества, т.е. коэффициенты в уравнении реакции показывают соотношения объёмов реагирующих и образовавшихся газообразных веществ.
Количество вещества n можно выразить через массу вещества, объём газообразного вещества или число частиц вещества:
n = m/M, где m — масса вещества, М — молярная масса (численно равна относительной молекулярной массе);
n = V/Vm, где V — объём газообразного вещества, Vm — молярный объём (Vm =
22,4 л/моль);
n = N/Na, где N — число частиц вещества (молекул или атомов), Na -постоянная Авогадро.
Единицы измерения основных величин:
количество вещества n — моль
масса m — г
объём V — л.
Иногда в задачах вместо массы вещества указаны массы раствора и массовая доля растворённого вещества. Следовательно, необходимо найти массу растворённого вещества прежде, чем находить его количество:
m (в-ва) = m (р-ра) * w (в-ва).
Если в задаче вместо массы раствора известен его объём и плотность, то для нахождения массы раствора необходимо воспользоваться формулой:
m (р-ра) = V (р-ра) * p (р-ра).
Нахождение искомых величин:
m = n*M
V = n*Vm
N = n* Na
m (р-ра) = m (в-ва)/w(в-ва)
w (в-ва) = m (в-ва)/ m (р-ра).
Алгоритм решения расчётных задач:
1. Внимательно прочитайте условие задачи. Выпишите числовые данные с указанием соответствующих величин (масса, объём, количество вещества и т.п.).
2. Сформулируйте вопрос задачи (какую величину требуется найти).
3. Составьте уравнение реакции.
4. Выразите количество вещества, для которого имеются числовые данные в задаче, используя необходимые формулы, связывающие количество вещества n с массой, объёмом или числом частиц вещества.
5. Используя стехиометрические коэффициенты уравнения реакции, выразите количество искомого вещества через количество известного вещества.
6. Найдите искомую величину, используя полученное количество вещества.
7. Запишите полученный ответ.
Пример: Какая масса осадка образуется при взаимодействии избытка хлорида цинка с 160г раствора гидроксида натрия с массовой долей растворённого вещества 15%?
Дано:
m (р-ра NaOH)=160г
w (NaOH)= 15% или 0,15
Найти: m (Zn(OH)2)
Решение:
2NaOH + ZnCl2 = Zn(OH)2 + 2NaCl
1) m(NaOH)= m(р-ра NaOH)*w(NaOH) = 160г * 0,15 = 24г.
2) n(NaOH)= m(NaOH)/M(NaOH) = 24г/40г/моль = 0,6 моль.
3) n(Zn(OH)2) = 1/2*n(NaOH) = 0,6 моль*1/2 = 0,3 моль.
4) m(Zn(OH)2) = n(Zn(OH)2) * M(Zn(OH)2) = 0,3 моль * 99г/моль = 29,7г.
Ответ: m(Zn(OH)2)= 29,7г.
Источник