- Практическая работа № 2 Получение этилена и изучение его свойств.
- Дистанционное обучение как современный формат преподавания
- Современные педтехнологии в деятельности учителя
- Методическая работа в онлайн-образовании
- Оставьте свой комментарий
- Безлимитный доступ к занятиям с онлайн-репетиторами
- Подарочные сертификаты
- Получение этилена и исследование его свойств
- Просмотр содержимого документа «Получение этилена и исследование его свойств»
- Практ. 1
Практическая работа № 2 Получение этилена и изучение его свойств.
Нечаев Дмитрий Валерьевич, учитель химии
ГУ ЛНР «ЛУВК « ИНТЕЛЛЕКТ»
Практическая работа № 2
Получение этилена и изучение его свойств.
Цель: научиться получать в лаборатории этилен; изучить физические и химические свойства этилена.
Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовая горелка, спички.
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
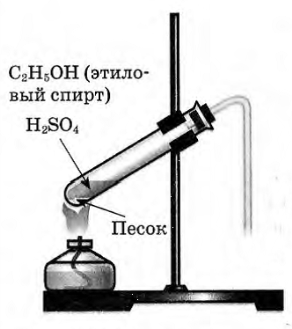
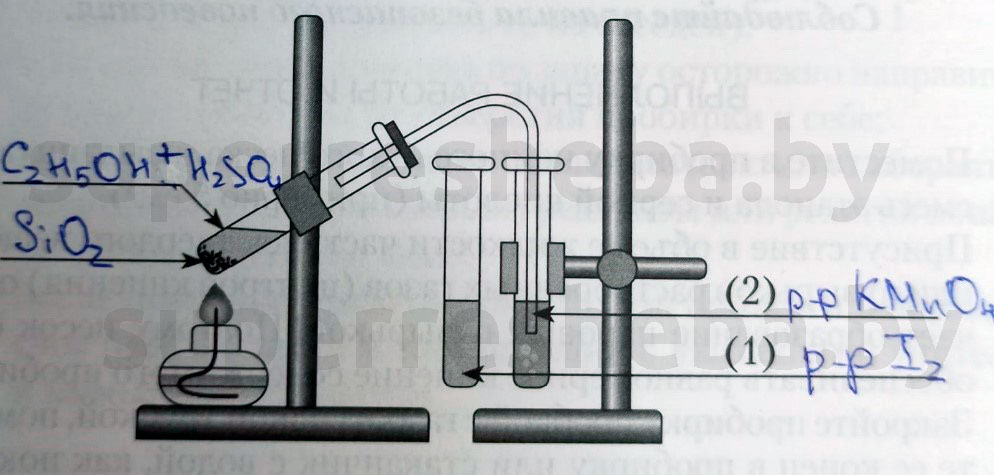
В пробирку налили 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпали немного прокаленного песка (чтобы предотвратить толчки жидкости при кипении). Закрыли пробирку пробкой с газоотводной трубкой, закрепили ее в штативе и осторожно нагрели содержимое пробирки.
В пробирке начинается выделяться газ — этилен.
В ходе реакции концентрированная серная кислота забирает воду из спирта, врезультате образуется этилен.
Такую реакцию называют – реакция дегидратации.
Изучение свойств этилена.
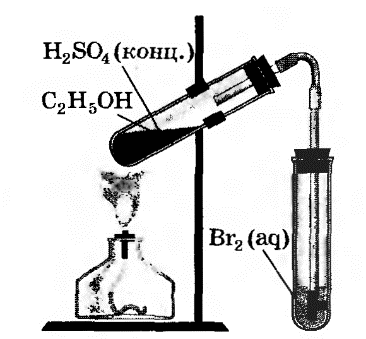
В другую пробирку налили 2-3 мл бромной воды. Опустили газоотводную трубку первой пробирки до дна пробирки с бромной водой и пропускали через неё выдедяющийся газ.
При пропускании газа через бромную воду, происходит обесцвечивание бромной воды.
В ходе реакции происходит окисление этилена бромной водой по двойной связи.
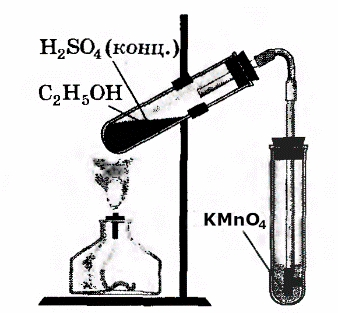
В третью пробирку налили 2-3 мл разбавленного раствора KMnO 4 , поодкисленного серной кислотой, и пропустили через него газ.
При пропускании газа через подкисленный раствор KMnO4 , происходит обесцвечивание раствора KMnO 4 .
В ходе реакции происходит окисление этилена подкисленным раствором перманганата калия.
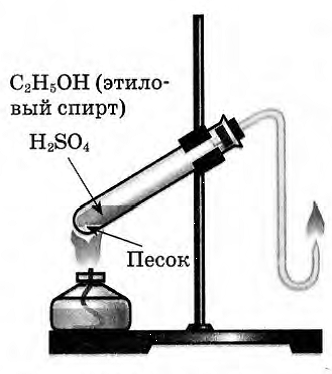
Выделяющиеся газ первой пробирки подожгли.
Этилен на воздухе горит ярким светящимся пламенем.
Этилен горит ярким светящимся пламенем, что доказывает наличие кратных связей.
Общий вывод: на данной практической работе мы научились получать в лаборатории этилен реакцией дегидратации спиртов; изучили химические свойства этилена, а именно, действие этилена на бромную воду и подкисленный раствор перманганата калия.
Какой из гомологов этена имеет плотность по воздуху 1,45?
Ответ: D (возд.) = Mr ( алкена)/Mr (воздуха);
Mr ( алкена) = D (возд.)* Mr (воздуха);
Mr ( алкена) = 1,45*29 = 42.
Какой из гомологов пропена имеет плотность по водороду 14?
Ответ: D (Н2) = Mr ( алкена)/Mr (Н 2 );
Mr ( алкена) = 14*2 = 28.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 832 человека из 77 регионов
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
- Курс добавлен 23.09.2021
- Сейчас обучается 47 человек из 23 регионов
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
- Сейчас обучается 22 человека из 11 регионов
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-1175165
Международная дистанционная олимпиада Осень 2021
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
Минпросвещения будет стремиться к унификации школьных учебников в России
Время чтения: 1 минута
С 2019 года закрыто более 50 детских лагерей
Время чтения: 1 минута
В Пензенской области запустят проект по снижению административной нагрузки на учителей
Время чтения: 1 минута
Минпросвещения разрабатывает образовательный минимум для подготовки педагогов
Время чтения: 2 минуты
Путин попросил привлекать родителей к капремонту школ на всех этапах
Время чтения: 1 минута
Рособрнадзор откажется от ОС Windows при проведении ЕГЭ до конца 2024 года
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник
Получение этилена и исследование его свойств

Данная практическая работа может использоваться как теоретический материал при подготовке к практической работе на уроке. Учащиеся дома повторяют правила техники безопасности, изучают цель работы, какое оборудование и реактивы необходимы в ходе работы, а так же какие наблюдения и выводы нужно будет записать при оформлении отчета.
Просмотр содержимого документа
«Получение этилена и исследование его свойств»
Общие положения техники безопасности на уроках химии
Химия – предмет, который предполагает изучение и работу с химическими веществами.
Во время урока, при работе учащихся могут иметь место вредные и опасные факторы:
отравление химическими веществами;
получение химических ожогов агрессивными веществами;
травмирования осколками стекла;
травмирования в результате взрыва или самовозгорания химических веществ, при нарушении условий их хранения.
Поэтому на уроках химии учащимся, прежде всего, нужно усвоить «химическую практику» и правила безопасного обращения с химическими веществами.
Это означает, что:
учащиеся обязаны знать свойства веществ, с которыми они работают и безопасные приемы обращения с ними;
выполнять требования безопасности при обращении со стеклянной посудой и ампулами;
знать правила обезвреживания и уничтожения вредных веществ;
выполнять только порученную учителем работу;
выполнять правила эксплуатации используемого оборудования;
соблюдать правила личной гигиены;
содержать рабочее место в чистоте;
правильно применять средства индивидуальной и коллективной защиты;
знать и соблюдать требования пожарной безопасности и уметь пользоваться средствами пожаротушения;
немедленно извещать учителя о любой ситуации, угрожающей здоровью и жизни людей (учеников), об инциденте или ухудшении состояния своего здоровья;
уметь оказывать первую (доврачебную) помощь при несчастных случаях (отравлении, термическом и химическом ожогах).
В кабинете химии должны быть в наличии:
аптечка, содержащая медикаменты для оказания первой медицинской помощи;
раствор для нейтрализации токсичных веществ, применяемых в работе;
средства индивидуальной защиты;
средства пожаротушения (огнетушитель, ящик с песком). Тара, в которой хранятся химические вещества должна иметь четкие надписи.
В кабинете химии ЗАПРЕЩАЕТСЯ:
выполнение работ, не связанных с заданием или во внеурочное время;
хранение химических веществ в таре, не имеющей надписи;
совместное хранение в непосредственной близости друг к другу веществ, которые могут вызвать в результате химического взаимодействия пожар или взрыв;
хранение химических веществ в количествах, превышающих суточную норму;
применение химической посуды для личного пользования;
бегать и прыгать;
Практическая работа № 2
Получение этилена и изучение его свойств.
Цель: научиться получать в лаборатории этилен; изучить физические и химические свойства этилена.
Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовая горелка, спички.
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
Описание опыта, рисунок
Наблюдения и уравнения реакций
В пробирку налили 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпали немного прокаленного песка (чтобы предотвратить толчки жидкости при кипении). Закрыли пробирку пробкой с газоотводной трубкой, закрепили ее в штативе и осторожно нагрели содержимое пробирки.
В пробирке начинается выделяться газ — этилен.
С2H5OH 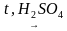
В ходе реакции концентрированная серная кислота забирает воду из спирта, врезультате образуется этилен.
Такую реакцию называют – реакция дегидратации.
Изучение свойств этилена.
В другую пробирку налили 2-3 мл бромной воды. Опустили газоотводную трубку первой пробирки до дна пробирки с бромной водой и пропускали через неё выдедяющийся газ.
При пропускании газа через бромную воду, происходит обесцвечивание бромной воды.
В ходе реакции происходит окисление этилена бромной водой по двойной связи.
В третью пробирку налили 2-3 мл разбавленного раствора KMnO4, поодкисленного серной кислотой, и пропустили через него газ.
При пропускании газа через подкисленный раствор KMnO4, происходит обесцвечивание раствора KMnO4.
В ходе реакции происходит окисление этилена подкисленным раствором перманганата калия.
Выделяющиеся газ первой пробирки подожгли.
Этилен на воздухе горит ярким светящимся пламенем.
Этилен горит ярким светящимся пламенем, что доказывает наличие кратных связей.
Общий вывод: на данной практической работе мы научились получать в лаборатории этилен реакцией дегидратации спиртов; изучили химические свойства этилена, а именно, действие этилена на бромную воду и подкисленный раствор перманганата калия.
Какой из гомологов этена имеет плотность по воздуху 1,45?
Ответ: D(возд.) = Mr (алкена)/Mr (воздуха);
Mr (алкена) = D(возд.)* Mr (воздуха);
Mr (алкена) = 1,45*29 = 42.
Какой из гомологов пропена имеет плотность по водороду 14?
Ответ: D(Н2) = Mr (алкена)/Mr (Н2);
Источник
Практ. 1
Напишите над стрелками формулы или названия веществ в пробирках.
Объясните явления, которые наблюдаются в процессе получения этилена.
В процессе получения мы наблюдали появление пузырьков газа и обесцвечивание растворов иода и перманганата калия. (Причины обесцвечивания приведены далее).
Приведите уравнение реакции получения этилена.
+ ° C 2 H 4 ↑ + H 2 O .
Объясните явления, наблюдаемые при пропускании этилена в пробирки с растворами иода (1) и перманганата калия (2).
В процессе получения этилена мы наблюдали обесцвечивание растворов иода и перманганата калия, потому что образовывались бесцветные продукты реакции. Раствор перманганата обесцвечивался, т.к. в ходе реакции перманганат переходил в щелочь и оксид марганца (IV), а раствора иода – потому что молекулы иода встраивались в молекулу этилена.
Приведите уравнения реакции этилена с раствором иода.
Приведите схему реакции этилена с раствором K M n O 4 \mathrm
Приведите уравнение реакции горения этилена.
1. Напишите, благодаря наличию какого структурного фрагмента в молекулах алкенов они вступают в реакции с иодной и бромной водой. К какому типу относятся данные реакции?
Алкены вступают в реакции с иодной и бромной водой благодаря наличию двойной связи. Эти реакции относятся к реакциям присоединения.
2. В каких условиях реагируют с бромом алканы? К какому типу относится реакция алканов с бромом?
Алканы реагируют с бромом на свету. Это реакция замещения.
3. Сравните отношение к бромной воде алканов и алкенов. Можно ли различить этан и этен при помощи бромной воды?
Да, можно. При пропускании этана через бромную воду раствор брома не будет обесцвечиваться, а при пропускании этена — будет.
Источник