- Выписать способы получения металлов
- Понятие о металлургии: общие способы получения металлов
- 1. Нахождение металлов в природе
- 2. Получение активных металлов
- 3. Получение малоактивных и неактивных металлов
- 3.1. Обжиг сульфидов
- 3.2. Восстановление металлов углем
- 3.3. Восстановление металлов угарным газом
- 3.4. Восстановление металлов более активными металлами
- 3.5. Восстановление металлов из оксидов водородом
- 4. Производство чугуна
- Добавить комментарий Отменить ответ
- Выписать способы получения металлов
- Таблица Менделеева
- Универсальная таблица растворимости
- Коллекция таблиц к урокам по химии
- Общая характеристика и способы получения металлов
- Пирометаллургия
- Гидрометаллургия
- Электрометаллургия
Выписать способы получения металлов
Металлы встречаются в земной коре преимущественно в виде соединений, поскольку они проявляют высокую химическую активность, в самородном состоянии могут находиться лишь неактивные металлы: медь, золото, серебро, платиновые металлы, встречаются месторождения ртути, поэтому получение металлов из их соединений является важной экономической задачей. Металлы получают из руд посредством металлургических процессов.
Рудами называют природные залежи, в которых металлы содержатся в экономически выгодных концентрациях.
Любой металлургический процесс – это процесс восстановления металла с помощью различных восстановителей. Он состоит из трех основных этапов: обогащение руды, восстановление металлов из их соединений, очистка технических металлов.
По характеру протекания восстановительного процесса способы получения металлов делятся на нижеследующие.
Пирометаллургия – восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, алюминия, магния и др.
Например, Cu2O + C = 2Cu + CO.
Гидрометаллургия – восстановление металлов из солей в растворе.
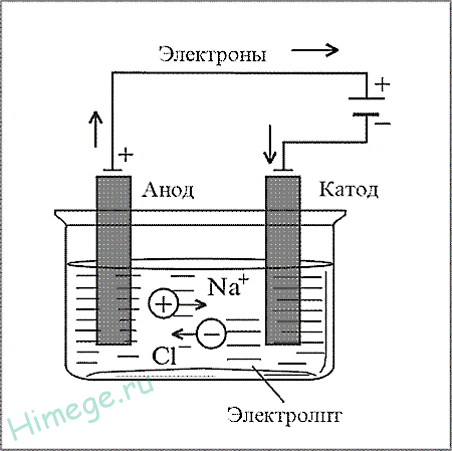
Электрометаллургия – восстановление металлов в процессе электролиза растворов и расплавов солей.
Например, металлический натрий получают электролизом расплава хлорида натрия:
K (-) Na + + 
A (+) 2Cl — -2 
2NaCl 
Медь можно получить электролизом раствора сульфата меди:
K (-) Cu 2+ + 2 
A(+) 2H2O – 4 
2CuSO4 + 2H2O
Также металлы можно получить при термическом разложении их малоустойчивых соединений, например,
Источник
Понятие о металлургии: общие способы получения металлов
Понятие о металлургии: общие способы получения металлов
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей)
- Получение металла или его сплава.
- Механическая обработка металла
1. Нахождение металлов в природе
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
| Нахождение металлов в природе | ||
| Активные металлы — в виде солей | Металлов средней активности — в виде оксидов и сульфидов | Малоактивные металлы -в виде простых веществ |
Хлорид натрия NaCl 2. Получение активных металловАктивные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя. Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества. Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами. Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях. Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция: 2NaCl = 2Na + Cl2 Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С: KCl + Na = K↑ + NaCl Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси): 2LiCl = 2Li + Cl2 Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция: Са + 2CsCl = 2Cs + CaCl2 Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С: Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция: Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C: 4BaO+ 2Al = 3Ba + Ba(AlO2)2 Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6: 3. Получение малоактивных и неактивных металловМеталлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают. 3.1. Обжиг сульфидовПри обжиге сульфидов металлов образуются оксиды: 2ZnS + 3O2 → 2ZnO + 2SO2 Металлы получают дальнейшим восстановлением оксидов. 3.2. Восстановление металлов углемЧистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия. Например , железо получают восстановлением из оксида углем: 2Fe2O3 + 6C → 2Fe + 6CO ZnO + C → Zn + CO Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов: CaO + 3C → CaC2 + CO 3.3. Восстановление металлов угарным газомОксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия. Например , железо можно получить восстановлением из оксида с помощью угарного газа: 3.4. Восстановление металлов более активными металламиБолее активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов: Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними. Алюмотермия – это восстановление металлов из оксидов алюминием. Например : алюминий восстанавливает оксид меди (II) из оксида: 3CuO + 2Al = Al2O3 + 3Cu Магниетермия – это восстановление металлов из оксидов магнием. CuO + Mg = Cu + MgO Железо можно вытеснить из оксида с помощью алюминия: При алюмотермии образуется очень чистый, свободный от примесей углерода металл. Активные металлы вытесняют менее активные из растворов их солей. Например , при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция: 2AgNO3 + Cu = Cu(NO3)2 + 2Ag Медь покроется белыми кристаллами серебра. При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди: CuSO4 + Fe = FeSO4 + Cu При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца: 3.5. Восстановление металлов из оксидов водородомВодород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании. CuO + H2 = Cu + H2O 4. Производство чугунаЧугун получают из железной руды в доменных печах. Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д. 1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар. В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее. Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю. Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает. Шихта — это железная руда, смешанная с флюсами. Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает: Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II): CO2 + С = 2CO Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III): Последовательность восстановления оксида железа (III): FeO + CO → Fe + CO2 Суммарное уравнение протекающих процессов: При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе. Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании: и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси: CaO + SiO2 → CaSiO3 Добавить комментарий Отменить ответЭтот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев. Источник Выписать способы получения металловХИМИЯ – это область чудес, в ней скрыто счастье человечества, величайшие завоевания разума будут сделаны именно в этой области.(М. ГОРЬКИЙ) Таблица | ||