Вычисление стандартной энтальпии образования вещества
Вычисление стандартной энтальпии образования бензола
Задача 2.
Вычислите стандартную энтальпию образования бензола С6Н6(ж), если энтальпии сгорания водорода, углерода и бензола равны соответственно (кДж/моль): -285,84: -393,51; -3267,70.
Решение:
Запишем уравнение реакции, тепловой эффект которой необходимо определить. Образование бензола из простых веществ можно представить следующим термохимическим уравнением:
Для определения энтальпии образования бензола составим цикл Гесса, используя данные задачи:
Чтобы получить искомое уравнение образования бензола из простых веществ, достаточно сложить в цикле Гесса уравнения (1) и (2), умножив их на соответствующие коэффициенты 3 и 6, и вычесть из них уравнение (3):
Сократим однородные члены и перенесем -С6Н6(ж) в правую часть равенства с противоположным знаком. Получим искомое уравнение: 6С(т) + 3Н2(г) = С6Н6(ж).
Аналогичные действия проделаем с тепловыми эффектами:
∆H 0 обр[С6Н6(ж)] = 3∆H 0 (1) + 6∆H 0 (2) – ∆H 0 (3),
∆H 0 обр[С6Н6(ж)] = 3·(-285,84) кДж/моль + 6·(-393,51) кДж/моль – (-3267,70) кДж/моль =
= (-857,52 -2361,06 + 3267,70) кДж/моль = 49,12 кДж/моль.
Термохимическое уравнение образования газообразного озона
Задача 3.
Стандартная энтальпия образования газообразного озона равна 142,3 кДж/моль. Укажите, в какой из перечисленных ниже реакций тепловой эффект ∆H 0 обр будет соответствовать стандартной энтальпии образования О3(г):
а) 3О(г) = О3(г);
б) 1,5О2(г) = О3(г);
в) О2(ж) + О(г) = О3(г);
г) 2О2(г) = О(г) + О3(г).
Напишите термохимическое уравнение этого процесса.
Решение:
По определению, ∆H 0 показывает тепловой эффект реакции образования 1 моль вещества О3(г) прямым синтезом из простых веществ, устойчивых при 298К и давлении 101кПа.
Случай а) не подходит под данное определение, т.к. атомарный кислород О(г) не является устойчивой формой существования простого вещества кислорода. Случай б) соответствует реакции химического процесса образования озона из кислорода. Случай в) не отвечает требованию стандартных условий, т.к. при 298К и давлении 101 кПа кислород не может находиться в жидком состоянии. Случай г) не подходит под данное определение, т.к. не соответствует реакции синтеза. Таким образом, требованиям определения соответствует только реакция б). Термохимическое уравнение будет выглядеть следующим образом:
Ответ: условиям задачи соответствует уравнение б); ∆H 0 обр[О3(г)] = 142,3 кДж/моль.
Источник
Эталоны решения задач
1. Некоторая реакция протекает с уменьшением энтропии. Определить, при каком условии возможно самопроизвольное протекание данной реакции.
Условием самопроизвольного протекания реакции является уменьшение свободной энергии Гиббса, т.е. DG 0.
2) В реакциях разложения энтропия возрастает, следовательно DS > 0.
3) Самопроизвольное протекание реакции свидетельствует о том, что DG
4. Вычислить стандартную энтальпию реакции:
по значениям стандартных энтальпий сгорания веществ:


Запишем выражение второго следствия из закона Гесса с учетом того, что стандартная энтальпия сгорания воды (высший оксид) равна нулю:



Подставим значения стандартных энтальпий сгорания веществ, участвующих в реакции:


Следствия из закона Гесса позволяют вычислять не только стандартные энтальпии реакций, но и величины стандартных энтальпий образования и сгорания веществ по косвенным данным.
5. Определить стандартную энтальпию образования оксида углерода (II) по следующим данным:
| (1) | C(тв.) + О2(газ) = СО2(газ); |  = -393,5 кДж/моль; = -393,5 кДж/моль; |
| (2) | СО(газ) + 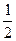 О2(газ) = СО2(газ); О2(газ) = СО2(газ); |  = -283 кДж/моль. = -283 кДж/моль. |
Из уравнения (1) видно, что стандартное изменение энтальпии данной реакции соответствует стандартной энтальпии образования CO2.
Запишем выражение первого следствия из закона Гесса для реакции (2):






Подставим значения и получим:

Эту задачу можно решить и другим способом.
Вычитая из первого уравнения второе, получим:
| (1) — (2) | C(тв.) + 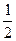 О2(газ) = СО(газ); О2(газ) = СО(газ); |  CO = -110,5 кДж/моль. CO = -110,5 кДж/моль. |
6. Вычислить стандартную энтропию реакции:
по значениям стандартных энтропий веществ:
| CH3Cl | HCl | CH4 | Cl2 |
 , Дж/(моль×K) , Дж/(моль×K) |
Стандартную энтропию реакции вычислим по формуле:





Подставляя табличные значения, получим:

7. Вычислить стандартную энергию Гиббса реакции:
по следующим данным:
| CH3COH | C2H5OH | H2O | H2O2 | |
 , кДж/моль , кДж/моль | -129 | -175 | –237 | –121 |
Определить, возможно ли самопроизвольное протекание данной реакции при стандартных условиях.
Стандартную энергию Гиббса реакции вычислим по формуле:





Подставляя табличные значения, получим:

Так как 





= 6×(-393,5) + 6×(-286) — (-1274,5) — 6×0 = -2803 кДж;





= 6×214 + 6×70 — 212 — 6×205 = 262 Дж/К = 0,262 кДж/К.
Стандартную энергию Гиббса реакции найдем из соотношения:



9. Вычислить стандартную энергию Гиббса реакции гидратации сывороточного альбумина при 25 0 С, для которой DH 0 = -6,08 кДж/моль, DS 0 = -5,85 Дж/(моль×К). Оценить вклад энтальпийного и энтропийного фактора.
Стандартную энергию Гиббса реакции рассчитаем по формуле:
DG 0 = DH 0 — T×DS 0 .
Подставив значения, получим:
DG 0 = -6,08 кДж/моль — 298 К×(-5,85×10 — 3 ) кДж/(моль×К) =
В данном случае энтропийный фактор препятствует протеканию реакции, а энтальпийный — благоприятствует. Самопроизвольное протекание реакции возможно при условии, если 
10. Определить температуру, при которой самопроизвольно пойдет реакция денатурации трипсина, если 

Температуру, при которой равновероятны оба процесса найдем из соотношения:
В данном случае энтальпийный фактор препятствует протеканию реакции, а энтропийный — благоприятствует. Самопроизвольное протекание реакции возможно при условии, если:
Таким образом, условием самопроизвольного протекания процесса является T > 983 K.
Вопросы для самоконтроля
1. Что такое термодинамическая система? Какие типы термодинамических систем вы знаете?
2. Перечислите известные Вам термодинамические параметры. Какие из них относятся к измеряемым? Какие к неизмеряемым?
3. Что такое термодинамический процесс? Как называются процессы, протекающие при постоянстве одного из параметров?
4. Какие процессы называют экзотермическими? Какие эндотермическими?
5. Какие процессы называют обратимыми? Какие необратимыми?
6. Что понимают под термином «состояние системы»? Какие бывают состояния системы?
7. Какие системы изучает классическая термодинамика? Сформулируйте первый и второй постулаты термодинамики.
8. Какие переменные называют функциями состояния? Перечислите известные вам функции состояния.
9. Что такое внутренняя энергия? Можно ли измерить внутреннюю энергию?
10. Что такое энтальпия? Какова ее размерность?
11. Что такое энтропия? Какова ее размерность?
12. Что такое свободная энергия Гиббса? Как ее можно вычислить? Что можно определить при помощи этой функции?
13. Какие реакции называют экзэргоническими? Какие эндэргоническими?
14. Сформулируйте первый закон термодинамики. В чем заключается эквивалентность теплоты и работы?
15. Сформулируйте закон Гесса и следствия из него. Что такое стандартная энтальпия образования (сгорания) вещества?
16. Сформулируйте второй закон термодинамики. При каком условии процесс самопроизвольно протекает в изолированной системе?
Варианты задач для самостоятельного решения
Вариант № 1
1. Вычислить стандартную энтальпию реакции:
используя значения стандартных энтальпий образования веществ:
| NH3 | NO | H2O | |
 , кДж/моль , кДж/моль | -46,2 | 90,4 | -242 |
Определить, к какому типу (экзо- или эндотермическому) относится эта реакция.
2. Вычислить стандартную энтальпию реакции:
используя значения стандартных энтальпий сгорания веществ:
| C2H6 | CH4 | |
 , кДж/моль , кДж/моль | -1560 | -890 |
3. Вычислить стандартную энергию Гиббса реакции гидратации b-лактоглобулина при 25 0 С, для которой DH 0 = -6,75 кДж, DS 0 = -9,74 Дж/К. Оценить вклад энтальпийного и энтропийного фактора.
Вариант №2
1. Вычислить стандартную энтальпию реакции:
используя значения стандартных энтальпий образования веществ:
| NO2 | N2O5 | O3 |
 , кДж/моль , кДж/моль |
Определить, к какому типу (экзо- или эндотермическому) относится эта реакция.
2. Вычислить стандартную энтальпию реакции:
используя значения стандартных энтальпий сгорания веществ:
| C2H2 | C2H6 | |
 , кДж/моль , кДж/моль | -1300 | -1560 |
3. Вычислить стандартную энергию Гиббса реакции тепловой денатурации химотрипсиногена при 50 0 С, для которой DH 0 = 417 кДж, DS 0 = 1,32 кДж/К. Оценить вклад энтальпийного и энтропийного фактора.
Вариант №3
1. Вычислить стандартную энтальпию реакции гидрирования бензола до циклогексана двумя способами, т.е., используя значения стандартных энтальпий образования и сгорания веществ:
| C6H6 | C6H12 | |
 , кДж/моль , кДж/моль | -156 | |
 , кДж/моль , кДж/моль | -3268 | -3920 |
2. Оценить возможность самопроизвольного протекания реакции:
при стандартных условиях, если:
| ZnO | CuO | Zn | Cu |
 , кДж/моль , кДж/моль | -348 | -157 | |
 , Дж/(моль×K) , Дж/(моль×K) |
3. При восстановлении 12,7 г оксида меди (II) углем (с образованием CO) поглощается 8,24 кДж теплоты. Определить стандартную энтальпию образования CuO, если 
Вариант №4
1. Вычислить стандартную энтальпию хемосинтеза, протекающего в автотрофных бактериях Baglatoa и Thiothpix, по стадиям и суммарно:
| H2S | H2O | H2SO4 | |
 , кДж/моль , кДж/моль | -20 | -286 | -814 |
2. Вычислить стандартную энтальпию реакции:
используя значения стандартных энтальпий сгорания веществ:
| C6H12O6 | C2H5OH | |
 , кДж/моль , кДж/моль | -2810 | -1368 |
3. Оценить роль энтальпийного и энтропийного факторов для реакции:
по известным данным:
| HCl | H2O | O2 | Cl2 |
 , кДж/моль , кДж/моль | -92,3 | -286 | |
 , Дж/(моль×K) , Дж/(моль×K) |
Определить температуру, при которой реакция пойдет самопроизвольно.
Вариант №5
1. Вычислить стандартную энтальпию реакции:
используя значения стандартных энтальпий образования веществ:
| CH3Cl | CO2 | H2O | HCl | |
 , кДж/моль , кДж/моль | -82 | -394 | -286 | -92 |
Определить, к какому типу (экзо- или эндотермическому) относится эта реакция.
2. Вычислить стандартную энтальпию реакции:
используя значения стандартных энтальпий сгорания веществ:
| C6H6 | C6H12 | |
 , кДж/моль , кДж/моль | -3302 | -3920 |
3. Вычислить стандартную энергию Гиббса реакции денатурации трипсина при 50 0 С, для которой DH 0 = 283 кДж, DS 0 = 288 Дж/К). Оценить возможность протекания процесса в прямом направлении.
Вариант №6
1. Вычислить стандартную энтальпию хемосинтеза, протекающего в автотрофных бактериях Thiobacillus Thioparus:
| Na2S2O3×5H2O | Na2SO4 | H2SO4 | H2O | |
 , кДж/моль , кДж/моль | -2602 | -1389 | -814 | -286 |
Определить, к какому типу (экзо- или эндотермическому) относится эта реакция.
2. Вычислить стандартную энтальпию реакции:
используя значения стандартных энтальпий сгорания веществ:
| C6H5NO2 | C6H5NH2 | |
 , кДж/моль , кДж/моль | -3093 | -3396 |
3. Оценить роль энтальпийного и энтропийного факторов для реакции:
по известным данным:
| H2O2 | H2O | O3 | O2 |
 , кДж/моль , кДж/моль | -188 | -286 | |
 , Дж/(моль×K) , Дж/(моль×K) |
Определить температуру, при которой реакция пойдет самопроизвольно.
Вариант №7
1. Вычислить стандартную энтальпию образования CH3OH по следующим данным:
2. Оценить возможность самопроизвольного протекания реакции:
при стандартных условиях, если:
| Al2O3 | Fe3O4 | Al | Fe |
 , кДж/моль , кДж/моль | -1670 | -1018 | |
 , Дж/(моль×K) , Дж/(моль×K) |
3. Вычислить значение DH 0 для возможных реакций превращения глюкозы:
по известным данным:
| C6H12O6 | C2H5OH | CO2 | H2O | |
 , кДж/моль , кДж/моль | -1275 | -278 | -393,5 | -286 |
В результате какой из этих реакций выделяется большее количество энергии?
Вариант №8
1. Вычислить стандартную энтальпию образования MgCO3 по следующим данным:
2. Вычислить стандартную энтропию реакции:
по известным данным:
| C2H6 | CH4 | H2 |
 , Дж/(моль×K) , Дж/(моль×K) |
3. Какие из перечисленных оксидов: CaO, FeO, CuO, PbO, FeO, Cr2O3 могут быть восстановлены алюминием до свободного металла при 298 К:
| Al2O3 | CuO | PbO | FeO | Fe2O3 | Cr2O3 | |
 , кДж/моль , кДж/моль | -1580 | -127 | -188,5 | -244 | -604 | -1058 |
Вариант №9
1. Вычислить стандартную энтальпию образования Ca3(PO4)2 по следующим данным:
2. Оценить возможность самопроизвольного протекания реакции:
при стандартных условиях, если:
| Fe2O3 | CO2 | CO | Fe |
 , кДж/моль , кДж/моль | -842 | -393,5 | -111 |
 , Дж/(моль×K) , Дж/(моль×K) |
3. Определить, какие из перечисленных оксидов: CuO, PbO2, ZnO, CaO, Al2O3 могут быть восстановлены водородом до свободного металла при 298 К, если известно:
| H2O | CuO | PbO2 | ZnO | CaO | Al2O3 | |
 , кДж/моль , кДж/моль | -237 | -127 | -219 | -318 | -604 | -1580 |
Вариант №10
1. Вычислить стандартную энтальпию образования этанола по следующим данным:
H2(газ) + 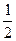
2. Вычислить стандартную энтропию реакции:
по известным данным:
| C2H6 | C2H2 | H2 |
 , Дж/(моль×K) , Дж/(моль×K) |
3. Вычислить количество энергии, которое выделится в организме человека, который съел 2 кусочка сахара по 5 г каждый, считая, что основной путь метаболизма сахарозы сводится к ее окислению:
C12H22O11(тв.) + 12O2(газ) = 12CO2(газ) + 11H2O(жидк.) 
Вариант №11
1. Вычислить стандартную энтальпию образования С2H4 по следующим данным:
2. Не производя вычислений, установить знак DS 0 следующих процессов:
3. Определить, по какому уравнению реакции будет протекать разложение пероксида водорода при стандартных условиях:
| H2O(жидк.) | H2O2(газ) | O2 | H2 |
 , кДж/моль , кДж/моль | -286 | -188 | |
 , Дж/(моль×K) , Дж/(моль×K) | -286 |
Вариант №12
1. Вычислить стандартную энтальпию образования ZnSO4 по следующим данным:
2ZnS + 3O2 = 2ZnO + SO2 DH 0 = -890 кДж;
ZnSO4 = ZnO + SO3 DH 0 = +234 кДж.
2. Вычислить стандартную энтропию реакции:
по известным данным:
| KClO3 | KCl | O2 |
 , Дж/(моль×K) , Дж/(моль×K) |
3. Определить температуру, при которой самопроизвольно будет протекать реакция:
если: 

Вариант №13
1. Рассчитать стандартную энтальпию реакции:
2FeO(тв.) + 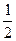
по следующим данным:
Fe(тв.) + 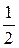
2Fe(тв.) + 
2. Вычислить стандартную энтропию фазовых превращений:
по известным данным:
| H2O(тв.) | H2O(жидк.) | H2O(газ) |
 , Дж/(моль×K) , Дж/(моль×K) |
3. Вычислить количество энергии, которое выделится при сгорании 10 г бензола, по следующим данным:
| C6H6 | CO2 | H2O |
 , кДж/моль , кДж/моль | -393,5 | -286 |
Вариант №14
1. Вычислить стандартную энтальпию образования PCl5 по следующим данным:
2. Вычислить стандартное изменение энергии Гиббса образования сероуглерода CS2 по следующим данным:


3. Оценить роль энтальпийного и энтропийного факторов для реакции:
по известным данным:
| CO2 | CaO | CaCO3 | |
 , кДж/моль , кДж/моль | -393,5 | -636 | -1207 |
 , Дж/(моль×K) , Дж/(моль×K) |
Определить температуру, при которой реакция пойдет самопроизвольно.
Вариант №15
1. Вычислить тепловой эффект реакции образования кристаллогидрата CuSO4×5H2O, протекающей по уравнению:
| CuSO4×5H2O | CuSO4 | H2O | |
 , кДж/моль , кДж/моль | -2278 | -662 | -286 |
2. Вычислить стандартную энтропию реакции:
по известным данным:
| C6H6 | C6H12 | H2 |
 , Дж/(моль×K) , Дж/(моль×K) |
3. Определить возможность протекания реакции:
при стандартных условиях, если:
| P2O5 | PH3 | H2O | |
 , кДж/моль , кДж/моль | -1350 | 13,4 | -237 |
Вариант №16
1. Рассчитать, в каком случае выделится больше энергии: при сжигании 1 моль водорода или 1 моль ацетилена
| C2H2 | CO2 | H2O |
 , кДж/моль , кДж/моль | -394 | -286 |
2. Вычислить температуру фазового превращения белого олова в серое по следующим данным:
| Белое | Серое |
 , кДж/моль , кДж/моль | -2,1 |
 , Дж/(моль×K) , Дж/(моль×K) | 51,5 |
3. Определить, можно ли при стандартных условиях получить пероксид водорода по реакции:
| H2O2 | H2O | O2 |
 , кДж/моль , кДж/моль | -188 | -286 |
 , Дж/(моль×K) , Дж/(моль×K) |
Вариант №17
1. Синтез-газ представляет собой смесь равных объемов водорода и оксида углерода (II). Вычислить количество энергии, которое выделится при сжигании 112 л синтез-газа, если известны термохимические уравнения:
СO(газ) + 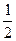
H2(газ) + 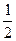
2. Вычислить стандартную энтропию реакции:
по известным данным:
| HNO2 | HNO3 | NO | H2O |
 , Дж/(моль×K) , Дж/(моль×K) |
3. Определить температуру, при которой самопроизвольно будет протекать реакция:
если: 

Вариант №18*
1. В ходе реакции окисления аммиака
образовалось 2,24 л азота и при этом выделилось 76,5 кДж теплоты. Вычислить 

2. Рассчитать стандартную энтальпию реакции:
по следующим данным:
3. Константа диссоциации уксусной кислоты равна 1,8×10 — 5 . Вычислить изменение энергии Гиббса при диссоциации уксусной кислоты.
Источник






