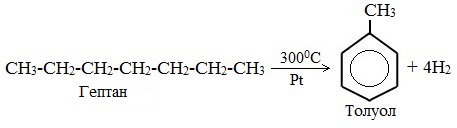Все способы получения толуола
Толуол (толуанский бальзам) — метилбензол, бесцветная жидкость с характерным запахом, относится к аренам.
Толуол был впервые получен Пельтье в 1835 при перегонке сосновой смолы.
В 1838 выделен А.Девилем из толуанского бальзама — желтовато-коричневой, приятно пахнущей смолы южно-американского дерева, привезенного из города Толу в Колумбии, в честь которого получил своё название.
Физические свойства толуола
Толуол – бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие, не растворимая в воде, хорошо растворяется в органических растворителях, растворяет полимеры. Температура кипения = 110,6 0 С.
Обладает сладковатым ароматом, напоминающим запах красок, лаков, растворителей. Горюч, сгорает с выделением копоти. Толуол менее токсичен, чем бензол.
Пары толуола легко образуют взрывоопасные смеси, воспламеняющиеся даже от искры статического электричества.
Получение
В промышленности
1. Переработка нефти и угля
В настоящее время, толуол получают из нефтяных фракций и каменноугольной смолы.
Каменноугольный толуол, образующийся в процессе коксования, извлекают из коксового газа в виде компонента сырого бензола, подвергают сернокислотной очистке (для удаления непредельных и серусодержащих соединений) и выделяют ректификацией.
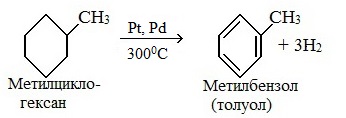
2. Дегидрирование метилциклогексана
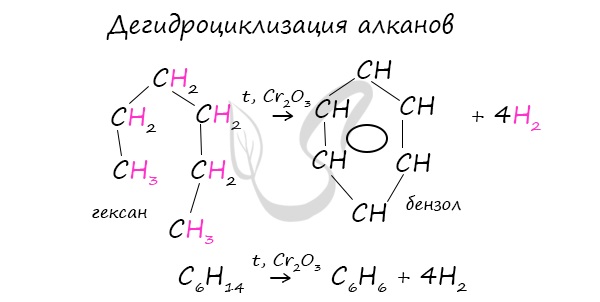
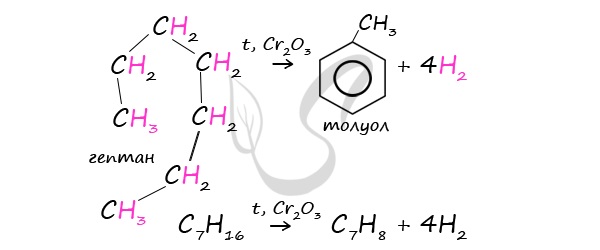
3. Дегидроциклизация гептана
В лаборатории
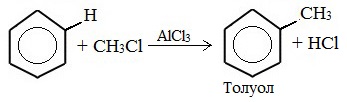
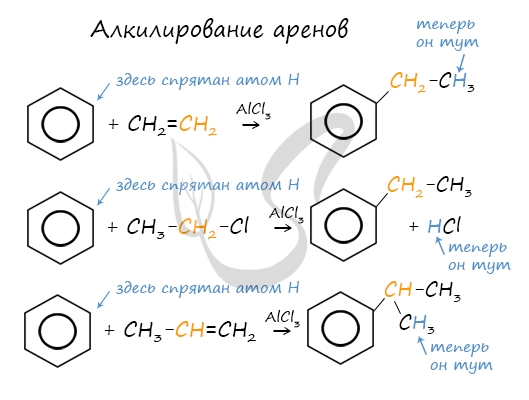
1. Алкилирование по Фриделю-Крафтсу
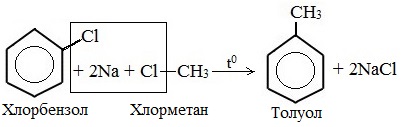
2. Реакция Вюрца-Фиттига (взаимодействие натрия со смесью галогенбензола и галогеналкана)
Применение толуола
Толуол – это ценное сырье для органического синтеза, для производства компонентов моторных топлив с высоким октановым числом, для получения взрывчатых веществ (тринитротолуола), фармацевтических препаратов, красителей и растворителей. Как основной компонент входит в состав растворителей.
Источник
Бензол и его гомологи
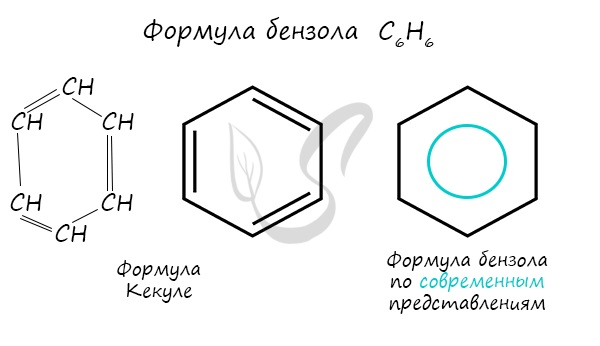
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6. Общая формула их гомологического ряда — CnH2n-6.
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp 2 гибридизации. Валентный угол — 120°.
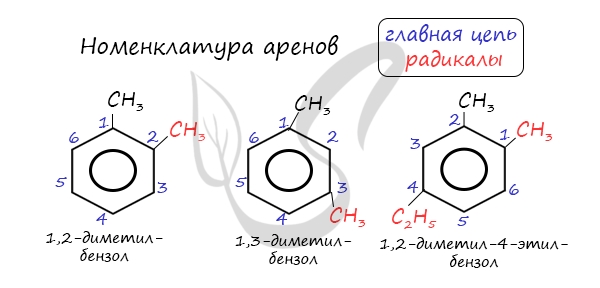
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
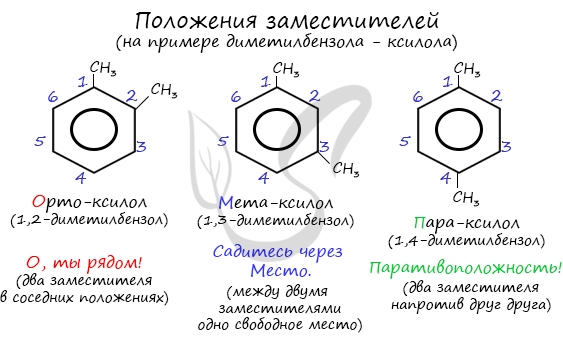
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 😉
Получение аренов
Арены получают несколькими способами:
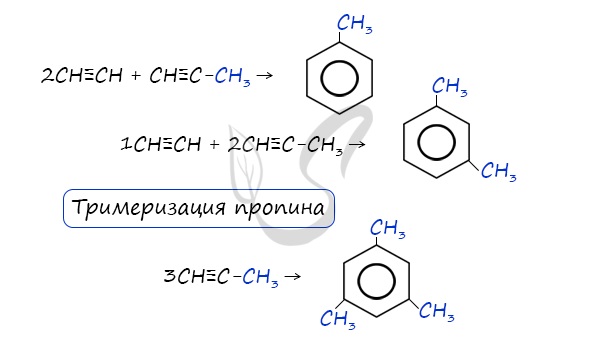
- Реакция Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.
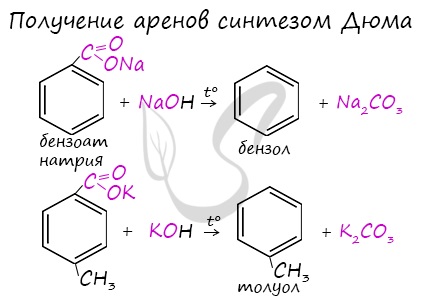
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
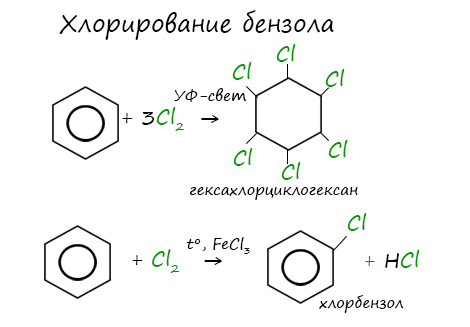
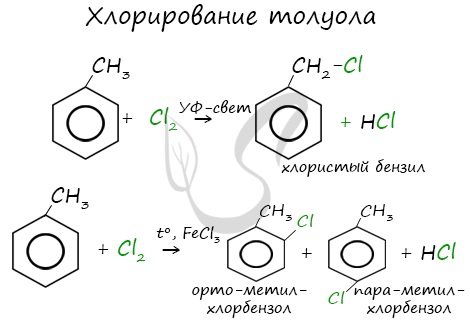
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
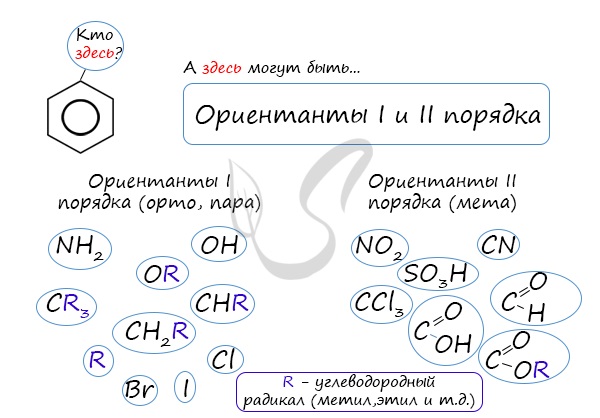
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
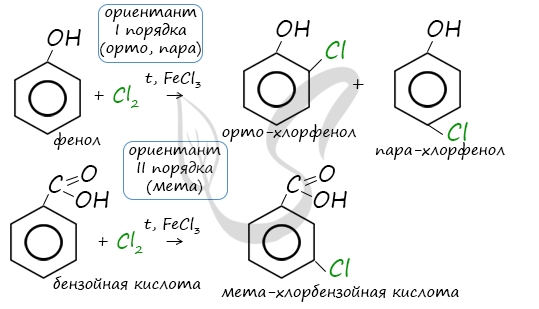
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
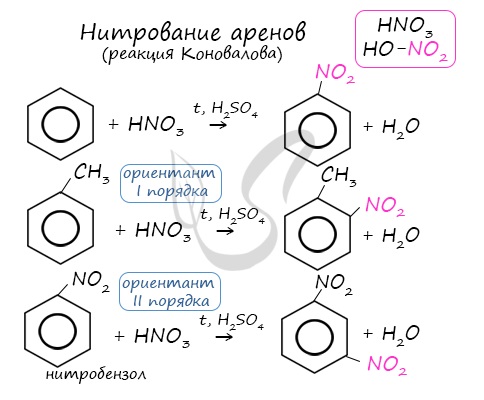
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
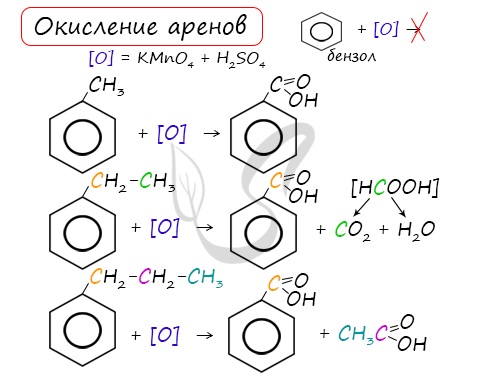
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
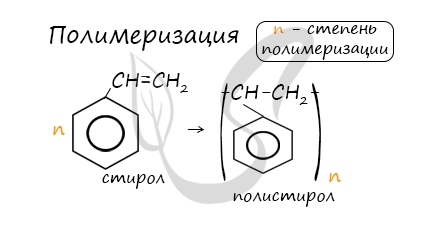
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Толуол
Толуол (от исп. Tolu , толуанский бальзам) — метилбензол, PhMe — бесцветная жидкость с характерным запахом, относится к аренам.
Толуол получен впервые П. Пеллетье в 1835 при перегонке сосновой смолы. В 1838 выделен А. Девилем из бальзама, привезенного из города Толу в Колумбии, в честь которого получил своё название.
Содержание

Общая характеристика
Бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие. Смешивается в неограниченных количествах с углеводородами, многими спиртами, простыми и сложными эфирами, не смешивается с водой. Показатель преломления света 1,4969 при 20 °C. Горюч, сгорает коптящим пламенем.
Химические свойства
Для толуола характерны реакции электрофильного замещения в ароматическом кольце и замещения в метильной группе по радикальному механизму.
Электрофильное замещение в ароматическом кольце идёт преимущественно в орто- и пара-положениях относительно метильной группы.
Кроме реакций замещения, толуол вступает в реакции присоединения (гидрирование), озонолиза. Некоторые окислители (щелочной раствор перманганата калия, разбавленная азотная кислота) окисляют метильную группу до карбоксильной. Температура самовоспламенения 535 °C. Температура вспышки 4 °C.
При взаимодействии толуола с сильными окислителями образуется бензойная кислота:
Получение и очистка
Продукт каталитического риформинга бензиновых фракций нефти. Выделяется селективной экстракцией и последующей ректификацией.Также хорошие выходы достигаются при каталитическом дегидрировании гептана через метилциклогексан.
Очищают толуол аналогично бензолу, только в случае применения концентрированной серной кислоты следует учитывать, что толуол сульфируется легче бензола, а, значит, необходимо поддерживать более низкую температуру реакционной смеси (практически — менее 30 °C).
Толуол также образует с водой азеотропную смесь.
Толуол можно получить из бензола по реакции Фриделя — Крафтса с использованием трибромида железа в качестве катализатора:
C6H6 + CH3Br → FeBr3 C6H5CH3 + HBr 

Применение
Сырьё для производства бензола, бензойной кислоты, нитротолуолов (в том числе тринитротолуола), толуилендиизоцианатов (через динитротолуол и толуилендиамин) бензилхлорида и др. органических веществ.
Является растворителем для многих полимеров, входит в состав различных товарных растворителей для лаков и красок. Входит в состав растворителей: Р-40, Р-4, 645, 646, 647, 648. Применяется как растворитель в химическом синтезе.
Опасность и обращение
Пары толуола могут проникать через неповрежденную кожу и органы дыхания, вызывать поражение нервной системы (заторможенность, нарушения в работе вестибулярного аппарата), в том числе необратимое. Поэтому работать с толуолом и растворителями, в состав которых он входит, необходимо в прочных резиновых перчатках в хорошо проветриваемом помещении или с использованием вытяжной вентиляции.
Пожароопасен, легковоспламеняющаяся жидкость. Концентрационные пределы взрываемости паровоздушной смеси 1,3 — 6,7 %. Обладает слабым наркотическим действием.
Согласно другим источникам (САНПИН, меры предосторожности при работе с летучими органическими растворителями), толуол является сильно токсичным ядом, влияющим на функцию кроветворения организма, аналогично бензолу. Нарушение кроветворения проявляется в цианозе и гипоксии. Существует также толуольная токсикомания.
В целом, толуол, как и другие гомологи бензола, очень токсичен, его длительное воздействие может привести к необратимым поражениям ЦНС, кроветворных органов и создать предпосылки для возникновения энцефалопатии.
Опыты на крысах не выявили рисков увеличения числа опухолей при долговременном воздействии толуола. Однако данные о воздействии на человека в настоящее время отсутствуют, и Агентство по охране окружающей среды США относит толуол к канцерогенам группы D («недостаточно данных для классификации»).
Толуоловая токсикомания
Толуол и содержащие его смеси, например, Р-646 являются галлюциногенными веществами. Для борьбы против токсикомании фирма Хенкель исключила толуол из клея «Момент», заменив его ацетоном.
Источник