- Бромид натрия: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Бромид натрия
- Содержание
- Общая информация
- Противопоказания
- Физические свойства
- Форма выпуска
- Хранение
- Бромид натрия (NaBr). Химическая структура, свойства и применение.
- Химическая структура
- Химический синтез
- противодействие
- свойства
- приложений
Бромид натрия: способы получения и химические свойства
Бромид натрия — NaBr соль щелочного металла натрия и бромоводородной кислоты. Белое кристаллическое вещество. Плавится без разложения. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 102,89; относительная плотность для тв. и ж. состояния d = 3,211; tпл = 755º C
Способ получения
1. Бромид натрия можно получить путем взаимодействия концентрированного и холодного гидроксида натрия и брома, образуются гипобромит натрия, бромид натрия и вода:
2NaOH + Br2 = NaBrO + NaBr + H2O,
при взаимодействии брома с концентрированным и горячим гидроксидом натрия образуется бромат натрия, бромид натрия и вода:
6NaOH + 3Br2 = NaBrO3 + 5NaBr + 3H2O
2. При температуре 150–200º C, в результате взаимодействия натрия и брома, образуется бромид натрия:
2Na + Br2 = 2NaBr
3. Холодный йодид натрия реагирует с бромом . При этом образуются бромид натрия и осадок йод:
2NaI + Br2 = 2NaBr + I2↓
Качественная реакция
Качественная реакция на бромид натрия — взаимодействие с нитратом серебра, в результате реакции происходит образование осадка бледно — желтого цвета:
1. При взаимодействии с нитратом серебра , бромид натрия образует нитрат натрия и осадок бромид серебра:
NaBr + AgNO3 = NaNO3 + AgBr↓
Химические свойства
1. Бромид натрия вступает в реакцию с простыми веществами :
1.1. Горячий бромид натрия взаимодействует с хлором. В результате реакции происходит образование хлорида натрия и газа брома:
2NaBr + Cl2 = 2NaCl + Br2↑
2. Бромид натрия способен вступать в реакцию со сложными веществами :
2.1. Бромид натрия реагирует с кислотами :
2.1.1. Твердый бромид натрия реагирует с холодной серной кислотой с концен трацией 10–50% . Взаимодействие данных веществ приводит к образованию сульфата натрия и бромоводородной кислоты:
Если концентрацию горячей серной кислоты поднять выше 50 %, то в результате реакции образуется гидросульфат натрия, бром, оксид серы (IV) и вода:
Источник
Бромид натрия
| Бромид натрия | |
|---|---|
 | |
 | |
| Систематическое наименование | бромид натрия |
| Традиционные названия | бромид натрия |
| Хим. формула | NaBr |
| Состояние | твердое |
| Молярная масса | 102.894 г/моль |
| Плотность | 3.21 г/см³ |
| Т. плав. | 747 °C |
| Т. кип. | 1396 °C |
| Растворимость в воде | 90.5 г/100 мл (20 °C) 121.0 г/100 мл (100 °C) |
| Растворимость в метанол | 17.3 г/100 г (0 °C) 16.8 г/100 г (20 °C) 16.1 г/100 г (40 °C) 15.3 г/100 г (60 °C) |
| Растворимость в этанол | 2.45 г/100 г (0 °C) 2.32 г/100 г (20 °C) 2.29 г/100 г (30 °C) 2.35 г/100 г (70 °C) |
| ГОСТ | ГОСТ 4169-76 ГОСТ 4169-66 |
| Рег. номер CAS | 7647-15-6 |
| PubChem | 253881 |
| Рег. номер EINECS | 231-599-9 |
| SMILES | |
| RTECS | VZ3150000 |
| ChEBI | 63004 |
| ChemSpider | 22712 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Натрия бромид (лат. Natrii bromidum ) — неорганическое соединение, соль натрия и бромистоводородной кислоты. Синонимы, использующиеся в фармации: лат. Natrium bromatum , англ. Sodium Bromide .
Содержание
Общая информация
Препараты брома обладают способностью концентрировать и усиливать процессы торможения в коре большого мозга, они могут восстанавливать равновесие между процессами возбуждения и торможения, особенно при повышенной возбудимости ЦНС.
В прошлом препараты брома широко применялись в качестве седативных и противосудорожных средств. В настоящее время ими пользуются реже, но своего значения они не потеряли.
Применяют препараты брома при неврастении, неврозах, истерии, повышенной раздражительности, бессоннице, начальных формах гипертонической болезни, а также при эпилепсии и хорее.
Противопоказания
При длительном приёме бромидов возможны побочные явления («бромизм»): насморк, кашель, конъюнктивит, общая вялость, ослабление памяти, кожная сыпь (acne bromica). В этих случаях (при отсутствии противопоказаний) вводят в организм большие количества натрия хлорида (10—20 г в сутки) в сочетании с большим количеством воды (3—5 л в сутки).
Физические свойства
Белый кристаллический порошок без запаха, солёного вкуса. Гигроскопичен. Растворим в воде (1:1,5) и спирте (1:10). Растворы (pH 6,0—7,0) стерилизуют при +100 °C в течение 30 мин.
Форма выпуска
Формы выпуска: порошок; таблетки по 0,5 г, 3 % раствор.
Хранение
Хранение: в хорошо укупоренной таре, предохраняющей от действия света, в сухом месте.
Источник
Бромид натрия (NaBr). Химическая структура, свойства и применение.
бромид натрия является химическим видом, который относится к солям неорганического происхождения. Его структура состоит из бромгалогена и металлического элемента натрия в соотношении 1: 1. Его химическая формула — NaBr и находится в состоянии твердой агрегации при стандартных условиях температуры и давления (25 ° C и 1 атм)..
Обычно его можно наблюдать в виде белого порошка и рассматривать как соединение кристаллического типа, которое также проявляет гигроскопическое поведение; то есть имеет способность поглощать влагу из окружающей среды.
Точно так же бромид натрия имеет физические характеристики, очень похожие на другое ионное соединение того же металла: хлорид натрия. Этот хлорид представлен как NaCl, который более известен как поваренная соль или поваренная соль.
Он имеет большое количество применений в различных областях науки; например, он используется в производстве различных видов лекарств (седативных, снотворных, противосудорожных, среди прочих), а также в органическом синтезе и даже в фотографиях.
- 1 Химическая структура
- 1.1 Химический синтез
- 2 свойства
- 3 использования
- 4 Ссылки
Химическая структура
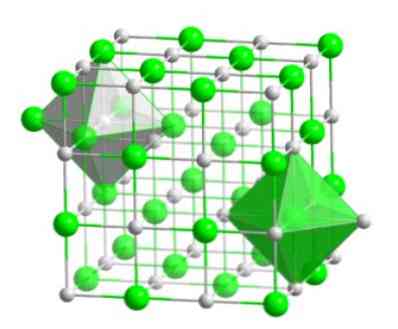
Как упоминалось ранее, бромид натрия находится в твердой фазе и, как и многие другие соли неорганической природы, имеет кристаллическую структурную конформацию..
Эта кристаллическая молекула, состоящая из атома брома и атома водорода, имеет конформацию кубического типа с центром на гранях, такую как галоидные соли того же металла (NaI, NaF и NaCl).
Это молекулярное расположение образует структурную основу многих соединений, в которых упорядочение осуществляется таким образом, что каждый ион находится в центре октаэдрической фигуры, как показано на следующем изображении..
В этом типе кристалла вы можете видеть, как каждый из ионов имеет вокруг себя шесть других ионов, которые имеют противоположный электрический заряд, которые расположены на концах октаэдрической фигуры..
Кроме того, структура этого ионного вещества подразумевает, что оно обладает высокой температурой плавления, равной приблизительно 747 ° С, будучи коммерчески доступным в двух его формах: безводный вид (без молекул воды) и дигидратированный вид (с двумя молекулами воды в его Структурная формула (NaBr · 2H2О)), у которых точки плавления разные.
Химический синтез
Бромид натрия вызван химической реакцией, которая происходит между бромистым водородом (BrH, галогеноводород в газовой фазе) и гидроксидом натрия (NaOH, сильное основание в твердой фазе и с гигроскопическими свойствами).
Таким образом, его производят коммерчески, добавляя избыток брома к раствору NaOH. Это образует смесь бромид / бром. Затем полученные продукты подвергают выпариванию до высушивания и обрабатывают углеродом, чтобы вызвать реакцию восстановления бромат-иона (BrO).3 — ) к бромид-иону (Br — ).
противодействие
Подобным образом, эта неорганическая соль также может быть получена посредством реакции нейтрализации карбоната натрия (Na2Колорадо3) с бромной кислотой (HBrO)3), следуя той же процедуре, описанной выше.
В результате синтеза это вещество может быть получено путем реакции железа с бромом и водой. В качестве продукта этой реакции происходит образование бромистого железа (II)..
Впоследствии этот вид образовался (представлен как FeBr2/ FeBr3) растворяется в воде и добавляется определенное количество карбоната натрия. Наконец, раствор фильтруют и пропускают через процесс выпаривания, чтобы окончательно получить бромид натрия.
свойства
— Это обычно находится в состоянии твердого скопления, в форме белого порошка.
— Он имеет кристаллическую структуру с кубическим молекулярным расположением, центрированным на гранях..
— Температура плавления этого вещества составляет приблизительно 747 ° C для его безводной формы и 36 ° C для его дигидратированной формы, показывая разложение перед тем, как оно расплавится.
— Состоит из иона натрия (Na + ) и бромид-ион (Br — ), с молярной массой или молекулярной массой 102,89 г / моль.
— Его температура кипения довольно высокая, наблюдается при 1390 ° C (эквивалентно 2530 ° F или 1660 K).
— Растворимость этого вида составляет около 94,32 г / 100 мл в воде при 25 ° C, увеличиваясь с ростом температуры.
— При нагревании до точки разложения это вещество выделяет газы, содержащие бром и оксид натрия, которые считаются токсичными.
— Плотность безводной формы бромида натрия составляет 3,21 г / см. 3 , в то время как у дигидратного соединения 2,18 г / см 3 .
— Его растворимость в спирте считается умеренной, как и в других растворителях, таких как пиридин, аммиак и гидразин.
— Обладает нерастворимостью в отношении ацетонитрила и ацетона.
приложений
— В области медицины его применяют в качестве лекарственного средства при большом количестве состояний, вызывающих судороги, и в качестве терапии для предотвращения эпилепсии у пациентов с синдромом Вольфа-Хиршхорна, а также в качестве седативного и снотворного средства..
— В ветеринарной медицине используется у собак, которые имеют судорожные расстройства из-за побочных эффектов таких препаратов, как фенобарбитал или примидон.
— В области нефтяной промышленности его используют в процессах приготовления некоторых жидкостей различной плотности, которые используются в нефтяных скважинах..
— В области биологических исследований были доказаны его микробиоцидные свойства; то есть он используется для контроля развития различных видов бактерий.
— В некоторых синтезах органического типа эта соль неорганической природы используется для получения других видов, состоящих из брома. Например, с помощью реакции Финкельштейна получают некоторые алкилгалогениды с большей реакционной способностью, один из которых раньше широко использовался в фотографии..
— В области очистки и дезинфекции бромид натрия используется в сочетании с хлором для очистки больших объемов воды, например, в плавательных бассейнах и джакузи..
Источник