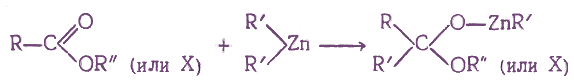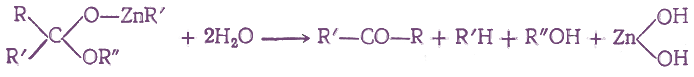- 1. Окисление спиртов
- 2. Дегидрогенизация (дегидрирование) вторичных спиртов
- 3. Из одноосновных карбоновых кислот
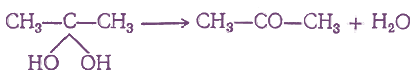
- 4. Действие воды на дигалоидные соединения
- 5. Действие воды на ацетиленовые углеводороды (реакция Кучерова)
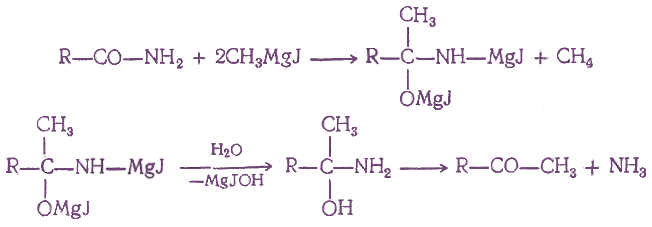
- 6. Получение с помощью магний- и цинкорганических соединений
- 7. Действие кадмийорганических соединений на хлорангидриды кислот
- Применение кетонов
- Физиологическое действие
- Альдегиды и кетоны
- Строение карбонильных соединений
- Номенклатура карбонильных соединений
- Изомерия карбонильных соединений
- Изомерия альдегидов
- Изомерия кетонов
- Физические свойства альдегидов и кетонов
- Химические свойства альдегидов и кетонов
- 1.1. Гидрирование
- 1.2. Присоединение воды
- 1.3. Присоединение спиртов
- 1.4. Присоединение циановодородной (синильной) кислоты
- 2. Окисление альдегидов и кетонов
- 2.1. Окисление гидроксидом меди (II)
- 2.2. Окисление аммиачным раствором оксида серебра
- 2.3. Жесткое окисление
- 2.4. Горение карбонильных соединений
- 3. Замещение водорода у атома углерода, соседнего с карбонильной группой
- 4. Конденсация с фенолами
- 5. Полимеризация альдегидов
- Получение карбонильных соединений
- 1. Окисление спиртов
- 1.1. Окисление спиртов оксидом меди (II)
- 1.2. Окисление спиртов кислородом на меди
- 1.3. Окисление спиртов сильными окислителями
- 2. Дегидрирование спиртов
- 3. Гидратация алкинов
- 4. Гидролиз дигалогенпроизводных алканов
- 5. Пиролиз солей карбоновых кислот
- 6. Кумольный способ получения ацетона
- 7. Каталитическое окисление алкенов
1. Окисление спиртов
Кетоны могут быть получены окислением вторичных спиртов. Окислителем, обычно применяемым для этой цели в лабораториях, является хромовая кислота, употребляемая чаще всего в виде «хромовой смеси» (смесь бихромата калия или натрия с серной кислотой). Иногда применяются также перманганаты различных металлов или перекись марганца и серная кислота.
2. Дегидрогенизация (дегидрирование) вторичных спиртов
При пропускании паров спирта через нагретые трубки с мелко раздробленной, восстановленной водородом металлической медью вторичные спирты распадаются — на кетон и водород. Несколько хуже эта реакция проходит в присутствии никеля, железа или цинка.
3. Из одноосновных карбоновых кислот
Кетоны могут быть получены сухой перегонкой кальциевых и бариевых солей одноосновных кислот. Для всех кислот, кроме муравьиной, реакция идет следующим образом:
Чаще восстанавливают не самые кислоты, а их производные, например хлорангидриды:
т. е. образуется кетон с двумя одинаковыми радикалами и карбонат кальция.
Если взять смесь солей двух кислот или смешанную соль, то наряду с предыдущей реакцией происходит также реакция между молекулами разных солей:
Вместо сухой перегонки готовых солей используют также контактный способ, так называемую реакцию кетонизации кислот, состоящую в том, что пары кислот пропускают при повышенной температуре над катализаторами, в качестве которых применяют углекислые соли кальция или бария, закись марганца, окись тория, окись алюминия и др.
Здесь сначала образуются соли органических кислот, которые затем разлагаются, регенерируя вещества, являющиеся катализаторами. В результате реакция идет, например, для уксусной кислоты по следующему уравнению:
4. Действие воды на дигалоидные соединения
Кетоны могут получаться при взаимодействии с водой дигалоидных соединений, содержащих оба атома галоида при одном и том же атоме углерода. При этом можно было бы ожидать обмена атомов галоида на гидроксилы и получения двухатомных спиртов, у которых обе гидроксильные группы находятся при одном и том же атоме углерода, например:
Но такие двухатомные спирты в обычных условиях не существуют, они отщепляют молекулу воды, образуя кетоны:
5. Действие воды на ацетиленовые углеводороды (реакция Кучерова)
При действии воды на гомологи ацетилена в присутствии солей окиси ртути, получаются кетоны:
6. Получение с помощью магний- и цинкорганических соединений
При взаимодействии производных карбоновых кислот с некоторыми металлоорганическими соединениями присоединение одной молекулы металлоорганического соединения по карбонильной группе протекает по схеме:
Если на полученные соединения подействовать водой, то они реагируют с ней с образованием в кетонов:
При действии на амид кислоты двух молекул магнийорганического соединения, а затем воды получаются кетоны без образования третичных спиртов:
7. Действие кадмийорганических соединений на хлорангидриды кислот
Кадмийорганические соединения взаимодействуют с хлорангидридами кислот иначе, чем магний- или цинкорганические:
Поскольку кадмийорганические соединения не вступают в реакцию с кетонами, здесь не могут получаться третичные спирты.
Применение кетонов
В промышленности кетоны используют как растворители, фармацевтические препараты и для изготовления различных полимеров. Важнейшими кетонами являются ацетон, метилэтиловый кетон и циклогексанон.
Физиологическое действие
Токсичны. Обладают раздражающим и местным действием, проникают через кожу, особенно хорошо ненасыщенные алифатические. Отдельные вещества обладают канцерогенным и мутагенным эффектом. Галогенпроизводные кетонов вызывают сильное раздражение слизистых оболочек и ожоги при контакте с кожей. Алициклические кетоны обладают наркотическим действием.
Кетоны играют важную роль в метаболизме веществ в живых организмах. Так, убихинон участвует в окислительно-восстановительных реакциях тканевого дыхания. К соединениям, содержащим кетонную группу, относятся некоторые важные моносахариды (фруктоза и др.), терпены (ментон, карвон), компоненты эфирных масел (камфора, жасмон), природные красители (индиго, ализарин, флавоны), стероидные гормоны (кортизон, прогестерон), мускус (мускон), антибиотик тетрациклин.
В процессе фотосинтеза 1,5-дифосфат-D-эритро-пентулозы (фосфолированная кетопентоза) является катализатором. Ацетоуксусная кислота — промежуточный продукт в цикле Креббса.
Наличие в моче и крови человека кетонов говорит о гипогликемии, различных расстройствах метаболизма или кетоацидозе.
Источник
Альдегиды и кетоны
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:
Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
| Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода. |
Структурная формула альдегидов:
| Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами . |
Структурная формула кетонов:
Строение карбонильных соединений
Атом углерода в карбонильной группе находится в состоянии sp 2 -гибридизации и образует три σ-связи и одну π-связь.
Одна из σ–связей – связь С–О, все три σ–связи расположены в одной плоскости под углом 120 о друг к другу.

π-Связь образована р-электронами атомов углерода и кислорода.
Из-за большей электроотрицательности атома кислорода по сравнению с атомом углерода связь С=О сильно поляризована, электронная плотность смещена к более электроотрицательному атому кислорода.
| На атоме кислорода возникает частичный отрицательный (δ – ), а на атоме углерода – частичный положительный (δ + ) заряды. |
Номенклатура карбонильных соединений
- По систематической номенклатуре к названию углеводорода добавляют суффикс «-АЛЬ».
Нумерация ведется от атома углерода карбонильной группы.
| Например, 2-метилпропаналь |
- К названию кетонов добавляют в название суффикс «-ОН». После этого добавляют номер атомов углерода карбонильной группы.
| Например, пентанон-2 |
- Тривиальные названия альдегидов и кетонов приведены в таблице.
Изомерия карбонильных соединений
Изомерия альдегидов
Для альдегидов характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомерия углеродного скелета характерна для альдегидов, которые содержат не менее четырех атомов углерода.
| Например. Ф ормуле С4Н8О соответствуют два альдегида-изомера углеродного скелета |
| Бутаналь | 2-Метилпропаналь |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Альдегиды являются межклассовыми изомерами с кетонами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для альдегидов, которые содержат не менее трех атомов углерода.
| Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3 |
| Пропаналь | Ацетон (пропанон) |
 |  |
Изомерия кетонов
Для кетонов характерна изомерия углеродного скелета, изомерия положения карбонильной группы и межклассовая изомерия.
Изомерия углеродного скелета характерна для кетонов, которые содержат не менее пяти атомов углерода.
| Например. Ф ормуле С5Н10О соответствуют кетоны-изомеры углеродного скелета |
| Пентанон-2 | 3-Метилбутанон-2 |
 |  |
Изомерия положения карбонильной группы характерна для кетонов, которые содержат не менее пяти атомов углерода.
| Например. Ф ормуле С5Н10О соответствуют два кетона-изомера углеродного скелета |
| Пентанон-2 | Пентанон-3 |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Кетоны являются межклассовыми изомерами с альдегидами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для кетонов, которые содержат не менее трех атомов углерода.
| Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3 |
| Пропаналь | Ацетон (пропанон) |
 |  |
Физические свойства альдегидов и кетонов
Все альдегиды и кетоны, кроме формальдегида – жидкости. Лёгкие альдегиды хорошо растворимы в воде из-за водородных связей, которые они образуют с водой.
Химические свойства альдегидов и кетонов
1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
1.1. Гидрирование
Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:
1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.
1.3. Присоединение спиртов
При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
В качестве катализаторов процесса используют кислоты или основания.
Полуацетали существует только при низкой температуре.
| Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. |
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
1.4. Присоединение циановодородной (синильной) кислоты
Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):
2. Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении альдегиды превращаются в карбоновые кислоты. Альдегид → карбоновая кислота
|