- Соли аммония: получение и химические свойства
- Соли аммония
- Способы получения солей аммония
- Химические свойства солей аммония
- Хлорид аммония
- Характеристики и физические свойства хлорида аммония
- Получение хлорида аммония
- Химические свойства хлорида аммония
- Применение хлорида аммония
- Примеры решения задач
- Хлорид аммония
- Содержание
- Физические свойства
- Химические свойства
- Получение
- Как получить хлорид аммония
Соли аммония: получение и химические свойства
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Источник
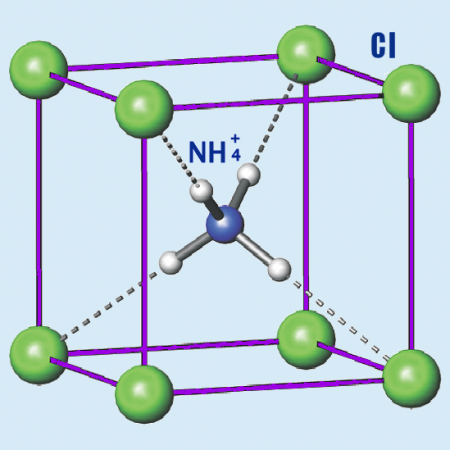
Хлорид аммония
Характеристики и физические свойства хлорида аммония
Рис. 1. Хлорид аммония. Внешний вид.
Основные характеристики хлорида аммония приведены в таблице ниже:
Молярная масса, г/моль
Плотность, г/см 3
Температура плавления, o С
Растворимость в воде (20 o С), г/100 мл
Получение хлорида аммония
Получение хлорида аммония в промышленных масштабах заключается в упаривании маточного раствора, остающегося после отделения гидрокарбоната натрия, образующегося по следующей реакции:
В лабораторных условиях эту соль получают, используя такие реакции, как
Химические свойства хлорида аммония
Хлорид аммония – это средняя соль, образованная слабым основанием – гидроксидом аммония (NH4OH) и сильной кислотой – соляной (хлороводородной) (HCl). В водном растворе гидролизуется. Гидролиз протекает по катиону. Наличие катионов Н + свидетельствует о кислом характере среды.
NH4 + + Cl — + HOH ↔ NH4OH + Cl — + H + ;
При нагревании хлорид аммония как бы возгоняется – разлагается на аммиак и хлороводород, которые на холодных частях сосуда вновь соединяются в хлорид аммония:
Хлорид аммония разлагается концентрированной серной кислотой и щелочами:
Он реагирует с хлором (1), типичными металлами (2), оксидами (3) и нитритами металлов (4):
NH4Cl + 3Cl2 = Cl3N↑ + 4HCl (t = 60 – 70 o C) (1);
2NH4Cl + 4CuO = N2 + 4H2O + CuCl2 + 3Cu (t = 300 o C) (3);
Применение хлорида аммония
Хлорид аммония, или нашатырь, применяется в красильном деле, в ситцепечатании, при паянии и лужении, а также в гальванических элементах. Применение хлорида аммония при паянии основано на том, что он способствует удалению с поверхности металла оксидных пленок, благодаря чему припой хорошо пристает к металлу. При соприкосновении сильно нагретого металла с хлоридом аммония оксиды, находящиеся на поверхности металла, либо восстанавливаются, либо переходят в хлориды. Последние, будучи более летучи, чем оксиды, удаляются с поверхности металла. Для случая меди и железа основные происходящие при этом процессы можно выразить такими уравнениями:
Примеры решения задач
| Задание | Какую массу хлорида аммония можно получить при взаимодействии 17,7 г хлороводорода и 12 л аммиака (н.у.)? Какой объем 0,06М раствора можно приготовить из этой массы соли? |
| Решение | Запишем уравнение реакции: |
Найдем количество моль хлороводорода (молярная масса – 36,5 г/моль) и аммиака, вступивших в реакцию используя данные указанные в условии задачи:
n(HCl) = m (HCl) / M (HCl);
n (HCl) = 17,7 / 36,5 = 0,5моль.
n (NH3) = 12 / 22,4 = 0,54 моль.
Согласно уравнению задачи n (HCl):n (NH3) = 1:1. Это означает, что аммиак находится в избытке и все дальнейшие расчеты следует вести по хлороводороду. Найдем количество вещества и массу образовавшегося хлорида аммония (молярная масса 53,5 г/моль):
n (NH4Cl) = n (HCl) = 0,5моль.
Рассчитаем объем 0,06М раствора, который можно получить из 26,75 г хлорида аммония:
| Задание | Вычислите массовую долю хлорида аммония в растворе, полученном при растворении соли массой 40 г в воде количеством 20 моль. |
| Решение | Найдем массу воды (молярная масса 18г/моль): |
m (H2O)= 20 × 18 = 360 г.
Рассчитаем массу раствора хлорида аммония:
msolution(NH4Cl) = 40 + 360 = 400 г.
Вычислим массовую долю хлорида аммония в растворе:
ω (NH4Cl)=40 / 400 × 100% = 10%.
| Понравился сайт? Расскажи друзьям! | |
| Систематическое наименование | Хлорид аммония |
|---|---|
| Хим. формула | NH4Cl |
| Состояние | бесцветные кубические кристаллы |
| Молярная масса | 53,49 г/моль |
| Плотность | 1,527 г/см³ |
| Т. плав. | возгонка при 337,6 °C |
| Т. субл. | 662 ± 1 градус Фаренгейта |
| Энтальпия образования | -314,2 кДж/моль |
| Давление пара | 1 ± 1 мм рт.ст. |
| Растворимость в воде | (при 20 °C) 37,2 г/100 мл |
| Рег. номер CAS | ГОСТ 3773-72 ГОСТ 2210-73 |
| Рег. номер CAS | [12125-02-9] |
| PubChem | 25517 |
| Рег. номер EINECS | 235-186-4 |
| SMILES | |
| Кодекс Алиментариус | E510 |
| RTECS | BP4550000 |
| ChEBI | 31206 |
| ChemSpider | 23807 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Хлорид аммония (хлористый аммоний; техническое название — нашатырь; NH4Cl) — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Содержание
Физические свойства
Бесцветные или белые кубические кристаллы. Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Химические свойства
- реагирует с щелочами с выделением аммиака:
NH4Cl + NaOH → NaCl + H2O + NH3↑
- реагирует с нитратом серебра с выпадением белого осадка хлорида серебра, темнеющего при действии света:
NH4Cl + AgNO3 → AgCl↓ + NH4NO3
- реагирует с нитритом натрия при нагревании, с образованием хлорида натрия, азота и воды:
NH4Cl + NaNO2 → NaCl + N2↑ + 2H2O
- под действием электрического тока разлагается с образованием хлористого азота NCl3
Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NaCl.
Иногда используют реакцию взаимодействия аммиака с хлором:
Реакция взаимодействия аммиака и соляной кислоты:
Источник
Как получить хлорид аммония
- — мерная колба
- — пробирка
- — реактивы (HCl, NH₄OH, (NH₄)₂SO₄, NaCl)
Промышленный метод получения хлорида аммония: пропустите оксид углерода (IV) через аммиак и хлорид натрия. В результате проведения реакции образуются гидрокарбонат натрия и хлорид аммония. Реакция проходит в обычных условиях без добавления катализаторов.
NH₃ +CO₂ +H₂O+NaCl=NaHCO₃ +NH₄Cl
В лаборатории NH₄Cl можно получить при воздействии гидроксида аммония на раствор соляной кислоты. Дополнительные условия не требуются.
Проведение реакции. По химическому уравнению высчитайте, какое количество исходных веществ необходимо взять. Налейте в пробирку высчитанное колличество соляной кислоты (HCl), добавьте раствор гидроксида аммония.
Результат. В результате нейтрализации кислоты гидроксидом образуется соль (хлорид аммония) и вода.
Другой лабораторный метод получения – взаимодействие двух солей.
Проведение реакции. Рассчитайте количество веществ, вступающих в реакцию. Отмерьте раствор хлорида натрия и добавьте раствор сульфата аммония.
Результат. Реакция проходит в два этапа. Сульфат аммония вступает в реакцию с хлоридом натрия. Ион натрия вытесняет ион аммония из его соединения. На промежуточной стадии образуется сульфат натрия, который в дальнейшем в реакции не участвует. На второй стадии аммиак взаимодействует с раствором соляной кислотой. Визуальный эффект реакции – выделение белого дыма.
(NH₄)₂SO₄ +NaCl=Na₂SO₄ + 2HCl+ 2NH₃↑
HCl+NH₃ =NH₄Cl
Для получении хлорида аммония в лаборатории применяют специальный прибор, чтобы получить нужное вещество в твердом виде. Т.к. при повышении температуры хлористый аммоний распадается на аммиак и хлороводород.
Источник