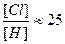- Получение HCl
- Соляная кислота
- Характеристики и физические свойства соляной кислоты
- Получение соляной кислоты
- Химические свойства соляной кислоты
- Применение соляной кислоты
- Примеры решения задач
- Соляная кислота ГОСТ 3118-77
- Содержание
- Физические свойства
- Химические свойства
- Получение
- Применение
- Промышленность
- Медицина
- Особенности обращения
Получение HCl
Хлороводород в промышленности получают либо прямым синтезом из хлора и водорода, либо из побочных продуктов при хлорировании алканов (метана). Мы будем рассматривать прямой синтез из элементов.
HCl – бесцветный газ с резким, характерным запахом
t°пл= –114,8°C, t°кип= –84°C, t°крист= +57°C, т.е. хлороводород можно получать при комнатной температуре в жидком виде, увеличивая давление до 50 – 60 атм. В газовой и жидкой фазе находится в виде отдельных молекул (отсутствие водородных связей). Прочное соединение Есв= 420 кДж/моль. Начинает разлагаться на элементы при t>1500°C.
2HCl 
Эффективный радиус HCl = 1,28 
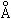
RCl — = 1,81 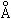
Хлороводород хорошо растворим в воде в любых соотношениях (в одном объеме H2O расторяется до 450 объемов HCl), с водой образует несколько гидратов и дает азеотропную смесь – 20,2% HCl и t°кип= 108,6°C.
Образование хлороводорода из элементов:
Смесь водорода и хлора при освещении взрывается, что указывает на цепной характер реакции.
В начале века Баденштейн предложил следующий механизм реакции:
Инициирование: Cl2 + hν → ē + Cl2 +
Обрыв цепи: Cl + + ē → Cl
Но ē в сосуде обнаружен не был.
В 1918 г. Нернст предложил другой механизм:
Инициирование: Cl2 + hν → Cl• + Cl•
Цепь: Cl• + H2 → HCl + H•
Обрыв цепи: H• + Cl• → HCl
В дальнейшем этот механизм получил дальнейшее развитие и дополнение.
1 стадия – инициирование
реакция Cl2 + hν → Cl• + Cl•
Инициируется фотохимическим путем, т.е. путем поглощения кванта света hν. Согласно принципу эквивалентности Эйнштейна каждый квант света может вызвать превращение только одной молекулы. Количественной характеристикой принципа эквивалентности является квантовый выход реакции:
– количество прореагировавших молекул приходящихся на 1 квант света.
γ в обычных фотохимических реакциях ≤1. Однако в случае цепных реакций γ>>1. Например, в случае синтеза HCl γ=10 5 , при распаде H2O2 γ=4.
Если молекула Cl2 поглотила квант света, то она находится в возбужденном состоянии
10 -8 -10 -3 сек и, если полученной с квантом света энергии хватило для превращения, то происходит реакция, если нет, то молекула снова перейдет в основное состояние, либо с испусканием кванта света (флуоресценция или фосфоресценция), либо электронное возбуждение конверсируется в энергию колебания или вращения.
Посмотрим, что происходит в нашем случае:
Еобр HCl = 432,82 кДж/моль – без облучения реакция не идет.
Квант света имеет энергию Екв = 41,1*10 -20 Дж. Энергия, необходимая для начала реакции (энергия активации) ровна энергии, затраченной диссоциацию молекулы Cl2:
В отличие от катализа, при котором потенциальный барьер снижается, в случае фотохимических реакций он просто преодолевается за счет энергии кванта света.
Еще одна возможность инициирования реакции – добавление паров Na в смесь H2+Cl2. Реакция идет при 100°C в темноте:
Na + Cl2 → NaCl + Cl•
и образуется до 1000 HCl на 1 атом Na.
2 стадия – продолжение цепи
Реакции продолжения цепи при получении HCl бывают следующих типов:
1. Cl• + H2 → HCl + H• Ea=2,0 кДж/моль
2. H• + Cl2 → HCl + Cl• Ea=0,8 кДж/моль
Это звенья цепи.
Скорость данных реакций можно представить следующим образом:
Т.к. энергии активации этих реакций малы, то их скорости велики. Цепи в данном случае неразветвленные, а по теории неразветвленных цепей:
Wразвитие цепи = Wициируется фотохимическим путем, т.е. путем поглощения кванта светаобрыва,
тогда, если считать, что обрыв квадратичен:

в данном случае W1 =W2, т.к.цепи достаточно длинные (из теории цепных реакций)
Данное кинетическое уравнение справедливо в отсутствие примесей в смеси H2 + Cl2. Если в систему попадет воздух, то кинетическое уравнение будет иное. В частности
Wобр = K[Cl•], т.е. не квадратичный обрыв и ход процесса полностью меняется.
Т.к. есть вещества, являющиеся ингибиторами цепных реакций. Ингибитором реакции образования HCl является кислород:
Этот радикал малоактивен и может реагировать только с таким же радикалом, регенерируя кислород
Расчеты показывают, что в присутствии 1% O2 реакция замедляется в 1000 раз. Еще более сильно замедляет скорость процесса присутствие NCl3, который замедляет реакцию в 10 5 раз сильнее, чем кислород. Т.к. хлорид азота может присутствовать в хлоре в процессе его получения в промышленности, необходима тщательная очистка исходного хлора перед синтезом HCl.
Механизм действия NCl3:
и восстановление Cl• идет чрезвычайно медленно и идет процесс
3 стадия – обрыв цепи
Представление Нернста о механизме обрыва цепи при тщательном исследовании не подтвердилось.
В данном случае возможно 3 способа рекомбинации радикалов:
1. Cl• + Cl• +М → Cl2 + М
2. H• + H• + М → H2 + М
3. H• + Cl• + М → HCl + М

Отсюда , что при t
600°C и [Cl2] ≈ [H2] (условия синтеза HCl), дает
Следовательно, скорость рекомбинации по 1 будет в 25 раз выше, чем по 3 и в 625 раз, чем по 2, т.е. процессами 2 и 3 можно практически пренебречь.
Дата добавления: 2015-06-17 ; просмотров: 4597 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Соляная кислота
Характеристики и физические свойства соляной кислоты
Сильная кислота: pKa = -7,1. Концентрированная соляная кислота содержит около 37% HCl.
Основные физические свойства соляной кислоты приведены в таблице:
Температура плавления, o С
Температура кипения, o С
Энтальпия образования, кДж/моль
Плотность, г/см 3
Удельная теплоемкость, кДж/(кг×К)
Получение соляной кислоты
Соляная кислота получается растворением в воде хлороводорода. В настоящее время основным способом промышленного получения хлороводорода является синтез его из водорода и хлора:
Этот процесс осуществляют в специальных установках, в которых смесь водорода и хлора непрерывно образуется и тут же сгорает ровным пламенем. Тем самым достигается спокойное (без взрыва) протекание реакции. Исходным сырьем для получения хлороводорода служат хлор и водород, образующиеся при электролизе раствора хлорида натрия.
Большие количества соляной кислоты получают также в качестве побочного продукта хлорирования органических соединений согласно уравнению реакции, представленному ниже:
где R – углеводородный радикал.
Химические свойства соляной кислоты
Соляная кислота – сильный электролит. Для нее характерны следующие химические свойства, общие для всех кислот:
— способность взаимодействовать с основаниями с образованием солей:
— способность взаимодействовать с некоторыми металлами с выделением водорода (разбавленный раствор):
— способность вступать в реакции взаимодействия с основными и амфотерными оксидами с образованием солей и воды:
— способность взаимодействовать с солями более слабых кислот:
— способность изменять цвета индикаторов, в частности, вызывать красную окраску лакмуса;
При диссоциации соляной кислоты образуются ионы водорода:
Нагревание смеси растворов соляной и азотной кислот до температуры 100-150 o С приводит к образованию очень сильного окислителя — соединения, которое называют «царская водка»:
Соляная кислота в окислительно-восстановительных реакциях может выступать и как восстановитель (за счет хлорид-аниона Cl — ) и как окислитель (за счет катиона водорода H + ). Уравнения ОВР с участием соляной кислоты приведены ниже:
Применение соляной кислоты
Соляная кислота – одна из важнейших кислот в химической практике. Ежегодное мировое производство соляной кислоты исчисляется миллионами тонн. Широкое применение находят также многие её соли.
Соляная кислота применяется в таких областях народного хозяйства как гидрометаллургия и гальванопластика, для травления, декапирования и лужения поверхности металлов; пищевом производстве, как регулятор кислотности (добавка Е507); в медицине, в качестве лекарства (смесь с ферментом пепсином) при недостаточной кислотности желудка.
Примеры решения задач
| Задание | Какова концентрация хлорид-ионов в растворе, полученном при сливании равных объемов растворов 2×10 -5 М хлорида натрия, 0,33×10 -4 М хлорида калия и 5,0×10 -6 М соляной кислоты? |
| Решение | Сначала преобразуем числа так, чтобы показатели степеней привести к наибольшему: |
5,0×10 -6 = 0,050×10 -4 .
Итого: 0,2×10 -4 + 0,33×10 -4 + 0,050×10 -4 = 0,580×10 -4 . Число значащих цифр суммы должно определяться числом 0,2×10 -4 , имеющим наименьшее число значащих десятичных знаков. Поэтому полученную сумму округляем до первой цифры после запятой, т.е. 0,6×10 -4 . В конечном объеме концентрация хлорид-ионов составляет:
0,6×10 -4 / 3 = 0,2×10 -4 М.
| Задание | Рассчитайте рН 0,001 М раствора соляной кислоты. |
| Решение | Для раствора сильной кислоты: |
По аналогии с раствором сильной кислоты для раствора сильного основания:
Источник
Соляная кислота ГОСТ 3118-77
| Соляная кислота | |
|---|---|
  |
наименование
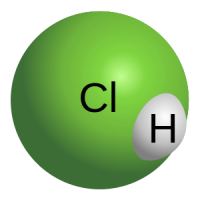
Соляная кислота (также хлороводородная, хлористоводородная кислота, хлористый водород) — раствор хлороводорода (HCl) в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около ω = 0,5 % присутствует в желудке человека, что соответствует pH = pω − lg ( ρH2O / μHCl ) ≅ 0,86 . Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см³. Соли соляной кислоты называются хлоридами.
Содержание
Физические свойства
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Конц. (вес), кг HCl/кг | Конц. (г/л), кг HCl/м³ | Плотность, кг/л | Молярность M | Водородный показатель (pH) | Вязкость, мПа·с | Удельная теплоемкость, кДж/(кг·К) | Давление пара, Па | Температура кипения, °C | Температура плавления, °C |
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 0,527 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 27,3 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 1,410 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,130 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 6,733 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,100 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,000 | 48 | −26 |
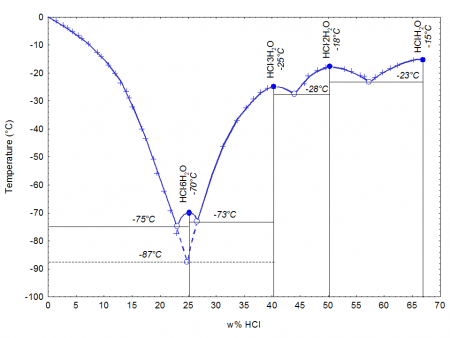
При 20 °C, 1 атм (101 кПа)При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
Химические свойства
- Взаимодействие с металлами, стоящими в ряду электрохимических потенциалов до водорода, с образованием соли и выделением газообразного водорода:
2Na + 2HCl ⟶ 2NaCl + H2 ↑ Mg + 2HCl ⟶ MgCl2 + H2 ↑ 2Al + 6HCl ⟶ 2AlCl3 + 3H2 ↑
- Взаимодействие с оксидами металлов с образованием растворимой соли и воды:
Na2O + 2HCl ⟶ 2NaCl + H2O MgO + 2HCl ⟶ MgCl2 + H2O Al2O3 + 6HCl ⟶ 2AlCl3 + 3H2O
- Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
NaOH + HCl ⟶ NaCl + H2O Ba(OH)2 + 2HCl ⟶ BaCl2 + 2H2O Al(OH)3 + 3HCl ⟶ AlCl3 + 3H2O
- Взаимодействие с солями металлов, образованных более слабыми кислотами, например угольной:
Na2CO3 + 2HCl ⟶ 2NaCl + H2O + CO2 ↑
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
2KMnO4 + 16HCl ⟶ 5Cl2 ↑ + 2MnCl2 + 2KCl + 8H2O
- Взаимодействие с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристалликов хлорида аммония:
NH3 + HCl ⟶ NH4Cl
- Качественной реакцией на соляную кислоту и её соли является её взаимодействие с нитратом серебра, при котором образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте:
HCl + AgNO3 → AgCl ↓ + HNO3
Получение
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Применение
Промышленность
- Применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при пайке и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
- В пищевой промышленности зарегистрирована как регулятор кислотности (пищевая добавка E507). Применяется для изготовления зельтерской (содовой) воды.
Медицина
- Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Особенности обращения
Высококонцентрированная соляная кислота — едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен.
Источник