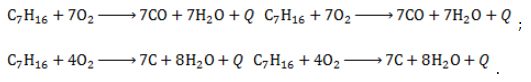- Изомеры гептана, строение и свойства
- Химическое строение и формула гептана
- Изомеры гептана
- Структурная изомерия
- Оптическая изомерия
- Список изомеров
- Физические свойства
- Свойства изомеров гептана
- Химические свойства
- Получение гептана и его изомеров
- Применение гептана и его изомеров
- Заключение
- Гептан: способы получения и химические свойства
- Гомологический ряд гексана
- Строение гексана
- Изомерия гексана
- Структурная изомерия
- Химические свойства гексана
- 1. Реакции замещения
- 1.1. Галогенирование
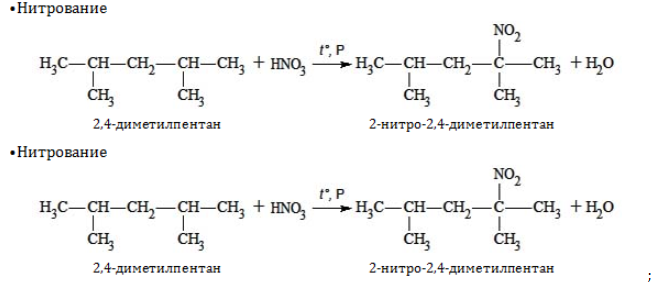
- 1.2. Нитрование гексана
- 2. Дегидрирование гексана
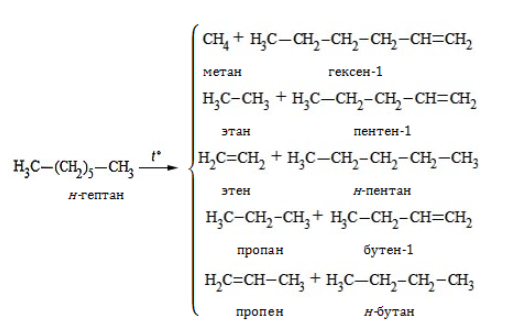
- 3. Крекинг
- 4. Окисление гексана
- Полное окисление – горение
- 5. Изомеризация гексана
- Получение гексана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Гидрирование алкенов и алкинов
- 3. Синтез Фишера-Тропша
- 4. Получение гексана в промышленности
Изомеры гептана, строение и свойства
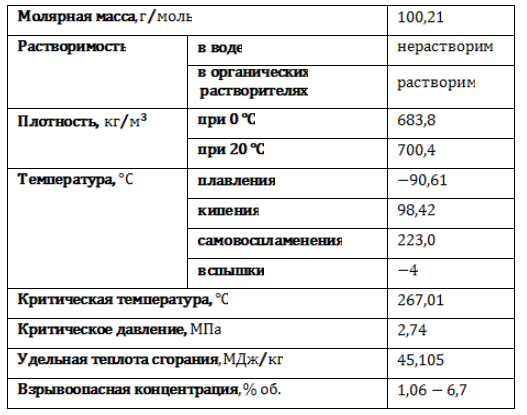
Гептан – седьмой член гомологического ряда алканов. Вследствие различий в порядке соединения и пространственного расположения атомов в молекуле гептан образует несколько изомеров, проявляющих разные свойства. Источником получения гептана служат нефть и нефтепродукты, попутный и природный газ.
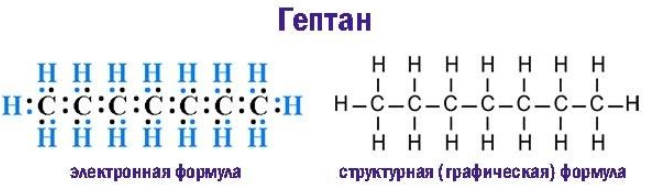
Химическое строение и формула гептана
Предельные углеводороды, к числу которых относится гептан, характеризуются полным насыщением всех валентностей углерода. Располагая каждый четырьмя свободными валентностями, sp3-гибридизованные углеродные атомы в молекулах алканов образуют насыщенные водородом цепочки состава 
Каждая общая электронная пара, возникающая при взаимодействии атомов, соответствует одинарной (простой) ковалентной 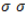
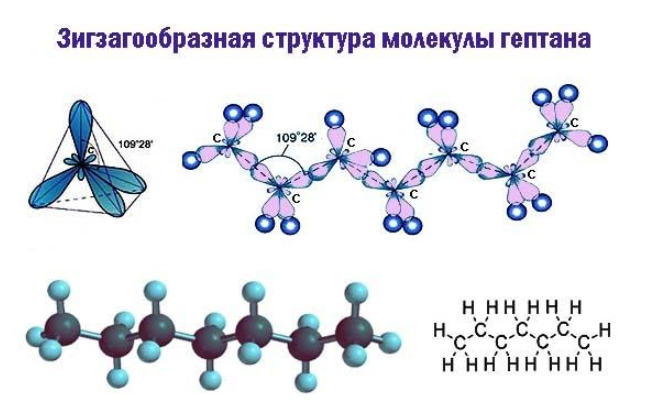
Скелетная формула представляет строение гептана в компактном виде как зигзагообразную линию. Атомы, формирующие углеродный скелет, находятся в вершинах и на концах линии; при записи их обозначения обычно опускают:
В двумерной форме зигзаг более точно показывает строение молекулы, так как ориентация связей C-C соответствует углу 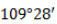
Изомеры гептана
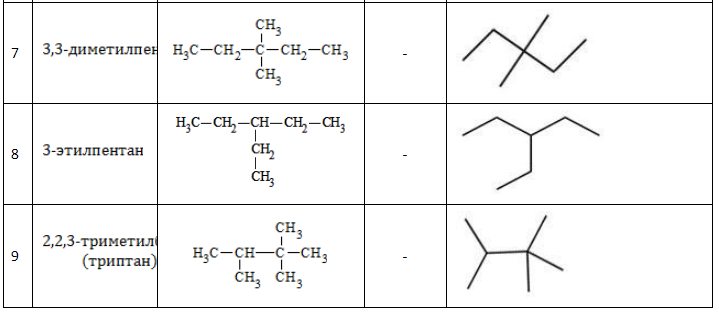
Благодаря возможности ветвления углеродного скелета и пространственным различиям в положении одинаковых алкильных радикалов соединениям состава свойственна изомерия. Всего у гептана насчитывается 11 изомерных вариантов.
Структурная изомерия
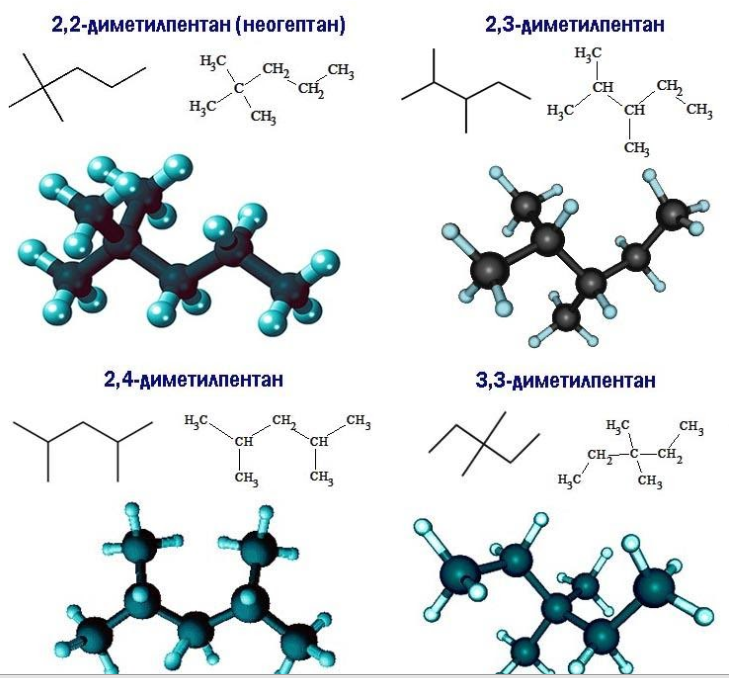
Существует девять изомеров с химической формулой C7H16, различающихся строением молекулы. По длине главной углеродной цепочки, по типу и числу радикалов они подразделяются следующим образом:
- н-гептан
;
- метилгексаны (2);
- диметилпентаны (4);
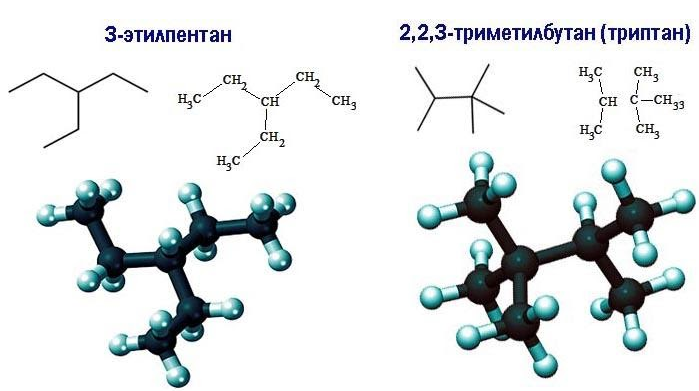
- 3-этилпентан;
- 2,2,3-триметилбутан.
Оптическая изомерия
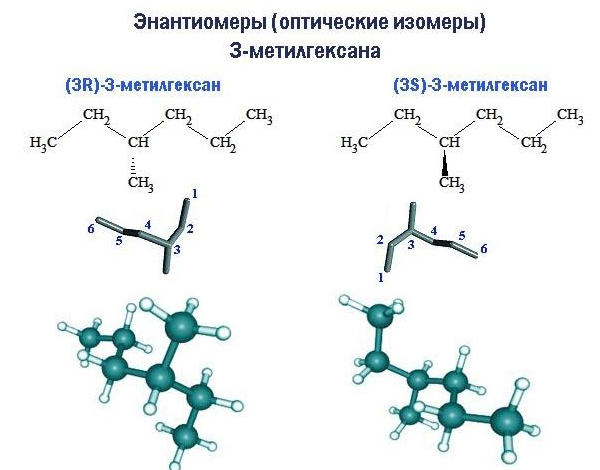
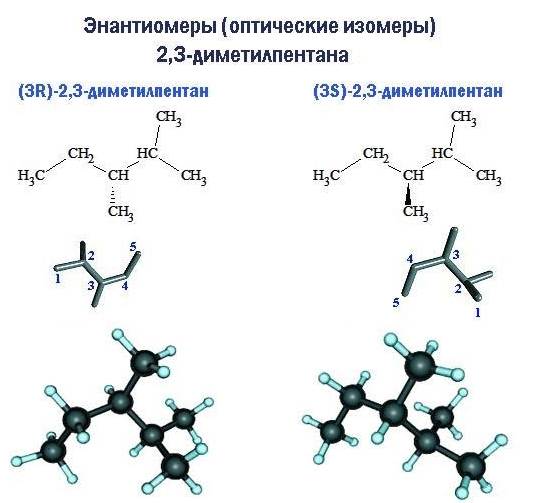
Если при одинаковой структуре молекулы расположение радикалов таково, что молекула не имеет зеркальной симметрии, возникает пространственная изомерия оптического типа.
Молекулы оптических изомеров (иначе называемых энантиомерами) обладают свойством хиральности: зеркально отображая друг друга, они при вращении не становятся идентичными. Примером хиральности является отличие правой ладони от левой. Центром хиральности молекулы является тот атом углерода, к которому у энантиомеров присоединены радикалы, по-разному ориентированные в пространстве.
Хиральность свойственна двум из девяти структурных изомеров гептана. Каждое из этих соединений – 3-метилгексан и 2,3-диметилпентан – существует в форме двух энантиомеров, обозначаемых как правый (R) и левый (S) изомеры. При этом указывается номер центра хиральности в углеродной цепи.
В среде с оптической активностью или в химической реакции с другим хиральным соединением энантиомеры ведут себя различно. В других случаях их свойства одинаковы.
Список изомеров
Все изомеры гептана с названиями и формулами, с учетом наличия энантиомеров, перечислены в таблице:

Физические свойства
Гептан в обычных условиях представляет собой легкую подвижную жидкость с резким специфическим запахом, без цвета. Пары гептана тяжелее воздуха и образуют с ним взрывоопасную смесь. Основные физические свойства н-гептана приведены в таблице:
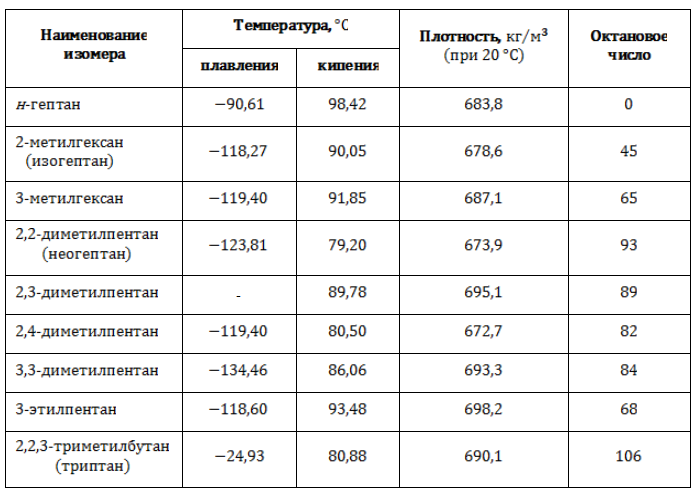
Свойства изомеров гептана
Различия в строении молекулы являются причиной неодинаковости плотностных и термических характеристик изомеров, в том числе и такой важной, как детонационные свойства.
Устойчивость горючего к взрыву при сжатии выражают через октановое число, сравнивая топливо с эталоном. В состав эталонной смеси входят н-гептан, который крайне склонен к детонации, и чрезвычайно устойчивый к ней изооктан. Процентное содержание изооктана в эталонной смеси называется октановым числом.
Существует зависимость между степенью разветвленности молекулы и стойкостью углеводорода к детонации. Чем больше алкильных радикалов и, соответственно, третичных и четвертичных углеродных атомов содержит молекула, тем выше антидетонационная характеристика и качество топлива.
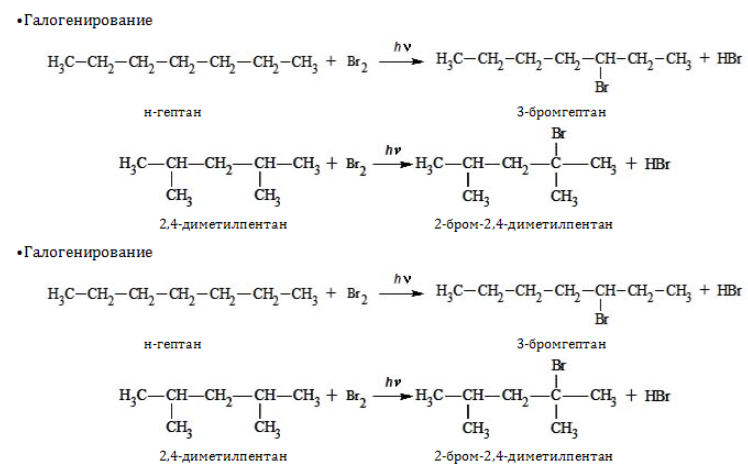
Химические свойства
Гептан и его изомеры – предельные углеводороды и проявляют все химические свойства, присущие данному классу органических соединений. Вследствие насыщенного характера всех связей они вступают только в реакции, протекающие с разрывом ковалентной связи. При этом, как правило, необходимо подвергнуть реагенты нагреванию и использовать катализаторы.
При недостатке кислорода продуктами неполного сгорания гептана являются угарный газ и сажа:
3. Разложение на низшие алканы и алкены при нагревании без доступа кислорода (крекинг):
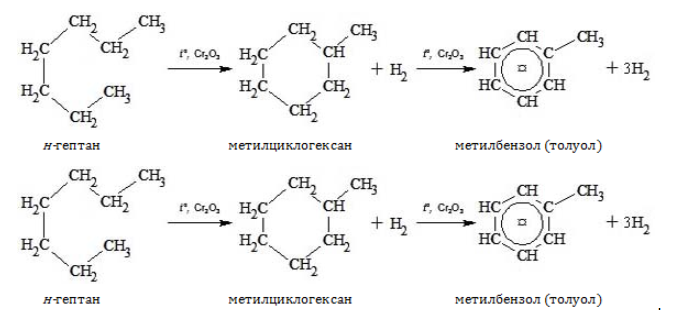
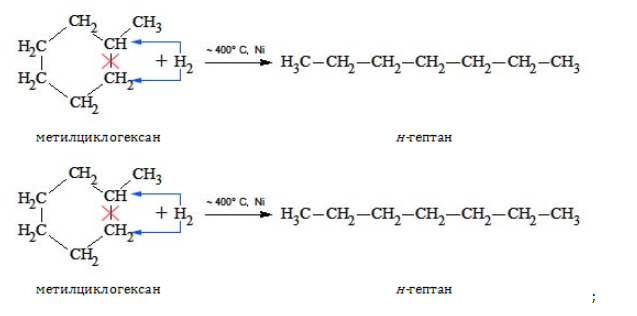
4. Дегидрирование с образованием циклического углеводорода (дегидроциклизация):
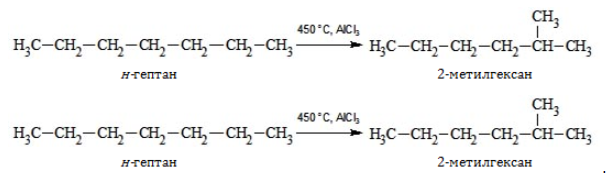
5. Изомеризация с ветвлением углеродного скелета:
Получение гептана и его изомеров
Промышленное получение соединений с химическим составом С7H16 проводится при добыче и переработке природного газа и нефти либо методом синтеза Фишера–Тропша наряду с прочими углеводородами:
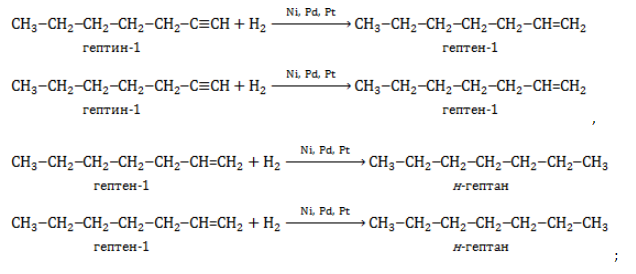
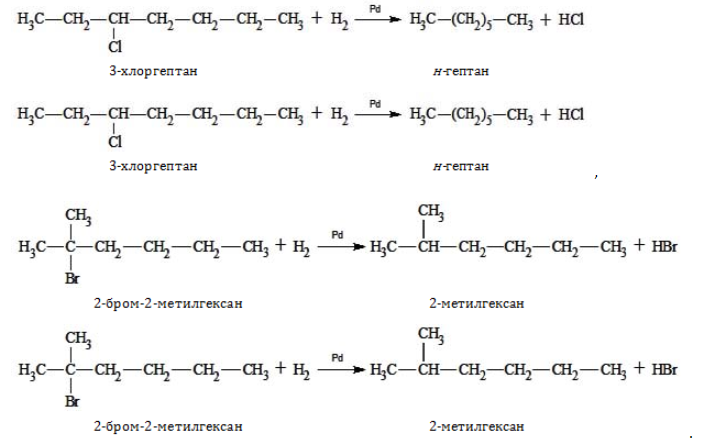
В лабораторной практике гептан и изомеры синтезируются следующими способами:
- гидрирование алкинов и алкенов:
- восстановление галогенпроизводных предельных углеводородов:
Применение гептана и его изомеров
Углеводороды состава C7H16 используются в различных отраслях в зависимости от свойств.
1. В топливной промышленности находят применение:
- н-гептан – в качестве компонента эталонной смеси для определения антидетонационных качеств горючего;
- 2,2,3-триметилбутан (триптан) повышает устойчивость к детонации и добавляется в бензин как присадка.
2. В нефтепереработке и химической промышленности:
- н-гептан играет важную роль в процессах циклизации и ароматизации углеводородов, например, при получении толуола.
3. В качестве растворителя (чистый н-гептан либо в смеси с изомерами):
- для обработки склеиваемых поверхностей в производстве различных изделий из пластических масс;
- в технологиях экстрагирования растительных масел.
Заключение
В отношении пожаро- и взрывоопасности гептан входит в число опасных грузов III класса (легковоспламеняющиеся жидкости). Гептан оказывает раздражающее воздействие на центральную нервную систему и по шкале токсикологической опасности относится к веществам IV класса. При длительной работе с ним необходимо защищать кожные покровы и органы дыхания.
При использовании защитных средств, соблюдении герметичности тары и оборудования, вентиляции помещений работа с гептаном не представляет угрозы. Большим преимуществом гептана, как и прочих жидких углеводородов, является удобство хранения и транспортировки по сравнению с газообразными низшими алканами.
Источник
Гептан: способы получения и химические свойства
Гексан C6H14 – это предельный углеводород, содержащий шесть атомов углерода в углеродной цепи. Бесцветная жидкость с характерным запахом, нерастворим в воде и не смешивается с ней.
Гомологический ряд гексана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение гексана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp 3 :

При образовании связи С–С происходит перекрывание sp 3 -гибридных орбиталей атомов углерода:

При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:

Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:

Это соответствует тетраэдрическому строению.
| Например, в молекуле гексана C6H14 атомы водорода располагаются в пространстве в вершинах тетраэдров, центрами которых являются атомы углерода. При этом углеродный скелет имеет зигзагообразное строение. |
Изомерия гексана
Структурная изомерия
Дл я гексана характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Для углеводородов состава С6Н14 существуют пять изомеров углеродного скелета: н-гексан, 2-метилпентан, 3 -метилпентан, 2,2-диметилбутан, 2,3-диметилбутан |
| Гексан | 2-Метилпентан |
| CH3-CH2-CH2-CH2-CH2-CH3 | CH3-CH(CH3)-CH2-CH2-CH3 |
Для гексана не характерна пространственная изомерия.
Химические свойства гексана
Гексан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для гексана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для гексана характерны радикальные реакции.
Гексан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Гексан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании гексана образуется смесь хлорпроизводных.
| Например , при хлорировании гексана образуются 1-хлоргексан, 2-хлоргексан и 3-хлоргексан: Бромирование протекает более медленно и избирательно.
|

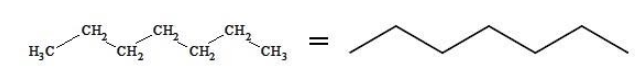
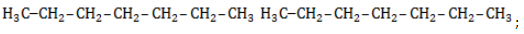 ;
;