- Галогены
- Методы синтеза галогеноводородов
- Все способы получения галогеноводородов
- Владельцы сайта
- Галогены
- Химия неметаллов VIIA группы.mp4
- Галогены
- Получение хлора.mp4
- Взаимодействие хлора с медью.mp4
- Взаимодействие хлора с водородом.mp4
- Р хлор.mp4
- Взаимодействие хлора со скипидаром.mp4
- Виртуальная практическая работа
- Лабораторная работа “Химические свойства галогенов” (проделайте опыты, уравнения реакций можно не составлять)
- химические свойства галогенов
- 5 пропущенных слов
- Растворение стекла в плавиковой кислоте.mp4
- Галогениды — соли галогеноводородов
- Качественные реакции на хлорид , бромид и йодид ионы.mp4
- Применение галогенов и их соединений
- Токсичность галогенов
Галогены
Галогены (греч. hals — соль + genes — рождающий) — химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.
Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 5 :
- F — 2s 2 2p 5
- Cl — 3s 2 3p 5
- Br — 4s 2 4p 5
- I — 5s 2 5p 5
- At — 6s 2 6p 5
Для галогенов характерны нечетные степени окисления: -1, +1, +3, +5, +7. Это связано с электронной конфигурацией атомов в возбужденном состоянии.
Природные соединения
- NaCl — галит (каменная соль)
- CaF2 — флюорит, плавиковый шпат
- NaCl*KCl — сильвинит
- 3Ca3(PO4)2*CaF2 — фторапатит
- MgCl2*6H2O — бишофит
- KCl*MgCl2*6H2O — карналлит
Простые вещества — F2, Cl2, Br2, I2
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте — HF — был впервые получен фтор.
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
В лабораторных условиях галогены могут быть получены следующими реакциями.
- Реакции с металлами
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Реакции с неметаллами
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность 😉
Br2 + F2 → BrF (фтор более электроотрицателен, чем бром — F — )
Br2 + I2 → IBr3 (бром более электроотрицателен, чем йод — Br — )
Реакции с водой
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
Хлор реагирует с водой обратимо, образуя хлорную воду — смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.
Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами — только при нагревании.
Реакции с щелочами
Cl2 + NaOH → NaCl + NaClO + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF — фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl — хлороводород (газ), соляная кислота (жидкость)
- HBr — бромоводород, бромоводородная кислота
- HI — йодоводород, йодоводородная кислота
- HAt — астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI — газы, хорошо растворимые в воде.
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
HF — является слабой кислотой, HCl, HBr, HI — сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
KOH + HCl → KCl + H2O (реакция нейтрализации)
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Методы синтеза галогеноводородов



Известны три основных метода синтеза галогеноводородов.
1. Прямой синтез из элементов. Фтор и хлор реагируют с водородом со взрывом, что является следствием цепного механизма реакции. Однако при определенных соотношениях давлений водорода (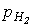
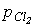
2. Вытеснение из солей. Газообразные НХ выделяются при действии нелетучих сильных кислот на твердые ионные галогениды металлов : (на практике пользуются 70-85%-ным р-ром серной к-ты, т.к. реакция идет на поверхности кристаллов соли. Если брать конц. к-ту, осаждается NaHSO4. При использовании разб серной к-ты значительная часть HCl остается в р-ре. Выделяющийся HCL сушат над конц. серной к-той. Оксид фосфора для этого непригоден так как взаимодействует с HCL: P4O10 + 12HCL = 4POCL3 + 6H2O
CaF2 + H2SO4(конц) = CaSO4 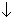
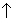
NaCl + H2SO4(конц) = NaHSO4 + HCl
При получении HBr и HI, обладающих сильными восстановительными свойствами, используют нелетучие кислоты-неокислители, например, H3РO4:
KX + H3РO4(конц) 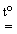
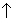
3. Гидролиз галогенидов неметаллов. Большинство галогенидов неметаллов относятся к соединениям с ковалентной связью и гидролизуются с выделением соответствующего галогеноводорода, например,
SiCl4 + 4H2O = SiO2 . 2H2O + 4HCl
Для получения галогеноводородов часто используют реакции гидролиза галогенидов фосфора PX3 (X = Cl, Br, I):
PX3 +3H2O(хол) = H3PO3 + 3HX 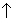
При получении НХ (X = Br, I) нет необходимости предварительно синтезировать PХ3. Например, для получения HI механическую смесь I2 + Pкр обрабатывают водой:
2Pкр + 3I2 + 6H2O = 2H3PO3 + 6HI 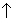
Существуют и другие методы синтеза галогеноводородов. HF, например, можно получить нагреванием твердых бифторидов щелочных металлов:
KHF2 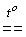
Галогеноводороды образуются также при галогенировании органических соединений, например:
RH +Cl2 = RCl + HCl 
Иодистоводородную кислоту можно получить пропусканием H2S через суспензию I2:
H2S + I2 = 2HI + S
Источник
Все способы получения галогеноводородов
3669 дн. с момента
как существует сайт
Владельцы сайта
Галогены
Химия неметаллов VIIA группы.mp4
Галогены – это элементы VII A группы главной подгруппы. К ним относятся: фтор, хлор, бром, йод и астат, который очень редко встречается в природе.
Все эти элементы являются типичными неметаллами. Галогены, означает « рождающие соли»
Рассмотрим таблицу, в которой отражены физические свойства галогенов.
Фтор является светло-жёлтым газом, хлор – жёлто-зелёный газ, бром – бурая жидкость, а йод – твёрдое вещество чёрно-серого цвета.


И з таблицы видно, что с ростом молекулярной массы увеличиваются температуры кипения и плавления галогенов, их плотность.
Это связано, прежде всего, с увеличением размеров атомов и молекул, а, следовательно, и силами межмолекулярного взаимодействия.
От фтора к йоду усиливается интенсивность окраски галогенов, а у кристаллов йода появляется металлический блеск.
Галогены – химически активные соединения, их активность уменьшается от фтора к йоду.
Фтор самый активный галоген, который при нагревании реагирует даже с золотом, серебром и платиной. Алюминий и цинк в атмосфере фтора воспламеняются.
Галогены
1. Электролиз растворов и расплавов галогенидов:
2 KF = 2 K + F 2 (единственный способ полученияя F 2 )
2. Окисление галогенводородов:
2 KMnO 4 +16 HCl =2 KCl +2 MnCl 2 +5 Cl 2 +8 H 2 O – лабораторный способ получения хлора
Получение хлора.mp4
MnO 2 + 4 HHal = MnHal 2 + Hal 2 + 2 H 2 O – Лабораторный — (Для получения хлора, брома, иода)
3. Промышленный способ – окисление хлором (для брома и йода):
Реакции с металлами
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
2Al + 3F 2 → 2 AlF 3
Cu + Cl 2 → CuCl 2
Взаимодействие хлора с медью.mp4
2Na + Br 2 → 2NaBr
Реакции с неметаллами
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
2Cl 2 + Si → SiCl 4
Cl 2 + H 2 →2 HCl (на свету)
Взаимодействие хлора с водородом.mp4
F 2 + H 2 → 2HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность 😉
Br 2 + F 2 →2 BrF (фтор более электроотрицателен, чем бром — F — )
Br 2 + 3 I 2 →2 BrI 3 (бром более электроотрицателен, чем йод — I — )
Р хлор.mp4
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
2H 2 O + 2F 2 →4 HF + O 2
Хлор реагирует с водой обратимо, образуя хлорную воду — смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.
Cl 2 + H 2 O → HCl + HClO
H 2 O + Br 2 → HBr + HBrO
Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами — только при нагревании.
Реакции с щелочами
Cl 2 + 2NaOH → NaCl + NaClO + H 2 O
3Cl 2 + 6NaOH → 5NaCl + NaClO 3 + 3H 2 O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
2KCl + F 2 → 2KF + Cl 2
2KBr + Cl 2 → 2KCl + Br 2
KBr + I 2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Взаимодействие хлора с органическими веществами
Взаимодействие хлора со скипидаром.mp4
Виртуальная практическая работа
Лабораторная работа “Химические свойства галогенов” (проделайте опыты, уравнения реакций можно не составлять)
Модуль включает модели приборов и веществ, необходимых для изучения химических свойств хлора, инструкцию, указывающую порядок действий. Ученику предлагается провести взаимодействие хлора с серой и медью, сфотографировать результаты взаимодействия.
Если Вы хорошо изучили эту часть урока, вставьте 5 пропущенных слов в тексте.
химические свойства галогенов
5 пропущенных слов
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF — фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl — хлороводород (газ), соляная кислота (жидкость)
- HBr — бромоводород, бромоводородная кислота
- HI — йодоводород, йодоводородная кислота
- HAt — астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI — газы, хорошо растворимые в воде.
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
H 2 + Cl 2 → 2HCl
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
NaCl + H 2 SO 4 → NaHSO 4 + HCl↑
CaF 2 + H 2 SO 4 → CaSO 4 + 2HF
PBr 3 + 3H 2 O → 3HBr↑ + H 3 PO 3
H 2 S + I 2 → S + 2HI
HF — является слабой кислотой, HCl, HBr, HI — сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Mg + 2HBr → MgBr 2 + H 2 ↑
Zn + 2HCl → ZnCl 2 + H 2 ↑
Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
Na 2 O + 2HCl → 2NaCl + H 2 O
ZnO + 2HI → ZnI 2 + H 2 O
KOH + HCl → KCl + H 2 O (реакция нейтрализации)
Cr(OH) 3 + 3HCl → CrCl 3 + 3H 2 O
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
AgNO 3 + HCl → AgCl + HNO 3
Li 2 CO 3 + 2HBr →2 LiBr + H 2 CO 3
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
4HI + MnO 2 → I 2 + MnI 2 + 2H 2 O
2HI + H 2 SO 4 → I 2 + H 2 S + H 2 O
4HI + O 2 → 2H 2 O +2 I 2
2HI + Br 2 → 2HBr + I 2
2HCl + H 2 SO 4 → Cl 2 + SO 2 + 2H 2 O
В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO 2 с плавиковой кислотой.
SiO 2 + 4HF → SiF 4 + 2H 2 O
Растворение стекла в плавиковой кислоте.mp4
Галогениды — соли галогеноводородов
Обнаружить ионы галогенов возможно воздействием на растворы солей, содержащих галоген ион нитратом серебра (AgNO3). При наличии хлор-иона образуется белый творожистый осадок хлорида серебра: NaCl + AgNO3 → NaNO3 + AgCl↓ При наличии бром-иона образуется бледно-желтый творожистый осадок бромида серебра: NaBr + AgNO3 → NaNO3 + AgBr↓ При наличии бром-иона образуется желтый творожистый осадок иодида серебра: NaJ + AgNO3 → NaNO3 + AgJ↓
Осадки не растворимы в воде и азотной кислоте.
Качественные реакции на хлорид , бромид и йодид ионы.mp4
Применение галогенов и их соединений
Природное соединение фтора — криолит Na 3AlF 6 — применяется при получении алюминия. Соединения фтора используются в качестве добавок в зубные пасты для предотвращения заболеваний кариесом.
Хлор широко используется для получения соляной кислоты, в органическом синтезе при производстве пластмасс и синтетических волокон, каучуков, красителей, растворителей и др. Многие хлорсодержащие соединения используют для борьбы с вредителями в сельском хозяйстве. Хлор и его соединения применяются для отбеливания льняных и хлопчатобумажных тканей, бумаги, обеззараживания питьевой воды. Правда, применение хлора для обеззараживания воды далеко не безопасно, для этих целей лучше использовать озон. Простые вещества и соединения брома и иода используются в фармацевтической и химической промышленности.
Токсичность галогенов
Вследствие высокой реакционной способности (особенно это ярко проявляется у фтора) все галогены являются ядовитыми веществами с сильно выраженным удушающим и поражающим ткани воздействиями.Большую опасность представляют пары и аэрозоль фтора, так как в отличие от других галогенов имеют довольно слабый запах и ощущаются только в больших концентрациях.
Источник






















