- Этилен
- Характеристики и физические свойства этилена
- Получение этилена
- Химические свойства этилена
- Применение этилена
- Примеры решения задач
- Этилен (этен), получение, свойства, химические реакции
- Электронное и пространственное строение молекулы
- Видео
- Получение
- Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
- Получение этилена
- Примеры решения задач
- Практическая работа № 2 Получение этилена и изучение его свойств.
- Дистанционное обучение как современный формат преподавания
- Современные педтехнологии в деятельности учителя
- Методическая работа в онлайн-образовании
- Оставьте свой комментарий
- Безлимитный доступ к занятиям с онлайн-репетиторами
- Подарочные сертификаты
- Этилен (этен), получение, свойства, химические реакции
- Этилен (этен), получение, свойства, химические реакции.
- Этилен (этен), формула, газ, характеристики:
- Физические свойства этилена (этена):
- Химические свойства этилена (этена):
- Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
- Применение и использование этилена (этена):
Этилен
Характеристики и физические свойства этилена
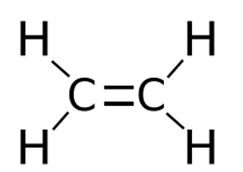
Представляет собой бесцветный горючий газ (строение молекулы показано на рис. 1), который обладает слабым запахом. Плохо растворяется в воде, но хорошо в диэтиловом эфире и углеводородах.
Рис. 1. Строение молекулы этилена.
Таблица 1. Физические свойства этилена.
Молярная масса, г/моль
Плотность, г/см 3
Температура плавления, o С
Температура кипения, o С
Получение этилена
Способы получения этилена можно разделить на промышленные и лабораторные. В первом случае этен – это продуктдегидрирования этана, полученного при крекинге нефти.
В лабораторных условиях этилен можно получить при помощи дегидратации этанола (1), дегалогенированиямоно- и дигалогенпроизводных этана (2, 3) или при неполном гидрировании ацетилена (4):
Химические свойства этилена
Этилен способен присоединять водород (гидрирование) (5), галогены (галогенирование) (6), галогеноводороды (гидрогалогенирование) (7) и воду (гидратация) (8):
В зависимости от условий проведения реакции окисления этилена могут быть получены многоатомные спирты (9), эпоксиды (10) или альдегиды (11):
В результате горения этилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и воды:
Этилен подвергается полимеризации:
Кроме этого, если проводить галогенирование этилена при температуре 400 o С, то разрыва двойной связи происходить не будет, будет замещаться один атом водорода в углеводородном радикале:
Применение этилена
Основное направление использование этилена — промышленный органический синтез таких соединений как галогенопроизводные, спирты (этанол, этиленгликоль), уксусный альдегид, уксусная кислота и др. Кроме этого данное соединение в производстве полимеров.
Примеры решения задач
| Задание | Осуществите ряд превращений: |
этан → этен → этанол → этен → хлорэтан → бутан.
Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной):
Для получения этена из этанола используют реакцию дегидротации:
Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования:
Для получения бутана из хлорэтана используют реакцию Вюрца:
| Задание | Сколько граммов потребуется для бромирования 16,8 г алкена, если известно, что при каталитическом гидрировании такого же количества алкена присоединилось 6,72 л водорода? Каков состав и возможное строение исходного углеводорода? |
| Решение | Запишем в общем виде уравнения бромирования и гидрирования алкена: |
Рассчитаем количество вещества водорода:
n(H2) = 6,72 / 22,4 = 0,3 моль,
следовательно, алкена тоже будет 0,3 моль (уравнение 2), а по условию задачи это 16,8 г. Значит молярная масса его будет равна:
что соответствует формуле C4H8.
Найдем массу брома:
M(Br2) = 2×Ar(Br) = 2×80 = 160 г/моль;
m(MnO2) = 0,3 × 160 = 48 г.
Составим структурные формулы изомеров: бутен-1 (1), бутен-2 (2), 2-метилпропен (3), циклобутан (4).
Источник
Этилен (этен), получение, свойства, химические реакции
Электронное и пространственное строение молекулы
Атомы углерода находятся во втором валентном состоянии (sp 2 —гибридизация). В результате, на плоскости под углом 120° образуются три гибридных облака, которые образуют три σ-связи с углеродом и двумя атомами водорода; p-электрон, который не участвовал в гибридизации, образует в перпендикулярной плоскости π-связь с р-электроном соседнего атома углерода. Так образуется двойная связь между атомами углерода. Молекула имеет плоскостное строение.
Видео
Получение
- Этилен в лаборатории получают при нагревании смеси этилового спирта с концентрированной серной кислотой.
- Углеводороды ряда этилена можно получить также дегидрированием предельных углеводородов.
- На производстве этилен получают из природного газа и при процессах пиролиза нефти.
- Углеводороды ряда этилена можно получить при взаимодействии дигалогенопроизводных предельных углеводородов с металлами.
- При действии спиртовых растворов щелочей на галогенопроизводные отщепляется галогеноводород и образуется углеводород с двойной связью.
Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
Этилен получают как в лабораторных условиях, так и в промышленных масштабах.
В промышленных масштабах этилен получается в результате следующей химической реакции:
- 1. каталитическое дегидрирование этана :
Этилен в лабораторных условиях получается в результате следующих химических реакций:
- 2. дегалогенирования дигалогенпроизводных этана:
- 3. неполное гидрирование ацетилена:
- 4. дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей:
Получение этилена
Способы получения этилена можно разделить на промышленные и лабораторные. В первом случае этен – это продуктдегидрирования этана, полученного при крекинге нефти.
В лабораторных условиях этилен можно получить при помощи дегидратации этанола (1), дегалогенированиямоно- и дигалогенпроизводных этана (2, 3) или при неполном гидрировании ацетилена (4):
Примеры решения задач
Задание Осуществите ряд превращений: этан → этен → этанол → этен → хлорэтан → бутан. Решение Для получения этена из этана необходимо использовать реакцию дегидрирования этана, которая протекает в присутствии катализатора (Ni, Pd, Pt) и при нагревании: С2H6 →C2H4 + H2. Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной): С2H4 + H2O = C2H5OH. Для получения этена из этанола используют реакцию дегидротации: C2H5OH →(t, H2SO4) → C2H4 + H2O. Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования: С2H4 + HCl → C2H5Cl. Для получения бутана из хлорэтана используют реакцию Вюрца: 2C2H5Cl +2Na → C4H10 + 2NaCl.
Задание Сколько граммов потребуется для бромирования 16,8 г алкена, если известно, что при каталитическом гидрировании такого же количества алкена присоединилось 6,72 л водорода? Каков состав и возможное строение исходного углеводорода? Решение Запишем в общем виде уравнения бромирования и гидрирования алкена: CnH2n + Br2 = CnH2nBr2 (1); CnH2n + H2 = CnH2n+2 (2). Рассчитаем количество вещества водорода: n = V / Vm; n(H2) = V(H2) / Vm; n(H2) = 6,72 / 22,4 = 0,3 моль, следовательно, алкена тоже будет 0,3 моль (уравнение 2), а по условию задачи это 16,8 г. Значит молярная масса его будет равна: M = m / n; M(CnH2n) = m(CnH2n) / n(CnH2n); M(CnH2n) = 16,8 / 0,3 = 56 г/моль, что соответствует формуле C4H8. Согласно уравнению (1) n(CnH2n) :n(Br2) = 1:1, т.е. n(Br2) = n(CnH2n) = 0,3 моль. Найдем массу брома: m = n×M; m(Br2) = n(Br2) × M(Br2); M(Br2) = 2×Ar(Br) = 2×80 = 160 г/моль; m(MnO2) = 0,3 × 160 = 48 г. Составим структурные формулы изомеров: бутен-1 (1), бутен-2 (2), 2-метилпропен (3), циклобутан (4). CH2=CH-CH2-CH3 (1); CH3-CH=CH-CH3 (2); CH2=C(CH3)-CH3 (3); C4H8 (4). Ответ Масса брома равна 48 г.
Источник
Практическая работа № 2 Получение этилена и изучение его свойств.
Нечаев Дмитрий Валерьевич, учитель химии
ГУ ЛНР «ЛУВК « ИНТЕЛЛЕКТ»
Практическая работа № 2
Получение этилена и изучение его свойств.
Цель: научиться получать в лаборатории этилен; изучить физические и химические свойства этилена.
Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовая горелка, спички.
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
В пробирку налили 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпали немного прокаленного песка (чтобы предотвратить толчки жидкости при кипении). Закрыли пробирку пробкой с газоотводной трубкой, закрепили ее в штативе и осторожно нагрели содержимое пробирки.
В пробирке начинается выделяться газ — этилен.
В ходе реакции концентрированная серная кислота забирает воду из спирта, врезультате образуется этилен.
Такую реакцию называют – реакция дегидратации.
Изучение свойств этилена.
В другую пробирку налили 2-3 мл бромной воды. Опустили газоотводную трубку первой пробирки до дна пробирки с бромной водой и пропускали через неё выдедяющийся газ.
При пропускании газа через бромную воду, происходит обесцвечивание бромной воды.
В ходе реакции происходит окисление этилена бромной водой по двойной связи.
В третью пробирку налили 2-3 мл разбавленного раствора KMnO 4 , поодкисленного серной кислотой, и пропустили через него газ.
При пропускании газа через подкисленный раствор KMnO4 , происходит обесцвечивание раствора KMnO 4 .
В ходе реакции происходит окисление этилена подкисленным раствором перманганата калия.
Выделяющиеся газ первой пробирки подожгли.
Этилен на воздухе горит ярким светящимся пламенем.
Этилен горит ярким светящимся пламенем, что доказывает наличие кратных связей.
Общий вывод: на данной практической работе мы научились получать в лаборатории этилен реакцией дегидратации спиртов; изучили химические свойства этилена, а именно, действие этилена на бромную воду и подкисленный раствор перманганата калия.
Какой из гомологов этена имеет плотность по воздуху 1,45?
Ответ: D (возд.) = Mr ( алкена)/Mr (воздуха);
Mr ( алкена) = D (возд.)* Mr (воздуха);
Mr ( алкена) = 1,45*29 = 42.
Какой из гомологов пропена имеет плотность по водороду 14?
Ответ: D (Н2) = Mr ( алкена)/Mr (Н 2 );
Mr ( алкена) = 14*2 = 28.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 832 человека из 77 регионов
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
- Курс добавлен 23.09.2021
- Сейчас обучается 47 человек из 23 регионов
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
- Сейчас обучается 22 человека из 11 регионов
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-1175165
Международная дистанционная олимпиада Осень 2021
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
В Минпросвещения предложили организовать телемосты для школьников России и Узбекистана
Время чтения: 1 минута
В Северной Осетии организовали бесплатные онлайн-курсы по подготовке к ЕГЭ
Время чтения: 1 минута
Минпросвещения будет стремиться к унификации школьных учебников в России
Время чтения: 1 минута
Путин попросил привлекать родителей к капремонту школ на всех этапах
Время чтения: 1 минута
Студентам вузов могут разрешить проходить практику у ИП
Время чтения: 1 минута
В Москве запустили онлайн-проект по борьбе со школьным буллингом
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник
Этилен (этен), получение, свойства, химические реакции
Этилен (этен), получение, свойства, химические реакции.
Этилен (этен), C2H4 – органическое вещество класса алкенов. Этилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Этилен (этен), формула, газ, характеристики:
Этилен (этен) – органическое вещество класса алкенов, состоящий из двух атомов углерода и четырех атомов водорода . Этилен имеет двойную углерод -углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Химическая формула этилена C2H4, рациональная формула H2CCH2, структурная формула CH2=CH2. Изомеров не имеет.
Этилен – бесцветный газ, без вкуса, со слабым запахом. Легче воздуха.
Этилен является фитогормоном, т.е. низкомолекулярным органическим веществом, вырабатываемым растениями и имеющим регуляторные функции. Он образуется в тканях самого растения и выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов ), распускание бутонов (процесс цветения), старение и опадание листьев и цветков, участие в реакции растений на биотический и абиотический стресс, коммуникации между разными органами растений и между растениями в популяции.
Пожаро- и взрывоопасен.
Плохо растворяется в воде . Зато хорошо растворяется в диэтиловом эфире и углеводородах.
Этилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Этилен — самое производимое органическое соединение в мире.
Физические свойства этилена (этена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,178 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,26 |
| Температура плавления, °C | -169,2 |
| Температура кипения, °C | -103,7 |
| Температура вспышки, °C | 136,1 |
| Температура самовоспламенения, °C | 475,6 |
| Критическая температура*, °C | 9,6 |
| Критическое давление, МПа | 5,033 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,75 до 36,35 |
| Удельная теплота сгорания, МДж/кг | 46,988 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0163 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0209 |
| Молярная масса, г/моль | 28,05 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства этилена (этена):
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, замещение, окисление, полимеризация молекул.
Химические свойства этилена аналогичны свойствам других представителей ряда алкенов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое гидрирование(восстановление)этилена:
- 2. галогенирование этилена:
Однако при нагревании этилена до температуры 300 o C разрыва двойной углерод-углеродной связи не происходит – реакция галогенирования протекает по механизму радикального замещения:
- 3. гидрогалогенирование этилена:
- 4. гидратация этилена:
Реакция происходит в присутствии минеральных кислот (серной, фосфорной). В результате данной химической реакции образуется этанол.
- 5. окисление этилена:
Этилен легко окисляется. В зависимости от условий проведения реакции окисления этилена могут быть получены различные вещества: многоатомные спирты, эпоксиды или альдегиды.
В результате образуется эпоксид.
В результате образуется ацетальдегид.
- 6. горение этилена:
В результате горения этилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и вода .
- 7. полимеризация этилена:
Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
Этилен получают как в лабораторных условиях, так и в промышленных масштабах.
В промышленных масштабах этилен получается в результате следующей химической реакции:
- 1. каталитическое дегидрирование этана :
Этилен в лабораторных условиях получается в результате следующих химических реакций:
- 2. дегалогенирования дигалогенпроизводных этана:
- 3. неполное гидрирование ацетилена:
- 4. дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей:
Применение и использование этилена (этена):
– как сырье в химической промышленности для органического синтеза различных органических соединений: галогенпроизводных, спиртов (этанола, этиленгликоля), винилацетата, дихлорэтан, винилхлорида, окиси этилена, полиэтилена , стирола, уксусной кислоты, этилбензола, этиленгликоля и пр.,
Примечание: © Фото //www.pexels.com, //pixabay.com

как получить этилен реакция ацетилен этен 1 2 вещество этилен кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этилена
напишите уравнение реакций этилен
Источник