- Посттрансляционная модификация белков
- Фолдинг белков
- Трансляция является хорошей мишенью для лекарств
- 1. Инактивация факторов инициации
- 2. Нарушение кодон-антикодонового взаимодействия
- 3. Блокада стадии элонгации
- Посттрансляционные модификации белков
- Лектор — заведующий кафедрой биохимии, чл.-корр. РАН, профессор, д.б.н. Гусев Николай Борисович
- Программа курса:
- Список рекомендуемой литературы:
- ПОСТТРАНСЛЯЦИО́ННАЯ МОДИФИКА́ЦИЯ БЕЛКО́В
- 36. Виды и механизмы посттрансляционной модификации (процессинга) пробелков:
Посттрансляционная модификация белков
К основным реакциям процессинга относятся:
1. Удаление с N-конца метионина или даже нескольких аминокислот специфичными аминопептидазами.
2. Образование дисульфидных мостиков между остатками цистеина.
3. Частичный протеолиз – удаление части пептидной цепи, как в случае с инсулином или протеолитическими ферментами ЖКТ.
4. Присоединение химической группы к аминокислотным остаткам белковой цепи:
фосфорной кислоты – например, фосфорилирование по аминокислотам Серину, Треонину, Тирозину используется при регуляции активности ферментов или для связывания ионов кальция,
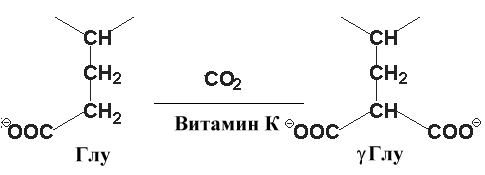
карбоксильной группы – например, при участии витамина К происходит γ-карбоксилирование глутаматав составе протромбина, проконвертина, фактора Стюарта, Кристмаса, что позволяет связывать ионы кальция при инициации свертывания крови,
метильной группы – например, метилирование аргинина и лизина в составе гистонов используется для регуляции активности генома,
гидроксильной группы – например, образование гидроксипролина и гидроксилизина необходимо для созревания молекул коллагена при участии витамина С,
йода – например, в тиреоглобулине присоединение йода необходимо для образования предшественников тиреоидных гормонов йодтиронинов,
5. Включение простетической группы:
углеводных остатков – например, гликирование требуется при синтезе гликопротеинов.
гема – например, при синтезе гемоглобина, миоглобина, цитохромов, каталазы,
витаминных коферментов – биотина, ФАД, пиридоксальфосфата и т.п.
6. Объединение протомеров в единый олигомерный белок, например, гемоглобин, коллаген, лактатдегидрогеназа, креатинкиназа.
Фолдинг белков
Фолдинг – это процесс укладки вытянутой полипептидной цепи в правильную трехмерную пространственную структуру. Для обеспечения фолдинга используется группа вспомогательных белков под названиемшапероны (chaperon, франц. – спутник, нянька). Они предотвращают взаимодействие новосинтезированных белков друг с другом, изолируют гидрофобные участки белков от цитоплазмы и «убирают» их внутрь молекулы, правильно располагают белковые домены.
В целом шапероны способствуют переходу структуры белков от первичного уровня до третичного и четвертичного.
При нарушении функции шаперонов и отсутствии фолдинга в клетке формируются белковые отложения – развивается амилоидоз. Насчитывают около 15 вариантов амилоидоза.
Трансляция является хорошей мишенью для лекарств
Многие вещества обладают способностью связываться с элементами рибосом или другими факторами трансляции. Некоторые из этих веществ используются в качестве лекарственных средств, которые в состоянии действовать на разных уровнях трансляции, например:
1. Инактивация факторов инициации
интерферон активирует внутриклеточные протеинкиназы, которые, в свою очередь, фосфорилируют белковый фактор инициации ИФ-2 и подавляют его активность.
2. Нарушение кодон-антикодонового взаимодействия
стрептомицин присоединяется к малой субъединице и вызывает ошибку считывания первого основания кодона.
3. Блокада стадии элонгации
тетрациклины блокируют А-центр рибосомы и лишают ее способности связываться с аминоацил-тРНК,
левомицетин связывается с 50S-частицей рибосомы и ингибирует пептидил-трансферазу,
эритромицин связывается с 50S-частицей рибосомы и ингибирует транслоказу,
пуромицин по структуре схож с тирозил-тРНК, входит в А-центр рибосомы и участвует в пептидил-трансферазной реакции, образуя связь с имеющимся пептидом. После этого комплекс пуромицин‑-пептид отделяется от рибосомы, что останавливает синтез белка.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Источник
Посттрансляционные модификации белков
Курс посвящен описанию наиболее распространенных способов посттрансляционных модификаций белков и анализу влияния этого процесса на функционирование белков и регуляцию различных процессов, происходящих в клетке.
Лектор — заведующий кафедрой биохимии, чл.-корр. РАН, профессор, д.б.н. Гусев Николай Борисович
Время проведения: весенний семестр, магистры первого года, аспиранты
Продолжительность курса: 12 лекций
Форма отчетности: Экзамен
Альтернативный курс:
Программа курса:
Введение. Что понимается под посттрансляционными модификациями белков? Современные методы идентификации посттрансляционных модификаций. Специальные системы, обеспечивающие записывание («введение»), регистрацию («чтение») и удаление («стирание») модификаций. Посттрансляционные модификации и эпигенетика.
Фосфорилирование и дефосфорилирование белков. Протеинкиназы. Киномы различных организмов. Исследования в области фосфорилированяи белков, удостоенные Нобелевских премий. Схема строения протеинкиназ. Первая классификация протеинкиназ. Определение пространственной структуры протеинкиназ. Современная классификация протеинкиназ, основанная на строении активного центра. Протеинкиназы семейства ACG, структура, свойства и механизмы регуляции. Циклонуклеотид-зависимые протеинкиназы, протеинкиназы семейства С, протеинкиназы, вовлеченные в фосфорилирование рецепторов, функционирующих с участием G-белков. Протеинкиназы семейства CaMK. Общий принцип строении и регуляции активности. Са-кальмодулин зависимые протеинкиназы, киназа легких цепей миозина, киназа фосфорилазы. Структура и свойства АМР-зависимой протеинкиназы, одного из основных регуляторов метаболизма. Протеинкиназы семейства CMG. Строение циклин-зависимых протеинкиназ. Киназа гликогенсинтазы 3, МАР-киназы. Каскадный механизм регуляции активности протеинкиназ. Участие МАР–киназ в передаче гормонального сигнала. Докинг в регуляции активности протеинкиназ. Казеин-киназы второго типа, строение, механизм регуляции, участие в различных физиологических процессах. Современные методы регистрации внутриклеточной активности протеинкиназ. Тирозиновые протеикиназы. Растворимые тирозиновые киназы, сходство в строении src-киназы и сАМР-зависимой протеинкиназы. Рецепторные тирозиновые протеинкиназы, строение, возможные пути регуляции и участие в передаче гормонального сигнала.
Протеинфосфатазы, современные представления о классификации этой группы ферментов. Основные механизмы регуляции протеинфосфатаз. Классификация Ser/Thr протеинфосфатаз. Протеинфосфатазы РРР1, механизмы регуляции, участие в регуляции цитоскелета. Протеинфосфатазы семейства РРР2 (РРР2, 4, 6), олигомерная структура, субстратная специфичность, механизмы регуляции активности. Са-кальмодулин зависимые протеинфосфатазы (РРР3). Протеинфосфатазы РРР5, их связь с белками теплового шока. Необычные протеинфосфатазы РРР7 и их гомологи у растений. Фосфатазы, дефосфорилирующие остатки тирозина. Фосфатазы смешанного типа. PTEN, как пример фосфатазы смешанного типа, участвующая в регуляции многочисленных внутриклеточных процессов.
Метилирование белков. История открытия метилирования, остатки, подвергающиеся метилированию. Ферменты, обеспечивающие метилирование и деметилирование, метаболические процессы, участвующие в регуляции процессов метилирования/деметилирования. Аргининтрансметилазы, строение и механизмы регуляции. Лизинметилтрансферазы строение и механизм функционирования, консенсусные последовательности, узнаваемые этими ферментами. Субстраты метилтрансфераз. Деметилазы аргинина. Соотношение и взаимное влияние различных типов посттрансляционных модификаций. Эпигенетический подход к лечению онкологических заболеваний.
Различные способы модификации N-концевых остаток белков. N-ацетилтрансферазы. Пропионилирование, миристоилирвание, пальмитоилирование N-концевых остатков аминокислот. Метилирование N-концевых остатков. Субстратная специфичность и взаимодействие ферментов, участвующих в модификации N-концевых аминокислот.
Убиквитинилирование и сумоилирование белков. Время жизни белков и так называемое правило N-конца. Понятие дегрона. Два способа создания дегронов (аргинилирование и ацетилирование). Механизмы убиквитинилирования белков, три фермента участвующих в процессе убиквитинилирования. Белки, узнающие дегроны и осуществляющие убиквитинилирование. Состав, строение и свойства протеасом. Жизненный цикл и схема функционирования протеасом. Линейное убиквитинилирование, ферменты, участвующие в этом процессе. Заболевания, связанные с нарушением системы убиквитинилирования. Сумоилирование, сходство процессов убиквитинилирования и сумоилирования. Функциональная роль сумоилирования. Сумоилирование и стресс.
Ацетилирование остатков лизина, процессы, регулируемые этой посттрансляционной модификацией. Участие кофермента А в процессах ацетилирования. Глутатионилирование и СоА-модификация белков. Гомоцистеинилирование белков. Гликозилирование белков, N- и О-гликозилирование. АДР-рибозилирование, ферменты, участвующие в этом процессе. Остатки, подвергающиеся АДР-рибозилированию, изменения в структуре белка, происходящие при АДР-рибозилировании.
Список рекомендуемой литературы:
- 1. Y.T. Kwon and A. Ciechanover The Ubiquitin Code in the Ubiquitin-Proteasome System and Autophagy. TIBS 2017 doi 10.1016/j.tibs.2017.09.002
- 2. Zhi-Jian Han, Yan-Hu Feng, Bao-Hong Gu, Yu-Min Li and Hao Chen
- 3. The post-translational modification, SUMOylation, and cancer (Review) Inter. J. Oncol. 52: 1081-1094, 2018
- 4. M.S. Cohen & P. Chang, Insights into the biogenesis, function, and regulation of ADP-ribosylation. Nature Chem Biol,14 , 236-243
- 5. S.S. Pinho and C. A. Reis, Glycosylation in cancer: mechanisms and clinical implications. Nature Reviews Cancer doi:10.1038/nrc3982
- 6. M.J. Wagner, M. M. Stacey, B. A. Liu, T Pawson, Molecular Mechanisms of SH2- and PTBDomain-Containing Proteins in ReceptorTyrosine Kinase Signaling, Cold Spring Harbor Perspect Biol 2013; 5: a008987
- 7. J. Murn, Y. Shi, The winding path of protein methylation research: milestones and new frontiers. Nature Rev, Mol. Cell Biol. 2017
- 8. S. Varland, C. Osberg, T. Arnesen, N-terminal modifications of cellular proteins:
- 9. The enzymes involved, their substrate specificities and biological effects, Proteomics 2015, 15, 2385–2401
- 10. F. Sambataro and M. Pennuto, Post-translational Modifications and Protein Quality Control in Motor Neuron and Polyglutamine Diseases. Front. Mol. Neurosci. 10: 82. doi: 10.3389/fnmol.2017.00082

Страница последний раз обновлялась 17.04.2018
Источник
ПОСТТРАНСЛЯЦИО́ННАЯ МОДИФИКА́ЦИЯ БЕЛКО́В
В книжной версии
Том 27. Москва, 2015, стр. 270-271
Скопировать библиографическую ссылку:
ПОСТТРАНСЛЯЦИО́ ННАЯ МОДИФИК А́ ЦИЯ БЕЛКО́В, катализируемые специфич. ферментами превращения структуры белков, завершающие формирование их молекулы или участвующие в регуляции функций этой молекулы. Разнообразные реакции первого типа часто называют процессингом (созреванием) белка. П. м. б. может происходить до завершения трансляции , когда полипептидная цепь ещё связана с рибосомой ( котрансляционная модификация ), при транспорте полипептидной цепи через мембрану или уже после образования пространственной структуры белка. П. м. б., свойственная многим, хотя и не всем, белкам, делает синтез белка зависимым не только от его структурного гена, но и от действия др. генов, кодирующих ферменты, участвующие в этом процессе. В отличие от трансляции, П. м. б. относится к нематричным процессам и контролируется менее строго, что может служить причиной образования множественных форм белков. Известно ок. 400 типов реакций П. м. б., каждый из которых затрагивает ограниченный круг белков. Нередко им свойственна тканевая, органная и возрастная специфичность.
Источник
36. Виды и механизмы посттрансляционной модификации (процессинга) пробелков:
. химическая модификация (виды, примеры);
Многие белки синтезируются в неактивном виде (в виде предшественников) и после схождения с рибосом подвергаются постсинтетической модификации. Виды модификации белков:
частичный (ограниченный) протеолиз (удаление N-концевого метионина и сигнального пептида, образование активных форм ферментов и гормонов, смотри ниже в вопросе 3.2)
ацетилирование: в большинстве случаев инициирующий метионин удаляется путем гидролиза, и к новой N – концевой аминокислоте добавляется ацетильная группа. Ацетил-КoA – донор ацетильной группы для этих реакций. Ацетилированию подвергаются гистоновые белки.
метилирование происходит по остаткам лизина в некоторых белках типа калмодулина и цитохрома c. S-аденозилметионин — донор активной метильной группы
фосфорилирование — одна из наиболее популярных модификаций белков, которые происходят в животных клетках. Реакции фосфорилирования белков составляют часть механизмов регуляции биологической активности белка и являются обратимыми. Реакции фосфорилирования (АТФ + белок фосфопротеин +АДФ) катализируются протеинкиназами, а реакции отщепления остатков фосфата (фосфопротеин протеин + фосфат) протеинфосфатазами. Примером такого рода реакций могут быть реакции фосфорилирования гликоген синтазы и гликоген фосфорилазы в гепатоцитах в ответ на действие глюкагона – гормона поджелудочной железы. Фосфорилирование синтазы ингибирует ее активность, в то время как активность фосфорилазы повышается. Эти два синхронные события ведут к повышению поступления печеночной глюкозы в кровь. Наоборот, дефосфорилирование вызывает обратное соотношение активностей и клетки печени активно синтезируют гликоген.
остатки тирозина в некоторых белках могут сульфатироваться. Примерами таких белков могут быть фибриноген или гастрин. Донором сульфата для белков, как и при сульфатировании других молекул является 3 ‘-фосфоаденозил-5 ‘—фосфосульфат (ФАФС). Присоединение сульфата к остаткам тирозина необходимо для проявления функции белков и является необратимым процессом в отличие от фосфорилирования тирозина, используемого в регуляторных механизмах клетки.
Пренилирование — присоединение 15 углеродной фарнезильной или 20 углеродной геранилгеранильной групп к акцепторным белкам. Фарнезил и геранилгеранил — изопреноиды, получаемые на пути синтеза холестерина. Изопреноидные группы присоединяются к остаткам цистеина на С конце белков тиоэфирной связью (C-S-C). Последовательность на C — конце белков, подвергающихся пренилированию: CAAX, где C – цистеин, А – любая алифатическая аминокислота (кроме аланина) и X — C-концевая аминокислота. Для проведения реакции присоединения пренильных групп, три С- концевые аминокислоты молекулы предшественника (AAX) удаляются, а цистеин активируется метилированием при участии S-аденозилметионина как донора метильной группы. Примерами пренлированных белков могут служить белки, связывающие и гидролизуюшие ГТФ. Многочисленные G-белки участвующие в передаче сигналов имеют гамма субъединицу, модифицированную геранил-геранилом.
Модификации белков, которые зависят от витамина C как кофактора, включают гидроксилирование пролина и лизина. Гидроксилирующие ферменты — пролилгидроксилазы и лизилгидроксилазы. (см. тему «Белки-2» вопрос 1.1.)
Витамин К – кофактор в карбоксилировании остатков ГЛУ. Результатом этой реакции является -карбоксиглутаминовая кислота.
Это соединение важно для функции ряда белков, участвующих в свертывании крови. Образование глутамата позволяет белкам формировать комплексы с ионами кальция и таким образом способствовать изменению конформации и биологической активности белков. Антикоагулянты производные кумарина, варфарин и дикумарин, ингибируют реакцию
Большинство белков подвергается действию протеаз. Самая простая форма такого протеолиза — удаление инициирующего метионина. Многие белки синтезируются в форме неактивных предшественников, активирование которых происходит порой далеко от места их синтеза при помощи так называемого ограниченного протеолиза. Примерами могут служить секретируемые ферменты поджелудочной железы или ферменты системы свертывания крови. Неактивные предшественники таких белков, активируемых удалением дополнительных пептидов, названы пропротеинами. Термин препротеины используется для обозначения белков, содержащих сигнальные последовательности, которые также удаляются специфическими протеазами. Многие секретируемые белки (пропротеины) также имеют сигнальные последовательности. Для обозначения таких белков используют термин препропротеины. Посттрансляционный протеолиз в в ряде случаев может принимать сложный характер. Например, препроопиомеланотропин, синтезируемый гипофизом, или препроинсулин.
Через какое-то время после начала трансляции N-концевая часть растущего полипептида оказывается вне рибосомы и затем по мере роста полипептида все большая часть его свешивается с рибосомы в окружающую среду. В ней полипептидная цепь не может оставаться в виде развернутой цепи: ее гидрофобные боковые группы взаимодействуют друг с другом, а гидрофильные — с окружающей водой и ионами. Это создает условия для сворачивания, компактизации и самоорганизации внерибосомной части растущего полипептида в пространственную (вторичную и третичную) структуру.
Такое постепенное полярное сворачивание растущей полипептидной цепи на рибосоме обозначается как котрансляционное формирование структуры белка. В других случаях белок, синтезируемый рибосомой и используемый в других компартментах клетки необходимо перенести через мембрану либо вне клетки, либо в одну из внутриклеточных органелл. Транспорт такого белка через мембрану требует несвернутого состояния его полипептидной цепи. В этом случае могут быть использованы две альтернативные возможности:
1) рибосомы, синтезирующие белок, предназначенный для транспорта через мембрану, сами сидят на мембране (мембраносвязанные рибосомы), и растущий полипептид в развернутом виде поступает из них непосредственно в мембрану;
2) свободные (не прикрепленные к мембране) рибосомы цитоплазмы синтезируют полипептидную цепь, которая по мере выхода из рибосомы взаимодействует со специальными белками — молекулярными шаперонами. Шапероны препятствуют полному сворачиванию белка в компактную структуру и поддерживают его недосвернутое состояние в растворе. После освобождения из рибосомы эти недосвернутые белки взаимодействуют с мембраной и транспортируются через нее.
Регуляция биосинтеза белка у прокариот. Особенности регуляции биосинтеза белка у эукариот:
альтернативный сплайсинг иРНК.
модификация гистоновых и негистоновых белков.
Регуляция биосинтеза белка у прокариот.
Значительная часть белков одинакова для всех типов клеток. Они обеспечивают основные функции клеток (ферменты гликолиза, цикла Кребса, структурные белки). Скорость их образования и содержание в клетке обычно меняется незначительно. Такие белки получили название конститутивных белков. Существуют белки, потребность в которых возникает только в специальных условиях. Такие белки обычно синтезируются с очень низкой скоростью, но синтез их может быть значительно ускорен. Например, при голодании или усиленных физических упражнениях клетки печени начинают активно превращать аминокислоты в глюкозу. Это становится возможным благодаря усилению синтеза ферментов, катализирующих образование глюкозы из аминокислот. Такие белки получили название индуцируемых белков. Индукция – свойство клеток синтезировать определенные ферменты только при наличии соответствующих субстратов.
Молекулярный механизм индукции ферментов был разработан Жакобом и Моно и известен как гипотеза оперона. У прокариот регуляция инициации транскрипции – основное место действия регуляторов.
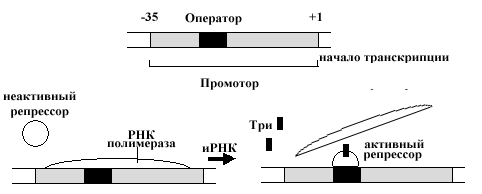
Оперон — участок ДНК, кодирующий строение белков, содержит регуляторную зону, контролирующую синтез этих белков. Структурные гены располагаются на молекуле ДНК рядом с последовательностями нуклеотидов, называемых промотором и оператором. Для регуляции транскрипции необходим еще один участок ДНК — регуляторный ген, не всегда располагающийся вблизи вышеописанной группы. Во время транскрипции РНК-полимераза связывается с промотором и продвигается вдоль ДНК, образуя транскрипт генов оперона. Белки-репрессоры — продукты трансляции регуляторных генов, связываются с соответствующими операторными участками и блокируют продвижение РНК-полимеразы, и, следовательно, препятствуют транскрипции.
В самом простом варианте этот механизм можно рассмотреть на примере триптофанового оперона кишечной палочки. Оператор триптофанового оперона представляет собой последовательность нуклеотидов, которую узнает репрессор этого оперона. Присоединение репрессора блокирует присоединение РНК-полимеразы к промотору, предотвращая экспрессию триптофанового оперона. Присоединение репрессора к оператору становится возможным лишь в том случае, если к репрессору присоединятся 2 молекулы триптофана. Результатом данного взаимодействия оператора и репрессора является остановка синтеза. Такое влияние продукта гена регулятора получило название негативного контроля, гены, кодирующие такие регуляторы, названы генами репрессоров, а молекулы, способствующие такой реакции репрессора, получили название корепрессоры (в нашем случае это молекулы триптофана). Роль корепрессоров в клетке часто выполняют конечные продукты метаболических путей.
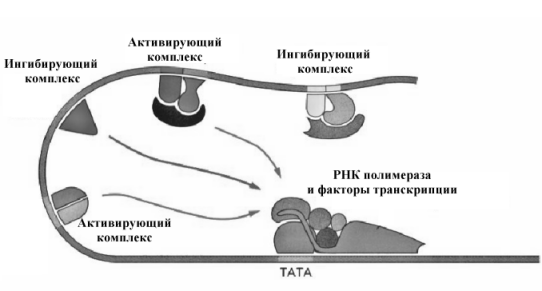
Особенности регуляции биосинтеза белка у эукариот. Избирательная транскрипция.
У эукариот, регуляция экспрессии генов происходит на разных участках механизма синтеза белков, начиная от синтеза иРНК и до формирования пространственной структуры белков. Можно выделить несколько уровней такой регуляции:
1 Регуляция механизмов траскрипции;
2. Регуляция процессинга иРНК;
3. Регуляция транспорта РНК из ядра в цитозоль;
5.Регуляция стабильности (продолжительности жизни) иРНК;
Основным объектом регулирующего влияния на синтез белка и нуклеиновых кислот является транскрипция, она регулируется специальными регуляторными белками, которые присоединяются к специфическим последовательностям, как правило, расположенным на больших расстояниях от промотора. Влияние на процесс формирования комплекса инициирующих белков может быть ускоряющим (энхансеры) или замедляющим (сайленсеры).
Важным элементом в механизмах регуляции экспрессии генов на уровне транскрипции является доступность участков ДНК к действию регуляторов транскрипции.
Многие гены, используемые для синтеза белков, собраны в молекулах ДНК в форме кластеров и доступность к такому кластеру может быть в свою очередь регулируема. Предполагается несколько механизмов, позволяющих вызвать изменения хроматина. Включение или выключение отдельных кластеров генов в определенные сроки жизни клетки или организма обеспечивают процессы дифференцировки клеток, адаптации к определенным условиям жизни.
Альтернативный сплайсинг иРНК.
См. тему «Белки-4», вопрос №11
Модификация гистоновых и негистоновых белков.
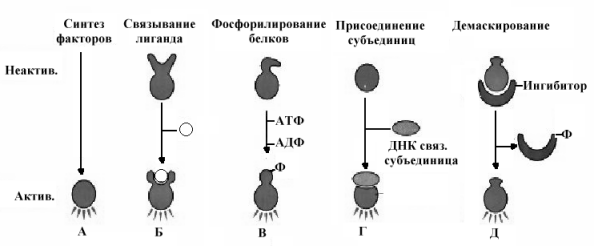
В ядре отрицательно заряженная ДНК находится в комплексе с положительно заряженными белками гистонами. Чтобы начались матричные синтезы, нужно «снять» гистоны с ДНК. Это достигается путем ведения отрицательно заряженных структур (под действием гормонального сигнала посредством ферментов аденилатциклазы (превращает АТФ в цАМФ) и протеинкиназ (катализирует процесс протеин—фосфопротеин) происходит фосфорилирование негистоновых белков, которые при этом приобретают отрицательный заряд и притягивают к себе положительно заряженные гистоны. В результате чего ДНК обретает способность к транскрипции и дальнейшей трансляции.
Источник