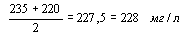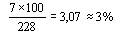Возможные причины погрешностей которые могут быть при данном способе приготовления растворов
Анализ воды сводится, в большинстве случаев, к измерению, т.е. установлению, концентрации какого-либо компонента в воде. При измерении концентрации химического соединения в воде даже самыми точными методами всегда остается некоторое сомнение относительно точности и достоверности результата, т.к. измерение – сложная процедура, состоящая из более простых операций, каждая из которых выполняется определенными средствами. В частности, для получения результата анализа иногда необходимо выполнить несколько измерений объемов растворов, навески реактива, интенсивности окраски раствора и т.д. Поэтому под термином «результат измерения» мы в дальнейшем будем подразумевать результат определения содержания компонента, или результат всей процедуры анализа*. В то же время мы будем иметь в виду, что характер измерения может иметь (и часто имеет) каждая выполняемая при анализе воды операция, при этом выполняющий операции и анализ субъект будет для нас оператором.
Таким образом, результату присуща неопределенность, степень (или значение) которой, тем не менее, могут быть оценены и по величине, и по знаку. Выполняя измерение тем или иным методом, оператор должен иметь, по меньшей мере, представление о неопределенности, которой сопровождается ожидаемый результат. Неопределенность результата сводится к минимуму при соблюдении принципов и правил единства и точности измерений.
В аналитической практике говорят о погрешностях при измерениях, понимая под этим все возможные неточности, которые могут повлиять на правильность результатов. Погрешность измерения можно определить как разность между отдельным результатом и истинным значением измеряемой величины**. Погрешности (иногда их же называют ошибками, что не совсем правильно) подразделяют на грубые, систематические и случайные.
Грубые, систематические и случайные погрешности. Грубые погрешности (их называют также промахами) обычно возникают из-за ошибок оператора или неправильной работы оборудования – ошибочной перестановки цифр при записи данных, ошибки считывания показаний весов или пипетки, ошибочного использования неисправного или негодного оборудования (например, пробирки со стертой меткой) и др. Грубые погрешности не всегда бывают очевидными; они могут даже воспроизводиться при повторных определениях, т.к. оператор, имея характерный индивидуальный стиль работы, может повторить ошибку. Любое значительное расхождение результатов нескольких измерений дает основание подозревать грубые погрешности, проверить действия выполняющего анализ или правильность работы оборудования. Лучший способ убедиться в отсутствии грубых погрешностей – повторить определение другим оператором. Грубые погрешности при оценке величины суммарной погрешности результата измерения не учитываются, т.к. соответствующие результаты измерений отбрасывают (отбраковывают).
Если грубые погрешности делают измерение недостоверным, то систематические и случайные погрешности снижают достоверность измерения.
Систематические погрешности могут быть частично, в большей или меньшей степени, компенсированы путем введения поправок в результаты измерений. Например, деление 9,0 мл при калибровке бюретки соответствует фактическому объему 9,1 мл, и это может быть учтено введением соответствующей поправки (+0,1 мл). Систематические погрешности могут суммироваться, причем суммированию подлежит выражение частных систематических погрешностей (отклонений), взятых с одним и тем же знаком.
Случайные погрешности имеют более сложное происхождение и могут иметь в каждом определении различные значения по величине и по знаку, т.е. по характеру отклонения от «истинного» значения. Они возникают обычно вследствие непредсказуемых явлений, которые могут и не воспроизводиться при повторных измерениях. Случайные погрешности нельзя компенсировать посредством введения поправок, но их можно уменьшить путем увеличения числа определений. Примером случайных погрешностей могут быть погрешности при считывании показаний с пипетки или прибора оператором, неодинаковое загрязнение пробы при отборе, неправильный учет внешних влияющих условий (в первую очередь температуры) и др. Случайные погрешности имеют место при работе любого оператора, однако они могут достигать значительных величин при неаккуратной работе – использовании не совсем чистой посуды, недостаточно полном количественном переносе пробы в другой сосуд и т.п. Случайные погрешности (обозначаются буквой греческого алфавита ε – эпсилон) рассчитываются методами математической статистики и являются функцией от числа определений, вида распределения результатов определений, доверительной вероятности и др.
Абсолютные и относительные погрешности. Отклонение полученного результата от истинного можно выразить в абсолютных и относительных единицах. Соответственно различают абсолютную и относительную погрешность.
Абсолютной называется погрешность, измеряемая в единицах определяемой величины и рассчитываемая как разность между истинным значением и полученным в данном определении.
Относительной называется погрешность, измеряемая в относительных единицах (в %) и рассчитываемая как отношение абсолютной погрешности к истинному содержанию компонента. При этом в качестве истинного значения можно принимать усредненный результат нескольких определений. Например, в трех последовательных определениях содержания хлорид-аниона в воде артезианской скважины получены результаты: 235 мг/л, 410 мг/л и 220 мг/л . Второй результат в расчетах не учитываем, т.к. он может быть вызван грубой ошибкой. Рассчитывая по двум оставшимся результатам среднее арифметическое концентрации хлорид-аниона, считаем его результатом анализа:
Абсолютная погрешность первого из результатов равна 235 – 228 = 7 мг/л.
Относительная погрешность для первого результата равна:
Следует отметить, что при количественной оценке погрешностей специалисты пользуются различными их характеристиками, описываемыми методами математической статистики. Такие характеристики необходимы для оценки значений случайных и систематических составляющих погрешности, которые, в свою очередь, применяются при контроле сходимости и воспроизводимости результатов измерений (см., например, ГОСТ Р 51232-98). Вместе с тем, при использовании полевых методов анализа обычно проводится внутренний (т.е. выполняемый самим оператором) контроль точности результатов, правила которого описаны в разделе 3.3.
* В аналитической практике часто используют термин «наблюдение», понимая под ним единичное определение, а результатом анализа, или результатом измерения, считают среднее арифметическое нескольких (не менее двух) определений, выполненных в одних и тех же условиях. Аналогичный подход рекомендуется в действующей нормативной документации и в настоящем руководстве (см. далее раздел «Факторы, определяющие точность анализа»).
** Термин «истинное значение» отражает идеализированное понятие, т.к. концентрация химического вещества в растворе принципиально имеет реальное конечное значение, однако измеряться это значение может конкретными методами, каждый из которых имеет свои погрешности.
Источник
Лабораторный практикум по химии (стр. 15 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 |
Наиболее распространены пять способов выражения концентрации растворов:
1. массовая доля растворенного вещества – масса растворенного веществ, содержащаяся в 100 г раствора;
2. молярная концентрация – количество вещества в одном литре раствора;
3. молярная концентрация эквивалента (эквивалентная концентрация) – количество эквивалентов вещества в одном литре раствора;
4. моляльность – количество вещества в одном килограмме растворителя;
5. титр – масса растворенного вещества в одном мл 
При переходе от массовой доли и моляльности к остальным способам выражения концентрации необходимо знать плотность раствора, которая определяется опытным путем с помощью ареометра.
Ареометр – это прибор для измерения плотности жидкостей. Он представляет собой запаянную стеклянную трубку с грузом на конце и со шкалой. Шкала градуирована в единицах плотности 
Когда ареометр погружен в жидкость, то уровень её поверхности совпадает с тем делением на шкале, которое указывает плотность этой жидкости. Зная плотность раствора, можно в справочной литературе найти массовую долю растворенного вещества. Например, для раствора гидроксида натрия имеются такие данные:
Наиболее точным и простым методом определения концентрации растворов является титрование. Это метод количественного химического анализа, основанный на измерении объема раствора с известной концентрацией, затраченного на реакцию с раствором вещества неизвестной концентрации, которую нужно измерить. В зависимости от типа реакции, протекающей при титровании, различают кислотно-основное титрование, окислительно-восстановительное и т. д.
Для определения концентрации щелочей применяется кислотно-основное титрование раствором кислоты. При этом протекает реакция нейтрализации
к которой можно применить закон эквивалентов:

Если концентрация раствора является эквивалентной концентрацией 


и выражение закона эквивалентов принимает вид:
Таким образом, для определения эквивалентной концентрации щелочи необходимо знать концентрацию кислоты и объёмы растворов кислоты и щелочи, вступивших в реакцию.
Целью работы является: 1) определение с помощью ареометра плотности раствора гидроксида натрия и массовой доли растворенного вещества, 2) приготовление раствора гидроксида натрия заданной концентрации, 3) определение методом титрования концентрации приготовленного раствора.
Опыт 1. Определение плотности раствора ареометром
Получить у лаборанта раствор гидроксида натрия и налить его в стеклянный мерный цилиндр емкостью 250 мл. В раствор осторожно опустить ареометр. Записать показания ареометра (во время снятия показаний ареометр не должен касаться стенок цилиндра). По таблице плотности (см. введение) определить массовую долю растворенного вещества в исследуемом растворе. Если показания ареометра не совпадают с табличными данными, то массовую долю определить методом интерполяции.
Метод интерполяции заключается в определении промежуточного, между табличными, значения искомой величины.
Предположим, что при помощи ареометра определена плотность раствора гидроксида натрия 
1. По таблице плотностей находят меньшее и большее значения массовой доли 
меньшее значение 
большее значение 
2. Находят разность между табличными значениями плотностей и концентраций:
3. Находят разность между значением плотности, определенной ареометром, и меньшим табличным значением:
4. Составляют пропорцию и решают её:
5. Найденное число прибавляют к меньшему табличному значению плотностью 
Опыт 2. Приготовление раствора заданной концентрации
Ход опыта. 1. Получить от преподавателя задание на приготовление раствора методом разбавления того раствора, массовая доля которого была определена при помощи ареометра в первом опыте. Обычно дается задание приготовить раствор гидроксида натрия объемом 250 мл с эквивалентной концентрацией 0,08 н., 0,09 н., 0,1 н., 0,11 н. и т. д. Раствор готовят в мерных колбах, разбавляя раствор первого опыта водой.
2. Вычислить объем раствора щелочи, массовая доля которого была определена при помощи ареометра, необходимый для приготовления заданного раствора объемом 250 мл.
3. Мерным цилиндром отмерить необходимый объем раствора щелочи. Вылить раствор в мерную колбу. Дважды ополоснуть цилиндр дистиллированной водой, слить воду в ту же колбу.
4. Содержимое колбы разбавить до метки водой. Разбавление вначале можно вести быстро, но в конце добавлять воду следует по каплям из капельницы. Разбавление можно считать законченным, когда нижний уровень мениска жидкости коснется метки на колбе.
5. Закрыть колбу пробкой и перемешать раствор, многократно переворачивая колбу. Приготовленный раствор использовать в следующем опыте.
Опыт 3. Титрование раствора
Ход опыта. 1. В мерную бюретку, закрепленную в штативе, налить раствор кислоты с эквивалентной концентрацией 0,1 моль/л (0,1 н.). Этот раствор называется рабочим раствором.
2. В три конические колбы внести с помощью мерной пипетки по 10 мл раствора гидроксида натрия, приготовленного в предыдущем опыте, добавить в каждую колбу по одной капле индикатора метилоранжа или фенолфталеина.
3. Из бюретки медленно, по каплям, прибавлять раствор кислоты к раствору щелочи до изменения окраски индикатора. По окончании титрования записать объем кислоты, использованной на титрование.
4. Опыт повторить еще два раза, каждый раз предварительно доливая раствор кислоты в бюретку до нулевого деления.
5. Рассчитать средний объем кислоты, использованный на титрование, и эквивалентную концентрацию щелочи. Вычислить титр раствора.
6. Сопоставить концентрацию приготовленного раствора, найденного методом титрования, с заданным значением. Рассчитать погрешность, допущенную при приготовлении раствора, в выводе указать возможные причины погрешности опыта.
Контрольные вопросы и задания
1. Приведите формулы для вычисления всех способов выражения концентрации растворов: массовой доли, молярной, эквивалентной, моляльности, титра и мольной доли растворенного вещества.
2. Выведите формулы перехода от молярной концентрации к массовой доле растворенного вещества, моляльности и титру раствора.
3. Рассчитайте объем раствора гидроксида натрия с плотностью 
4. Для нейтрализации 10 мл раствора гидроксида бария израсходовано 7 мл 0,1 н. азотной кислоты. Определите молярную концентрацию гидроксида бария.
5. Выведите математическое выражение закона химических эквивалентов применительно к растворам.
6. Выведите математическое выражение для расчета массы растворенного вещества в любом объеме раствора при известной молярной концентрации раствора.
Лабораторная работа № 11. ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ РАСТВОРЕНИЯ
Физико-химические процессы (растворение, плавление, гидратация и др.) сопровождаются, как и химические реакции, поглощением или выделением тепла. При растворении солей в воде происходят два процесса: эндотермический, связанный с разрушением кристаллической решетки, и экзотермический, обусловленный взаимодействием растворенного вещества и воды с образованием гидратов. В зависимости от того, какой из этих процессов преобладает, тепловой эффект растворения может быть или положительным (эндотермическое растворение), или отрицательным (экзотермическое растворение).
Количество теплоты, поглощающейся (выделяющейся) при растворении одного моля вещества, называется теплотой растворения данного вещества.
Источник