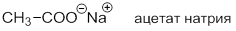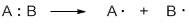- Типы связей в молекулах органических веществ
- Типы связей в молекулах органических веществ
- Добавить комментарий Отменить ответ
- Гибридизация электронных орбиталей и геометрия молекул
- Типы связей по способу перекрывания орбиталей
- Как узнать, когда в молекуле есть π- и ϭ-связи?
- Видео
- Отличительные черты строения алкенов
- Образование ароматических веществ
- Способы определения
- Примеры решения задач
- Виды связи по способу перекрывания электронных орбиталей
- Химические связи в молекулах органических соединений
Типы связей в молекулах органических веществ
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
| σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. |
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
 |  |
 |  |
 |  |
| π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
| Одинарная связь С–С, С–Н, С–О | Двойная связь С=С, С=О | Тройная связь С≡С, С≡N |
| σ-связь | σ-связь + π-связь | σ-связь + две π-связи |
Таким образом, число сигма-связей ( σ-связей) в молекуле метана равно четырем:
В молекуле этилена число сигма-связей равно пяти, а также есть одна пи-связь (между атомами углерода):
В молекуле ацетилена всего три сигма-связи и две пи-связи:
H–C≡C–H
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Источник
Гибридизация электронных орбиталей и геометрия молекул
Типы связей по способу перекрывания орбиталей
Как известно, орбитали могут иметь различную форму, так, например, s-орбитали имеют сферическую, а p-гантелеобразную форму. По этой причине связи также могут отличаться по способу перекрывания электронных орбиталей:
• ϭ-связи – образуются при перекрывании орбиталей таким образом, что область их перекрывания пересекается линией, соединяющей ядра. Примеры ϭ-связей:
• π-связи – образуются при перекрывании орбиталей, в двух областях – над и под линией соединяющей ядра атомов. Примеры π-связей:
Как узнать, когда в молекуле есть π- и ϭ-связи?
При ковалентном типе связи ϭ-связь между любыми двумя атомами есть всегда, а π-связь имеет только в случае кратных (двойных, тройных) связей. При этом:
- Одинарная связь – всегда является ϭ-связью
- Двойная связь всегда состоит из одной ϭ- и одной π-связи
- Тройная связь всегда образована одной ϭ- и двумя π-связями.
Укажем данные типы связей в молекуле бутин-3-овой кислоты:
Видео
Отличительные черты строения алкенов
Гомологический ряд этилена, имеющий общую формулу СnН2n, характеризуется sp гибридизацией атома углерода. Алкены имеют треугольное строение, валентный угол составляет 120 °.
Атом углерода, у которого после нагревания, из-за перехода электрона с 2s на 2p энергетический подуровень, в процессе образования связи принимают участие 1s и 2p электроны. Они становятся гибридными, образуя в пространстве треугольник. Вершины полученных гибридных облаков перекрываются с негибридными атомами водорода, образуя одинарную связь. Sp2-гибридизация характерна для представителей всего ряда этилена.
Гомологический ряд алкенов начинается с этилена (этена), имеющего два атома углерода. У каждого из них остается по одному негибридному атому углерода, которые перекрываются друг с другом. Отличительной чертой этого класса органических соединений является наличие не только простых «сигма» связей, но и присутствие двойной «пи» связи.
Именно она объясняет специфические свойства представителей этого гомологического ряда. В отличие от насыщенных углеводородов ряда метана, этилен и его гомологи вступают в реакции электрофильного присоединения. В частности, выделяют следующие качественные реакции на двойную связь:
- обесцвечивание йодной (бромной) воды;
- изменение окраски перманганата калия (марганцовки).
Среди примеров неорганических веществ, имеющих этот тип гибридизации, приведем: хлорид алюминия (AlCl3), фторид бора (BF 3).
Образование ароматических веществ
Представители этого класса имеют общую формулу СnН2n-6. Их особенностью является наличие в молекуле единого электронного облака, образуемого 6 негибридными облаками. Бензол считается родоначальником гомологического ряда ароматических углеводородов. Замкнутая формула молекул представителей этого класса объясняется наличием sp2 гибридизации каждого из шести углеродных атомов.
Три гибридных облака используются для образования простой «сигма» связи с соседними атомами, а также с одним облаком водорода. Оставшийся негидридный p -электрон участвует в формировании единой системы (бензольного кольца). Особенности строения объясняют химическую инертность бензола. Этот арен способен вступать в реакции замещения только при жестких условиях.
Способы определения
Поговорим подробнее о том, как определить тип гибридизации. В химическом понимании данный термин предполагает изменение энергии и формы орбиталей. Наблюдается подобный процесс в тех случаях, когда для образования связи используют электроны, которые принадлежат различным типам.
Чтобы понять, как определить тип гибридизации, рассмотрим молекулу метана. Данное вещество является первым представителем гомологического ряда насыщенных (предельных) углеводородов. В пространстве молекула СН4 является тетраэдром. Единственный атом углерода образует с водородами связи, сходные по энергии и длине. Для того чтобы образовались такие гибридные облака, используются три р- и один эс-электрон.
Четыре облака смешиваются, и возникает четыре одинаковых (гибридных) вида, имеющих форму неправильной восьмерки. Называют такой тип гибридизации sp3. Все углеводороды, в составе которых только простые (одинарные) связи, характеризуются именно таким типом гибридизации атома углерода. Валентный угол составляет 109 градусов 28 минут.
Продолжим разговор о том, как определить тип гибридизации. Примеры ненасыщенных углеводородов ряда этилена дают представление о sp2-гибридизации. Например, в молекуле этилена из четырех валентных электронов в образовании химической связи используется только три. Оставшийся негибридный р-электрон уходит на образование двойной связи.
Ацетилен является простейшим представителем класса СпН2п-2. Особенностью этого класса углеводородов является наличие тройной связи. Из четырех валентных электронов углеродного атома только два меняют свою форму и энергию, становясь гибридными. Два оставшихся электрона принимают участие в образовании двух двойных связей, определяя ненасыщенный характер этого класса органических соединений.
Примеры решения задач
Задание Определите с помощью метода валентных связей тип гибридизации молекулы метана (CH4) и его геометрическую структуру по методу Гиллеспи Решение 6С 2s22s22p2 1H1s1 Чтобы принять 4 лиганда атому углерода необходимо перейти в возбужденное состояние, следовательно электроны 2s-орбитали распарятся и один из них перейдет на p-орбиталь – в гибридизации будут участвовать все валентные орбитали атома углерода. Тип гибридизации sp3. Рассчитываем НЕП : (4 – 4)/2=0, следовательно метан имеет тетраэдрическую структуру. Ответ Тип гибридизации sp. Метан имеет тетраэдрическую структуру.
Задание Определите с помощью метода валентных связей тип гибридизации молекулы BCl3 и его геометрическую структуру по методу Гиллеспи Решение 5B 1s22s22p1 17Сl 1s22s22p63s23p5 Атому бора необходимо перейти в возбужденное состояние, чтобы принять 3 атома хлора: Тип гибридизации sp2. Рассчитываем НЕП : (3 – 3)/2=0, следовательно молекула BCl3 имеет структуру плоского треугольника. Ответ Тип гибридизации sp. Молекула BCl3 имеет структуру плоского треугольника.
Источник
Виды связи по способу перекрывания электронных орбиталей
- Главная
- Обучение
- Предварительный просмотр
- Мероприятия / ВИШР
- Обучение
- Тренажер ЕГЭ
- Учебные пособия
- Игры
- 120 лет ТПУ. Викторина онлайн
- Университетские субботы
- Высшая инженерная школа России
Химия
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
Химические связи в молекулах органических соединений
Химическая связь – это силы взаимодействия между атомами или группами атомов, приводящие к образованию молекул, ионов, и т.д. По своей природе химическая связь – это электростатические силы. Главную роль при образовании химической связи между атомами играют их валентные электроны, т. е. электроны внешнего уровня, наименее прочно связанные с ядром. Из курса общей химии вы знаете о существовании ковалентной и ионной связи.
Ионная связь – это химическая связь, основанная на электростатическом притяжении ионов. Она возникает при большой разнице электроотрицательностей связываемых атомов. В органических соединениях ионные связи встречаются довольно редко, например, в солях карбоновых кислот:
Для органических соединений наиболее характерна ковалентная связь.
Ковалентная связь – это химическая связь, образованная за счет обобществления электронов двумя и более ядрами. Существуют два способа обобществления электронной пары: обменный и донорно-акцепторный.
По обменному механизму в образовании связи участвуют по одному электрону от каждого атома:
Н· + Cl· → H : Сl
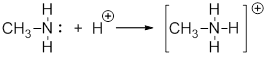
По донорно-акцепторному механизму ковалентная связь образуется за счет объединения электронной пары одного атома и свободной орбитали другого. Примером может служить взаимодействие молекулы амина с протоном с образованием метиламмоний катиона:
Классификация ковалентной связи по способам перекрывания атомных орбиталей
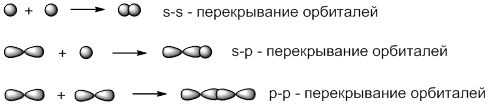
В зависимости от способа перекрывания атомных орбиталей различают σ- и π-связи. σ –связи образуются в результате перекрывания орбиталей вдоль линии, соединяющей центры ядер двух атомов:
π –связи образуются в результате бокового p-p-перекрывания орбиталей, в результате которого образуются две области повышенной электронной плотности:
Типы разрыва ковалентной связи
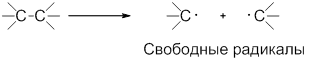
Разрыв ковалентной связи может происходить по гомолитическому или гетеролитическому механизмам.
Гомолитические реакции – реакции, в которых разрыв связи происходит симметрично, так что каждому из образующихся фрагментов отходит по одному электрону:
Гомолиз от греческого homos – одинаковый, lysis – разрыв.
В ходе гомолитических реакций в качестве интермедиатов образуются свободные радикалы – частицы, содержащие неспаренный электрон, например:
Радикал – атом или группа атомов, имеющие неспаренный электрон.
Гетеролитические реакции – реакции, в которых разрыв связи происходит несимметрично, так что пара электронов связи остается у одного из образующихся фрагментов:
Гетеролиз – это несимметричный разрыв ковалентной связи, в результате которого образуются разные по природе частицы: катион и анион.
Если заряды в таких частицах находятся на атоме углерода, их называют – карбокатионы и карбанионы, например:
Электронная пара остается у более электроотрицательного атома.
Источник