- Ученый из МФТИ раскрыл процесс создания вакцины от коронавируса
- Как создают вакцину от коронавируса?
- Вакцина МФТИ: в чем инновация?
- Вакцина МФТИ будет эффективна против разных штаммов SARS-CoV-2
- Массовая вакцинация от COVID-19 может не понадобиться?
- Как сделать аденовирусную вакцину?
- Введение: Аденовирусы и инфекции
- Создание аденовирусного вектора
- Очистка и упаковка
Ученый из МФТИ раскрыл процесс создания вакцины от коронавируса
Как создают вакцину от коронавируса?
Об эксперте: Павел Волчков — кандидат биологических наук, вирусолог, генетик, заведующий Лабораторией геномной инженерии Московского физико-технического института (МФТИ).
Существует много разных подходов к созданию вакцины от COVID-19. Она может быть вирусной, инактивированной, векторной, на основе нуклеиновых кислот. Какая из них окажется самой эффективной — пока никто точно не знает. Если вы разработчик, то можете выбрать любую и принять участие в большой мировой гонке по созданию долгожданной прививки. А можете, как ученые из МФТИ, сознательно отказаться от возможных бенефитов и неспешно заняться разработкой экспериментальной вакцины нового типа.
Одни из самых популярных на сегодняшний день — это рекомбинантные или векторные вакцины. Они изготавливаются на основе вирусов-носителей или вирусных векторов. Как это работает? Вы берете какие-то вирусные частицы, «вычищаете» из них все патогенные составляющие и на их место вставляете нужные вам элементы — генетический материал вируса, против которого изготавливается вакцина. По такому принципу была создана прививка от вирусного гепатита B или ротавирусной инфекции. И по такому же принципу сегодня многие разработчики создают вакцину от COVID-19. В частности, в России векторную вакцину от коронавируса разработали в НИИ эпидемиологии и микробиологии имени Н.Ф. Гамалеи.
Павел Волчков:
«Чем хорош вирусный вектор? Он способен инфицировать клетки только один раз и не может размножаться в организме человека дальше. Такая особенность делает рекомбинантные вакцины довольно безопасными. При этом в качестве вирусного вектора можно использовать буквально любой вирус из библиотеки человеческих патогенов. Выбор зависит от того, для какого заболевания вы изготавливаете вакцину. Потому что одни вирусы лучше заражают мышцы, другие — легкие, третьи — центральную нервную систему. Например, та же вакцина Центра Гамалеи выполнена на аденовирусном векторе».
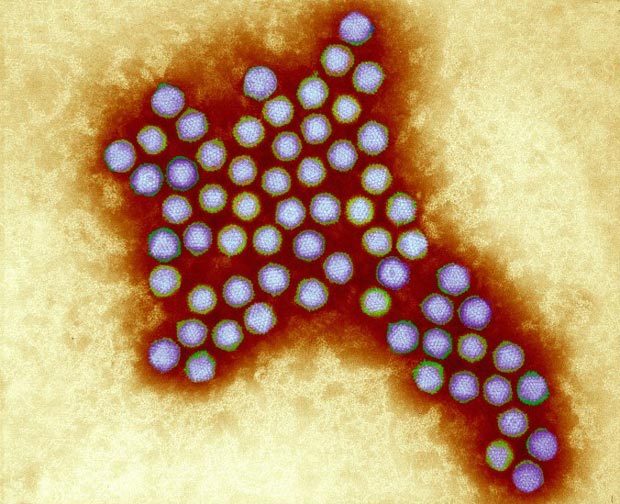
Аденовирусы — ДНК-вирусы. Относятся к группе острых респираторных вирусных инфекций (ОРВИ) и характеризуются поражением слизистых оболочек верхних дыхательных путей, конъюнктив, лимфоидной ткани. Большинство аденовирусных инфекций представляют собой легкую форму инфицирования. Существует семь видов аденовирусов человека (от А до G) и 57 серотипов. Подразделение на серотипы связано с различными способами заражения.
В качестве векторов для вакцин, аденовирусы применяются довольно давно. Эти вирусы хорошо изучены. Согласно данным сайта ClinicalTrials.gov, клинические испытания на людях успешно прошли или проходят более сотни различных вакцин на основе аденовирусных векторов.
Среди главных преимуществ этих вирусов — их естественный механизм взаимодействия с клетками человека. Они способны обеспечивать довольно длительную экспрессию антигена, а это успешно активирует врожденный иммунный ответ.
Антигены — это любые вещества, содержащиеся в микроорганизмах и других клетках (или выделяемые ими), которые несут в себе признаки генетически чужеродной информации, и которые потенциально могут быть распознаны иммунной системой организма.
Павел Волчков:
«При всех плюсах, у аденовирусов есть и ряд минусов. Первое — они обладают провоспалительным эффектом. То есть могут чрезмерно драйвить иммунную систему. Проще говоря — вызывать сильный иммунный ответ. Это один из возможных побочных эффектов вообще всех аденовирусных вакцин. Но есть еще один нюанс. Большинство аденовирусов — это естественные патогены человека. Многие из нас сталкивались в течение жизни с аденовирусными инфекциями. А что это значит? Что в крови у таких людей уже есть нейтрализирующие антитела к этому вирусу. Они могут связываться с компонентами вакцины и блокировать ее действие. Поэтому для некоторых из нас такая вакцина будет совершенно неэффективна».
Вакцина МФТИ: в чем инновация?
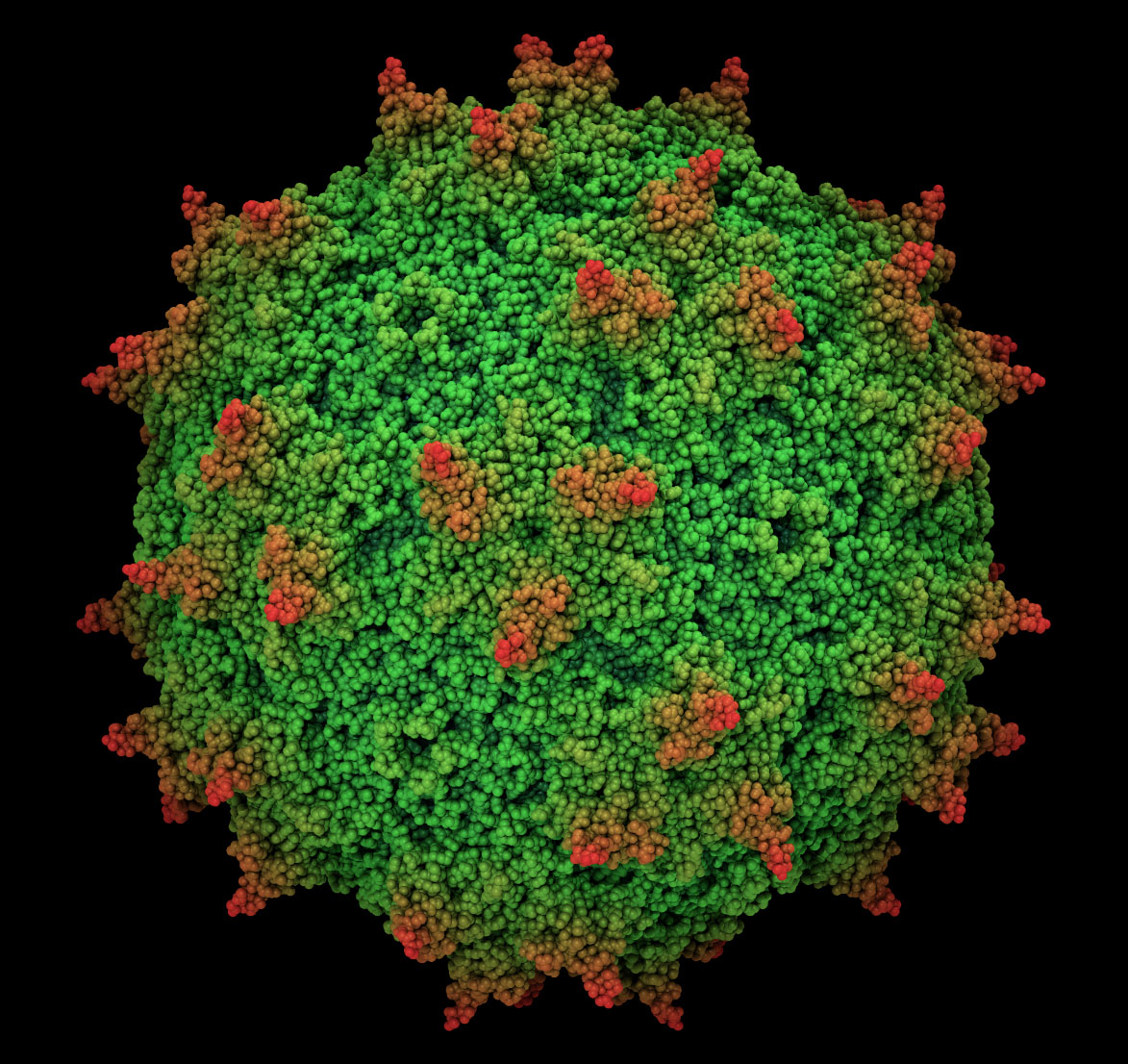
Поскольку у аденовирусных векторов есть существенные недостатки, ученые из МФТИ выбрали другие вирусы в качестве вектора — аденоассоциированные вирусы. Что любопытно, раньше никто в мире не использовал их в таком качестве.
Аденоассоциированные вирусы — мелкие ДНК-содержащие вирусы. Размер частиц 22-24 нм. Размножаются только в присутствии аденовирусов. Способны инфицировать клетки человека и некоторых других приматов. Аденоассоциированный вирус, по-видимому, не вызывает заболеваний у человека, поэтому провоцирует слабый иммунный ответ.
Один из плюсов аденоассоциированных вирусов — они давно и успешно используются в генной терапии. Сегодня зарегистрировано несколько лекарственных средств на их основе. Одно из самых нашумевших — Luxturna. Это первое генное лекарство, созданное для лечения наследственной слепоты, вызванной мутацией гена RPE65.
По аденоассоциированным вирусам также накоплена внушительная клиническая база. На сайте ClinicalTrials.gov можно увидеть, в каком количестве клинических экспериментов аденоассоциированные вирусы уже приняли участие. Это несколько сотен доклинических исследований и порядка 50 клинических экспериментов. Носитель хорошо охарактеризован и, что еще важнее, показана его безопасность. Все это делает аденоассоциированные вирусы весьма привлекательным кандидатом для создания вирусных векторов не только для генной терапии, но и для вакцин, уверены в Лаборатории геномной инженерии МФТИ.
Еще одной веской причиной создать вакцину на аденоассоциированном векторе стало то, что ученые из МФТИ уже давно придумывают, модифицируют и создают аденоассоциированные вирусы. На сегодняшний день в библиотеке МФТИ их более миллиона. Все они имеют разную специфичность и разные свойства. Что важно, к этим вирусам у человека не может быть иммунного ответа, который бы снизил эффективность вакцины. Поскольку все они созданы искусственно.
Павел Волчков:
«Мы с самого начала понимали, что сможем не только разработать вакцину, но и масштабировать ее производство. То есть произвести столько доз, сколько потребуется или столько, сколько захотим. В мире существует огромное количество аутсорсинговых компаний, которые по GMP сделают вам любое количество доз препарата.
Good Manufacturing Practice (GMP) — правила, которые устанавливают требования к организации производства и контроля качества лекарственных средств для медицинского и ветеринарного применения.
Поэтому с самого начала у нас было четкое понимание, что проблем с производством не будет. Как и проблем с лицензией на вирусный носитель. Это качественно отличает нашу лабораторию от многих других разработчиков вакцин в Российской Федерации. В современном мире все технологии так или иначе кому-то принадлежат, и аденовирусы, и прочие системы векторной доставки, аденоассоциированные в том числе. Живя по правилам свободного рынка, вы не можете просто взять и сделать вакцину на основе любого понравившегося вектора. Вы должны иметь разрешение от компании, которая обладает правами на технологию, либо владеет непосредственно интеллектуальной собственностью в области этого вектора. И тут у нас все хорошо — мы как раз владеем патентом по разработке аденоассоциированных вирусов. Нам не нужно просить ни у кого лицензию на производство данной вакцины, поскольку мы используем собственные же аденоассоциированные вирусы».
Вакцина МФТИ будет эффективна против разных штаммов SARS-CoV-2
Изначально ученые хотели разработать вакцину, которая бы вырабатывала иммунитет практически ко всем поверхностным белкам вируса SARS-CoV-2. А не только к S-белку, как это делают большинство разработчиков вакцин по всему миру (включая НИИ им. Гамалеи). Но в итоге разработчики остановились на конечном числе компонентов. Ими стали S-белок, Е-белок и М-белок.
Павел Волчков:
«По сути мы воплощаем идею совершенно нового типа вакцин — так называемых поливалентных вакцин. Это когда в одном препарате сразу несколько вирусных компонентов. Такой подход кажется нам крайне эффективным применительно к SARS-CoV-2. Ведь на самом деле это не один какой-то конкретный вирус, который распространился по планете. Если мы начнем секвенировать разные изоляты коронавируса, то они все будут отличаться друг от друга. Либо на одну аминокислотную замену, либо на несколько. Поливалентная вакцина как раз направлена на то, чтобы вырабатывать иммунный ответ не к одному поверхностному белку вируса, а сразу к нескольким. В том числе к консервативным поверхностным белкам, которые меньше остальных подвержены мутациям. Так наша вакцина поможет сформировать иммунитет к разным штаммам вируса SARS-CoV-2».
Если текущая разработка покажет свою эффективность и безопасность, ученые планируют пойти еще дальше и разработать вакцину, которая будет содержать не только различные компоненты SARS-CoV-2, но еще и вируса гриппа или других сезонных респираторных вирусов. То есть объединить в одной вакцине генетический материал от самых разных сезонных патогенов. По мнению ученых из МФТИ, такие ассемблированные, поливалентные вакцины могли бы готовить людей каждый сезон к новому остро-респираторному вирусному нашествию.
Что касается текущей разработки (вакцины от COVID-19), то на данный момент ее разработка завершена. Впереди подготовка к доклиническим испытаниям на китайских хомяках и приматах. Если они пройдут успешно, вакцину ожидают испытаниях на людях. Но торопиться и участвовать в текущей «вакцинной» гонке разработчики из МФТИ не собираются.
Павел Волчков:
«Дело в том, что в нашей вакцине слишком много новых компонентов. Несмотря на то, что аденоассоциированные вирусы используются в генной терапии, для создания вакцин их еще никто не применял. Спешка или сокращение сроков проведения доклинических и клинических исследований может обернуться ошибкой и поставить крест на такой многообещающей и перспективной платформе. Но это не значит, что сейчас мы создаем вакцину, что называется «в стол». Во-первых, когда она будет испытана, мы сможем ее продавать другим нуждающимся странам. Во-вторых, наша основная цель — получить опыт по созданию быстрых вакцин, который мы планируем применять в будущем. Как научная лаборатория мы можем проводить такие эксперименты — создавать платформу для вакцин совершенно нового типа. И если у нас все получится, то в следующий раз, когда в мире появится новость о новой вспышке заболевания, мы будем готовы пройти весь путь создания препарата гораздо быстрее, чем мы проходим его сейчас».
Массовая вакцинация от COVID-19 может не понадобиться?
Павел Волчков уверен, что сама по себе гонка по созданию вакцин от короновируса уже не имеет смысла. Он уверен, что к тому моменту, когда российские вакцины будут испытаны и наработаны для массовой вакцинации населения, потребность в них может отпасть. Ученый считает, что уже к осени мы все, так или иначе, переболеем COVID-19 и получим естественный иммунитет.
У этой оптимистичной гипотезы есть основания. Не так давно шведские ученые провели исследование и померяли иммунитет в шведской популяции. Измерялся и гуморальный иммунитет (то есть антитела в крови), и клеточный иммунитет. А именно Т-лимфоциты — так называемые клетки иммунной памяти, которые при повторной встрече с инфекцией «просыпаются» и активизируют иммунный ответ.
Исследование показало, что лишь у небольшой части шведов в крови присутствовали антитела, но примерно треть граждан имела ту самую клеточную память. Это говорит о том, что существенная часть популяции шведов в той или иной форме переболела COVID-19 или имела непродолжительный контакт с вирусом. В последнем случае большой продукции антител не происходит, но благодаря Т-лимфоцитам формируется иммунологическая память к COVID-19.
Павел Волчков:
«Согласно московской статистике, антитела к коронавирусу были определены в крови примерно у 20% жителей столицы. А это около 2 млн человек. Следуя логике шведского исследования, которому у меня лично нет причин не доверять, то скорее всего еще у 20% (а может и у 40% или даже 50-60%) людей уже есть клеточный иммунитет к COVID-19. Эти люди контактировали с небольшими дозами вируса, их иммунная система его детектировала и сформировала клетки памяти. Фактически, половина населения столицы естественным образом получила живую вакцину от COVID-19. Что примечательно, иммунитет, полученный в результате натуральной инфекции, оказывается более стойким, чем от гипотетической вакцины. Потому что в таком случае, иммунная система знакомится с полноценным вирусом (со всеми поверхностными белками), а не с его редуцированной версией, как это происходит при вакцинации. Я думаю, что такая ситуация с клеточным иммунитетом к COVID-19 обстоит не только в Москве, а во многих российских городах. То есть огромное количестве людей по всей России на самом деле уже имеет иммунитет к коронавирусной инфекции».
Источник
Как сделать аденовирусную вакцину?
Недавно я рассматривал процессы которые используются для производства мРНК вакцин, и подумал, что будет уместным, написать еще и про производство векторных аденовирусных вакцин, таких как J&J, Oxford/AstraZeneca, CanSino, НИЦЭМ Гамалеи и других. Это совершенно другая система, со своими преимуществами и недостатками и со своей длинной историей масштабирования производства, где на каждом шагу — компромиссы. Всегда сложно вырваться из ограничений инженерной триады: «Быстро, Дешево, Качественно — выбирай любые два». Другими словами, если что-то выполняется дешево и качественно, то вряд-ли быстро или если быстро и качественно, то вряд-ли дешево. И, разумеется, если быстро и дешево, то навряд ли хоть сколь-нибудь качественно!
Введение: Аденовирусы и инфекции
Аденовирусы — очень распространенные патогены, содержащие двухцепочечную ДНК и кажется бесспорным, что каждый читающий эти строки, заражался несколькими из них в течение жизни. Они, как правило, вызывают легкие респираторные симптомы и иногда проявляются в виде ушных инфекций или конъюнктивита. У нас нет никаких противовирусных препаратов или вакцин против аденовирусов в широком доступе (хотя были попытки программ разработок противоаденовирусных препаратов у военных). Подтипы: существуют как минимум 88 подтипов, которые способны заражать людей (больше с тех пор, как была опубликована данная статья!), подразделенных на несколько связанных групп. Среди наиболее распространенных аденовирус пятого подтипа (Ad5), и в некоторых регионах мира можно найти 80-90% населения уже серопозитивны.
Аденовирусы долгое время используются как инструменты в молекулярной биологии, потому что они способны переносить модифицированную ДНК, они не проявляют склонности интегрировать ДНК в человеческие геномы и умеют заражать как делящиеся, так и неделящиеся клетки. Но, как показывают вышеприведенные цифры, обратная сторона их использования в качестве терапии для людей, состоит в том, что у многих людей с самого начала могут быть антитела для борьбы с вирусным вектором, что, несомненно, снизит эффективность терапии. По этой причине ведется длительный поиск редких и необычных Ad-форм, что объясняет, почему J&J и НИЦЭМ им. Н. Ф. Гамалеи используют Ad26, Oxford / AZ использует вирус от шимпанзе (а не человеческий), ReiThera использует аденовирус гориллы и т.д. Собственно, поэтому люди задаются вопросом об общей эффективности CanSino, поскольку они используют Ad5 подтип.
Независимо от того, какой вариант вы используете, вам также нужно подумать, что произойдет если вы сделаете вторую прививку той же вакциной — сколько вирионов дойдет до цели? Нужно отметить, что с текущим уровнем клинических испытаний, за короткое время, мы получаем все больше реальных данных — больше чем мы когда-либо могли себе представить. Такое положение дел тесно связано с еще большим вопросом: если вы получили вакцину (или даже генную терапию?) с определенным аденовирусным вектором, что произойдет, если вы захотите получить еще одну вакцину от другого заболевания, которая использует тот же вектор? Еще один неотвеченный вопрос — нужно ли исключать большое количество людей с Ad5, Ad26 и другим подтипами?
Независимо от типа аденовируса, конечный результат такой вакцинации очень похож на то, что происходит с мРНК-вакциной. Аденовирус внедряется и проходит свой обычный путь инфицирования — вся машинерия остается неизменной. Но в данном случае, ДНК, которая доставляется в ваши клетки — не большой набор инструкций, для создания новых аденовирусов, а гораздо более короткие последовательности которые кодируют белок-«шип» коронавируса. Другими словами, модифицированная ДНК транскрибируется в информационную РНК в ваших клетках (это тот же самый шаг, с которого начинают мРНК вакцины), и далее мРНК транслируется рибосомой в тот самый белок-шип. Производство чужеродного белка запускает иммунную систему, которая безусловно, уже наготове, потому что уже заметило вирусную атаку. Вот почему вам не нужно добавлять адъювант ни к вирусным векторным вакцинам, ни к мРНК вакцинам — они прекрасно запускают различные механизмы обнаружения чужеродных ДНК и РНК сами по себе, в то время, как просто инъекция белка шипа пропускает некоторые механизмы обнаружения. Как правило, такие системы основаны на обнаружении чужеродных ДНК и РНК, и переход от них к введенному белку приводит к менее энергичному ответу (поэтому нужен адъювант).
Создание аденовирусного вектора
Итак, перейдем к тому, как делать вакцины. Вам нужно будет произвести огромное количество инфекционных вирусных частиц, каждая из которых содержит модифицированную укороченную ДНК, которую вы хотите доставить в клетки пациента. Вы особенно хотите вырезать часть аденовирусного генома, которая называется E1, удаление которого делает невозможным репликацию вируса. Если вам нужно больше места, вы также можете вырезать часть, которая называется E3. Все это было исследовано некоторое количество лет назад — как оказалось в вирусном геноме есть ряд областей, которые подходят для сплайсинга в ваших собственных последовательностях.
Но для того, чтобы сделать задуманное и создать систему, которая будет производить заготовки нового вирусного вектора, потребуется несколько генетических шагов. Наиболее распространенный способ это сделать, если в общих чертах — создать связку (линейной) аденовирусной ДНК, с вашими собственными модификациями, а затем поместить ее в большой реактор, заполненной культурой человеческих клеток. И (что важно) эти человеческие клетки специально сконструированы для производства белков, которые оригинально должна производить вирусная E1 область, то есть, та область, которая отвечает за репликацию. Такой трюк позволяет модифицированному аденовирусу реплицироваться в культуре клеток человека и дает значительный выход новых вирусных частиц, но гарантирует то, что полученные вирусы сами не смогут больше реплицироваться. Белки E1, которые им нужны, не закодированы в их геномах (вы вынули эту часть), но присутствовали в культуре человеческих клеток. При введении пациенту они определенно не встретят никаких других человеческих клеток, которые вырабатывали бы для них вирусные белки E1.
Итак, первый шаг в процессе — создание вирусной ДНК и изготовлении большого количества ее. Этот процесс часто выполняют в бактериях, потому что бактериальная ДНК относительно проста в обращении и репликации. На самом деле, есть коммерческие системы, которые можно купить, чтобы сделать нужное в лабораторных масштабах — то есть , вы можете купить плазмиды (кольцевые молекулы ДНК, используемые бактериями) которые уже имеют A5 аденовирусный геном, с уже удаленными E1 и E3 областями, с дополнительными последовательностями, настроенными для простой вставки любой ДНК. Еще один способ сделать требуемое — использовать плазмиду, которая называют искусственная бактериальная хромосома (bacterial artificial chromosome, BAC), вы можете купить такие варианты, у которых есть функции, необходимые для модификации. Но помните, что J&J и НИЦЭМ им. Н. Ф. Гамалеи используют Ad26, в то время как Oxford/AZ используют аденовирус шимпанзе, поэтому коммерческие Ad5 реагенты бесполезны — упомянутые компании разрабатывают свои собственные инструменты. Ранее CanSino сообщила об использовании коммерческой системы AdMax от Microbix (Toronto) для своей работы с плазмидами. Как бы то ни было, в любом варианте, сначала нужно заставить бактерии (часто это старая добрая кишечная палочка), наработать большое количество копий плазмид. Потом вы лизируете (вскрываете) бактерии, изолируете нужные ДНК, а затем раскрываете кольцевые плазмиды, чтобы получить линейные молекулы ДНК. Некоторые из BAC могут быть спроектированы так, чтобы делать и эти модификации за вас, экономя вам один шаг. Линейная форма ДНК нужна для репликации/упаковки аденовируса, когда он находится в клетке, но также можно получить ДНК аденовируса в виде кольцевой плазмиды. Ранние оксфордские статьи ссылаются на эту главу книги о своих методах. Что касается J&J, то в этом патенте есть некоторые детали их системы.
Судя по этой и этой статье, видно , что команда Oxford / AZ использует BAC, сконструированный из комбинации двух различных плазмид через «рекомбинирование», чтобы внедрить их в то что раньше было областью E1 аденовирусного генома. (Я опускаю детали процесса, чтобы сэкономить время, место и ваше терпение). Между тем, вы можете прочитать о том, что представляет собой плазмидная система J&J здесь и здесь (последняя ссылка подробно описывает другой подтип аденовируса, но очевидно про аналогичные методы, используемые для Ad26).
Пришло время внедрить линейные молекулы ДНК в культуру человеческих клеток. Тут может наблюдаться некоторое противоречие, в зависимости от ваших убеждений. Похоже, что Oxford/AZ, Гамалея и CanSino используют для этого процесса модифицированную версию клеток HEK293, а J&J использует линию под названием PER.C6. Два этих варианта известны уже некоторое время. Аббревиатура HEK обозначает «эмбриональную почку человека» (human embryonic kidney, HEK), и действительно, она была впервые выделена из ткани абортированной плода в начале 1970-х годов в Лейденском университете. Клеточную линию PER.C6 начали использовать к 1998 году, но получили ее в 1985 году также в Лейдене, и также из абортированной ткани, причем часть «ER» означает «эмбриональные ретинобласты». Как вы прекрасно понимаете, люди с сильным предубеждениями против абортов без энтузиазма воспринимают подробности происхождения данных вакцин, в то время как людей с другими убеждениями эта история не беспокоит. Тем не менее, несмотря ни на что, особенно важно, чтобы линейная ДНК трансфектировалась в какую-либо культуру комплементарных человеческих клеток — единственный способ получить повышенный выход конечных вирусных частиц, пригодных для использования в вакцине.
Читая о производстве векторных вакцин, вы иногда можете встретить фразы «резерв вирусного посевного материала» (virus seed stock) и «банк клеток-хозяев» (host cell bank). Ниже вы увидите, что по всему миру существуют производственные площадки для вакцин, и последнее, что вам нужно, — это чтобы все работали в одиночку. Партии плазмид, линейных ДНК, комплементарных клеток и конечного аденовируса хранятся для дальнейшего использования и/или распространения и исчерпывающе охарактеризованы. Вы определенно хотите внимательно следить за партиями, чтобы быть уверенными, что вы имеете дело с одними и теми же вещами на всех производственных площадках.
Культура клеток человека — любая культура клеток — одновременно и научный процесс, и искусство. Спросите любого, буквально любого, кто работал в этой области, особенно в промышленном масштабе, то они подтвердят еще энергичнее. Это (вероятно) самое слабое место всего процесса производства вирусных векторов. Когда все хорошо работает, сложно превзойти данный метод заражения живых клеток и превращение в фабрики вирусов. Но не всегда все работает так, как должно. Похоже, что у AstraZeneca возникли проблемы, из-за того, что на одном из их крупнейших производственных предприятий возникли проблемы с низким выходом вируса, хотя все должно быть одинаковым (та же вирусная ДНК, та же линия клеток и т.д.)
Чтобы представить культуру клеток HEK293, необходимо знать, что они бывают разных типов, те, которые растут на поверхности культурального сосуда (прикрепленные, HEK293A) или те, которые растут плавая в суспензии (HKE293S). Возможно, вам понадобится последний вариант для серьезного масштабирования (не в последнюю очередь потому, что так можно выращивать в трех измерениях а не в двух), но и это можно сделать любым способом. Прикрепленные клетки растут до тех пор пока не соприкасаются и не образуют пластовый слой на своей поверхности, и некоторые линии клеток в этом случае развиваются нормально, а другие, случается, нет (или постепенно менее «счастливы» из-за соседства). Линии суспензионных клеток делятся и образуют более концентрированную суспензию, и также по-разному реагируют на этот процесс. Вы должны продумать, в каких средах все эти клетки растут и какие питательные вещества необходимо предоставить (и в какой концентрации), накоплении отходов (и остатков мертвых клеток), промывании прикрепленных линий свежей средой, скорости перемешивания, технике суспендирования . о, это бесподобно.
Например, когда используются искусственно созданные клетки для производства модифицированных человеческих белков (чрезвычайно распространенная задача как в академической, так и в промышленной молекулярной биологии), я участвовал в проекте, в котором выход белка резко менялся с использованием тех же зачарованных клеток, выращенных в «барабанах», которые перемешивались путем медленного вращения (примерно как в хот-дог-аппаратах), по сравнению с «шейкерами», более свободного типа, которые медленно раскачивались вращательными движениями. Почему это важно для клеток? Лучше вы мне это расскажите — но факт, что при одних условиях клетки производили намного больше белка, чем при других. Почему одна из фабрик у Астразенеки производит меньше векторных вирусов, чем должна? Кто знает?
Очистка и упаковка
Выделение вирусных частиц, вероятно, устроена очень похожим образом во всех обсуждаемых вакцинах. Мне не удалось (что неудивительно) найти подробную информацию о производстве какой-либо из текущих вакцин, но, вероятно, этот этап был одним из менее сложных частей оптимизации процесса, учитывая всю работу, которая уже была проделана над аденовирусами в течение многих лет. Вы лизируете клетки культур и делаете грубую фильтрацию, чтобы пропустить вирусные частицы и удержать клеточный мусор. Согласно этой странице от AstraZeneca, похоже, что они применяют несколько этапов фильтрации, а затем используют мембранную хроматографию (вероятно, используют какой-то варианта ионообменной технологии, разделения по заряженным остаткам поверхностных белков вируса) с последующей ультрафильтрацией. Можно поспорить, что все обсуждаемые компании уже имели довольно четкое представление о том, какие именно шаги они собираются предпринять, даже если все шаги требовали некоторой настройки оптимизаций, а также верификации на каждом шаге. Соответствующие регуляторы, знают обо всех деталях, но я не думаю, что мы увидим подробности.
Далее необходимо сформировать вирусные частицы, что является гораздо менее сложным процессом, чем в случае с вакцинами мРНК. Остальные ингредиенты для вакцины достаточно безобидны, никаких необычных липидов, необходимых для липидных наночастиц. Вот список вакцины от НИЦЭМ им. Н. Ф. Гамалеи (см. первую страницу текста); в нем нет ничего, что могло бы вызвать проблемы с поставками. Наконец, время для «разлива/финализации», что является общим шагом для всех — увеличение мощностей производственных линий по наполнению и закупориванию стерильных флаконов.
подробнее про то, где производятся и упаковываются аденовирусные вакцины
Я заметил, что самые ранние партии вакцины от Oxford/AZ были произведены в самом Оксфорде, а позже были произведены и упакованы компанией Advent (в Помезии, Италия) и COBRA Biologics (в Килле, Великобритания) с заправкой флаконов. от Symbiosis (в Стерлинге, Великобритания). Они работают с крупной контрактной фирмой Catalent как в США (Харманс, штат Мэриленд), так и в Европе (Ананьи, Италия) в области разлива/финализации. Также есть производство в в Нидерландах (Halix) и Бельгии (Novasep, в Seneffe). В последней фабрике, по-видимому, и наблюдались проблемы с выходом вакцины. Он также финализируется в Дессау, Германия, компанией IDT Biologika. Русский производитель R-Pharm имеет завод в Германии, производящий на экспорт в страны СНГ (там же производится вакцина НИЦЭМ им. Н. Ф. Гамалеи). Испанский Insud также задействован, как и их новый завод в Аргентине. AZ также имеет крупное производственное соглашение с Сывороточным институтом Индии, а WuXi участвует в Китае и на заводе в Вуппертале, Германия. Я уверен, что пропустил несколько сделок.
J&J, со своей стороны, имеет большие мощности в Нидерландах (например, в Лейдене), а также они подписали соглашения с Emergent на производство вакцины в Балтиморе (которые также работают с AstraZeneca и, с Novavax, которая делает пептидную вакцину на отдельном заводе в Мэриленде). Они также работают с Catalent (на их заводе в Блумингтоне, Индиана, а также на заводе Ананьи, в Италии), Reig Jofre в Барселоне, Aspen Pharmacare (в Порт-Элизабет, Южная Африка), Biological E в Индии (которые только что купили еще один завод в Химачал-Прадеше), а также с PCI Pharma для хранения и транспортировки. Без сомнения, есть и другие сделки.
Итак, теперь вы знаете про весь процесс, по крайней мере в общих чертах. Любой из этапов можно рассматривать детальнее, но по большей части текст должен дать вам базовое представление о том, что происходит (а во многих случаях, дает вам даже больше, чем вы когда-либо хотели знать!). Как видите, это принципиально иной процесс, нежели производство вакцины мРНК, со своей спецификой (хорошей и плохой). Все это может стать важным, если нам придется переоборудовать существующие вакцины-кандидаты для новых вариантов, но это тема для другого дня!
Переводчик — не вирусолог, текст достаточно объемный, поэтому про ошибки прошу сообщать.
Я решил перевести статью, потому что на хабре писали почти исключительно о мРНК-вакцинах , но не про аденовирусные ДНК-вакцинах. Хотя они не менее интересно устроены и также очень сложны.
В предыдущей публикации о мРНК вакцинах, Дерек писал чуть более структурированно, но в этой статье, к сожалению, текст разделен еще меньше. Если еще дальше уходить от деталей, то этапы, приблизительно, можно разделить таким образом:
создание вирусной ДНК (обычно в бактериях)
лизис бактерий, раскрытие циклической ДНК в линейную
внедрение линейных ДНК в культуру человеческих клеток (вероятно самый сложный и капризный этап)
Источник