- Этилен (этен), получение, свойства, химические реакции
- Этилен (этен), получение, свойства, химические реакции.
- Этилен (этен), формула, газ, характеристики:
- Физические свойства этилена (этена):
- Химические свойства этилена (этена):
- Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
- Применение и использование этилена (этена):
- Практ. 1
- Практическое занятие № 8. Получение этилена и изучение его свойств
- Физические свойства этилена (этена):
- Видео
- Окислительное дегидрирование этана
- Применение и использование этилена (этена):
Этилен (этен), получение, свойства, химические реакции
Этилен (этен), получение, свойства, химические реакции.
Этилен (этен), C2H4 – органическое вещество класса алкенов. Этилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Этилен (этен), формула, газ, характеристики:
Этилен (этен) – органическое вещество класса алкенов, состоящий из двух атомов углерода и четырех атомов водорода . Этилен имеет двойную углерод -углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Химическая формула этилена C2H4, рациональная формула H2CCH2, структурная формула CH2=CH2. Изомеров не имеет.
Этилен – бесцветный газ, без вкуса, со слабым запахом. Легче воздуха.
Этилен является фитогормоном, т.е. низкомолекулярным органическим веществом, вырабатываемым растениями и имеющим регуляторные функции. Он образуется в тканях самого растения и выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов ), распускание бутонов (процесс цветения), старение и опадание листьев и цветков, участие в реакции растений на биотический и абиотический стресс, коммуникации между разными органами растений и между растениями в популяции.
Пожаро- и взрывоопасен.
Плохо растворяется в воде . Зато хорошо растворяется в диэтиловом эфире и углеводородах.
Этилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Этилен — самое производимое органическое соединение в мире.
Физические свойства этилена (этена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,178 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,26 |
| Температура плавления, °C | -169,2 |
| Температура кипения, °C | -103,7 |
| Температура вспышки, °C | 136,1 |
| Температура самовоспламенения, °C | 475,6 |
| Критическая температура*, °C | 9,6 |
| Критическое давление, МПа | 5,033 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,75 до 36,35 |
| Удельная теплота сгорания, МДж/кг | 46,988 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0163 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0209 |
| Молярная масса, г/моль | 28,05 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства этилена (этена):
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, замещение, окисление, полимеризация молекул.
Химические свойства этилена аналогичны свойствам других представителей ряда алкенов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое гидрирование(восстановление)этилена:
- 2. галогенирование этилена:
Однако при нагревании этилена до температуры 300 o C разрыва двойной углерод-углеродной связи не происходит – реакция галогенирования протекает по механизму радикального замещения:
- 3. гидрогалогенирование этилена:
- 4. гидратация этилена:
Реакция происходит в присутствии минеральных кислот (серной, фосфорной). В результате данной химической реакции образуется этанол.
- 5. окисление этилена:
Этилен легко окисляется. В зависимости от условий проведения реакции окисления этилена могут быть получены различные вещества: многоатомные спирты, эпоксиды или альдегиды.
В результате образуется эпоксид.
В результате образуется ацетальдегид.
- 6. горение этилена:
В результате горения этилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и вода .
- 7. полимеризация этилена:
Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
Этилен получают как в лабораторных условиях, так и в промышленных масштабах.
В промышленных масштабах этилен получается в результате следующей химической реакции:
- 1. каталитическое дегидрирование этана :
Этилен в лабораторных условиях получается в результате следующих химических реакций:
- 2. дегалогенирования дигалогенпроизводных этана:
- 3. неполное гидрирование ацетилена:
- 4. дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей:
Применение и использование этилена (этена):
– как сырье в химической промышленности для органического синтеза различных органических соединений: галогенпроизводных, спиртов (этанола, этиленгликоля), винилацетата, дихлорэтан, винилхлорида, окиси этилена, полиэтилена , стирола, уксусной кислоты, этилбензола, этиленгликоля и пр.,
Примечание: © Фото //www.pexels.com, //pixabay.com

как получить этилен реакция ацетилен этен 1 2 вещество этилен кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этилена
напишите уравнение реакций этилен
Источник
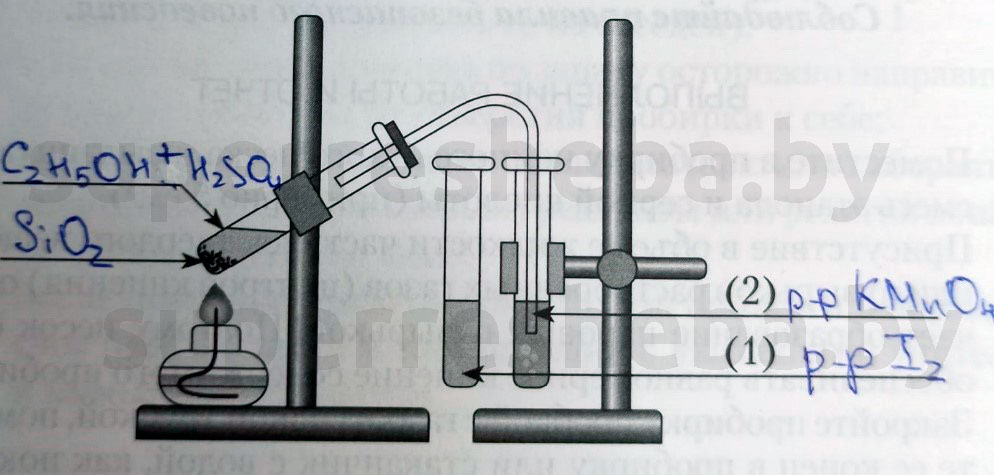
Практ. 1
Напишите над стрелками формулы или названия веществ в пробирках.
Объясните явления, которые наблюдаются в процессе получения этилена.
В процессе получения мы наблюдали появление пузырьков газа и обесцвечивание растворов иода и перманганата калия. (Причины обесцвечивания приведены далее).
Приведите уравнение реакции получения этилена.
+ ° C 2 H 4 ↑ + H 2 O .
Объясните явления, наблюдаемые при пропускании этилена в пробирки с растворами иода (1) и перманганата калия (2).
В процессе получения этилена мы наблюдали обесцвечивание растворов иода и перманганата калия, потому что образовывались бесцветные продукты реакции. Раствор перманганата обесцвечивался, т.к. в ходе реакции перманганат переходил в щелочь и оксид марганца (IV), а раствора иода – потому что молекулы иода встраивались в молекулу этилена.
Приведите уравнения реакции этилена с раствором иода.
Приведите схему реакции этилена с раствором K M n O 4 \mathrm
Приведите уравнение реакции горения этилена.
1. Напишите, благодаря наличию какого структурного фрагмента в молекулах алкенов они вступают в реакции с иодной и бромной водой. К какому типу относятся данные реакции?
Алкены вступают в реакции с иодной и бромной водой благодаря наличию двойной связи. Эти реакции относятся к реакциям присоединения.
2. В каких условиях реагируют с бромом алканы? К какому типу относится реакция алканов с бромом?
Алканы реагируют с бромом на свету. Это реакция замещения.
3. Сравните отношение к бромной воде алканов и алкенов. Можно ли различить этан и этен при помощи бромной воды?
Да, можно. При пропускании этана через бромную воду раствор брома не будет обесцвечиваться, а при пропускании этена — будет.
Источник
Практическое занятие № 8. Получение этилена и изучение его свойств
Физические свойства этилена (этена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,178 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,26 |
| Температура плавления, °C | -169,2 |
| Температура кипения, °C | -103,7 |
| Температура вспышки, °C | 136,1 |
| Температура самовоспламенения, °C | 475,6 |
| Критическая температура*, °C | 9,6 |
| Критическое давление, МПа | 5,033 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,75 до 36,35 |
| Удельная теплота сгорания, МДж/кг | 46,988 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0163 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0209 |
| Молярная масса, г/моль | 28,05 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Видео
Окислительное дегидрирование этана
Реакция окислительного дегидрирования этана (ОДЭ) производится по следующей формуле:
C2H6 + 1/2O2 = C2H4 + H2O (1)
В качестве окислителя может применяться как концентрированный кислород, так и кислород в составе воздуха. Последние опыты по окислительному дегидрированию этана показали следующие результаты (в качестве окислителя применялся кислород с концентрацией 99,5 %):
- конверсия этана 74,0 %;
- селективность по этилену 82,0 %.
С использованием полученных данных была разработана схема выделения этилена из контактного газа окислительного дегидрирования этана, основанная на абсорбционном методе извлечении этан-этиленовой фракции. Принципиальная схема получения этилена путем ОДЭ представлена на рис. 2.

Схема включает реакционный узел Р-1, узел водной отмывки К-1, стадию предварительного удаления СО2 путем аминовой хемосорбции К-2, компримирования М-1, осушку С-1, колонны абсорбции и десорбции ЭЭФ (соответственно К-3 и К-4), колонну выделения товарного этилена К-5.
Разработанная технология является достаточно гибкой, чтобы проводить окислительное дегидрирование как концентрированным кислородом, так и кислородом воздуха или какой-либо промежуточной смесью воздухкислород. Для любого случая в зависимости от применяемого окислителя в представленной технологии решена проблема образования взрывоопасных смесей кислород-углеводороды-монооксид углерода, что делает технологию простой и безопасной.
Кроме того, гибкость технологии позволяет использовать различные катализаторы окислительного дегидрирования этана, т.е. при появлении новых катализаторов, являющихся по тем или иным характеристикам лучше ныне существующих, их также можно применять в данной технологической схеме.
Благодаря разработанной технологии, а также применению абсорбционной технологии выделения ЭЭФ из контактного газа, исключающей использование хладагентов с температурой ниже минус 37 °С, удалось достичь приемлемых для промышленной установки показателей эксплуатационных параметров. При моделировании технологии были получены следующие результаты:
Расходный коэффициент по сырью, т этана/т этилена 1,29
Расход электроэнергии, МВт⋅ч/т этилена 0,60
Степень извлечения этилена, % 98,5
Моделирование технологии ОДЭ с применением концентрированного кислорода показало значительно более низкие эксплуатационные затраты по сравнению с пиролизом этана (в качестве примера: потребление электроэнергии составляет соответственно 0,6 и 1,0).
Кроме того, технология ОДЭ имеет значительно более простую схему выделения этилена: отсутствуют узлы каталитического удаления ацетилена, низкотемпературного (до минус 100 °С) удаления метана и водорода и другие. В связи с этим данный способ получения этилена претендует на получение высоких результатов при дальнейших более подробных оценках экономической целесообразности реализации данного проекта.
Применение и использование этилена (этена):
– как сырье в химической промышленности для органического синтеза различных органических соединений: галогенпроизводных, спиртов (этанола, этиленгликоля), винилацетата, дихлорэтан, винилхлорида, окиси этилена, полиэтилена , стирола, уксусной кислоты, этилбензола, этиленгликоля и пр.,
Примечание: © Фото //www.pexels.com, //pixabay.com
Найти что-нибудь еще? 

как получить этилен реакция ацетилен этен 1 2 вещество этилен кислород водород связь является углекислый газ бромная вода уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этилена напишите уравнение реакций этилен
Источник