- Ультибро ® Бризхалер ® (Ultibro Breezhaler)
- Владелец регистрационного удостоверения:
- Производство и первичная упаковка:
- Вторичная упаковка и выпускающий контроль качества:
- Активные вещества
- Лекарственная форма
- Форма выпуска, упаковка и состав препарата Ультибро ® Бризхалер ®
- Фармакологическое действие
- Фармакокинетика
- Показания активных веществ препарата Ультибро ® Бризхалер ®
- Ультибро бризхайлер : инструкция по применению
- Описание
- Состав
- Противопоказания
- Меры предосторожности
- Побочное действие
- Фармакотерапевтическая группа
- Срок годности
Ультибро ® Бризхалер ® (Ultibro Breezhaler)
Владелец регистрационного удостоверения:
Производство и первичная упаковка:
Вторичная упаковка и выпускающий контроль качества:
Активные вещества
Лекарственная форма
 | Ультибро ® Бризхалер ® |
Форма выпуска, упаковка и состав препарата Ультибро ® Бризхалер ®
Капсулы с порошком для ингаляций твердые, размер №3, прозрачные, бесцветные, с маркировкой 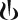
| 1 капс. | |
| гликопиррония основание | 50 мкг, |
| что соответствует гликопиррония бромиду | 63 мкг |
| индакатерола основание | 110 мкг, |
| что соответствует индакатерола малеату | 143 мкг |
Вспомогательные вещества: лактозы моногидрат — 24.757 мг, магния стеарат — 37 мкг.
Состав оболочки капсулы: гипромеллоза — 45.7 мг, вода — 2.7 мг, каррагинан — 420 мкг, калия хлорид — 180 мкг.
Состав черных чернил: шеллак, краситель железа оксид черный (E172), пропиленгликоль, калия гидроксид, вода.
Состав синих чернил: шеллак, индигокармин (E132), пропиленгликоль, титана диоксид.
6 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (1) в комплекте с устройством для ингаляций (бризхалер) — пачки картонные.
6 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (2) в комплекте с устройством для ингаляций (бризхалер) — пачки картонные.
6 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (5) в комплекте с устройством для ингаляций (бризхалер) — пачки картонные.
Мультиупаковка.
6 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (1) — пачки картонные (25) в комплекте с устройством для ингаляций (бризхалер) — коробки.
6 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (2) — пачки картонные (4) в комплекте с устройством для ингаляций (бризхалер) — коробки.
6 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (5) — пачки картонные (3) в комплекте с устройством для ингаляций (бризхалер) — коробки.
Фармакологическое действие
Комбинированное лекарственное средство для ингаляций.
Гликопирроний и индакатерол вызывают расслабление гладкой мускулатуры бронхов, взаимно усиливая бронходилатирующий эффект друг друга за счет различного механизма действия, направленного на различные виды рецепторов. Поскольку плотность расположения м-холинорецепторов и β 2 -адренорецепторов в центральных и периферических дыхательных путях различается, бета 2 -адреномиметики более эффективны для бронхорелаксации периферических дыхательных путей, в то время как м-холиноблокаторы оказывают более выраженный эффект в отношении центральных дыхательных путей. Таким образом, комбинация м-холиноблокатора и бета 2 -адреномиметика способствует оптимальной бронходилатации на всем протяжении нижних дыхательных путей человека.
Гликопирроний — ингаляционный м-холиноблокатор длительного действия, предназначенный для поддерживающей терапии нарушений бронхиальной проводимости у пациентов с ХОБЛ. Нервная регуляция бронхоконстрикции обеспечивается парасимпатической нервной системой, таким образом, холинергическая стимуляция является ключевым компонентом обратимого нарушения бронхиальной проходимости при ХОБЛ. Механизм действия гликопиррония основан на блокировании бронхоконстрикторного действия ацетилхолина на гладкомышечные клетки дыхательных путей, что приводит к бронходилатирующему эффекту. В организме человека выявлено 5 подтипов мускариновых рецепторов (м 1-5 ). Известно, что только подтипы м 1-3 задействованы в физиологической функции дыхательной системы. Гликопирроний обладает в 4-5 раз большей селективностью в отношении м 1 — и м 3 -рецепторов по сравнению с м 2 -рецепторами. Это приводит к быстрому развитию терапевтического эффекта после ингаляции, что подтверждено клиническими исследованиями. Бронходилатирующий эффект гликопиррония после ингаляции сохраняется более 24 ч. Продолжительность его действия после ингаляции обусловлена длительным поддержанием терапевтической концентрации препарата в легких, что подтверждается более длительным Т 1/2 препарата после ингаляционного применения, по сравнению с в/в введением.
Индакатерол — селективный бета 2 -адреномиметик ультрадлительного действия (в течение 24 ч при однократном применении). Фармакологическое действие бета 2 -адреномиметиков, включая индакатерол, связано со стимуляцией внутриклеточной аденилатциклазы, фермента, который катализирует превращение АТФ в циклический 3′,5′-АМФ (цАМФ). Повышение содержания цАМФ приводит к расслаблению гладкой мускулатуры бронхов. Индакатерол является практически полным агонистом β 2 -адренорецепторов; стимулирующее действие препарата на β 2 -адренорецепторы в 24 раза сильнее, чем на β 1 -адренорецепторы, и в 20 раз сильнее, чем на β 3 -адренорецепторы. После ингаляции индакатерол оказывает быстрое и продолжительное бронходилатирующее действие. Селективность индакатерола сходна с селективностью формотерола. После ингаляции индакатерол оказывает местное бронходилатирующее действие. В изолированных бронхах человека индакатерол оказывает быстрое и длительное действие.
Фармакокинетика
После ингаляции препарата, содержащего данную комбинацию, среднее время достижения C max гликопиррония бромида и индакатерола в плазме крови составляли 15 мин и 5 мин соответственно.
После ингаляции гликопирроний быстро всасывается и достигает C max в плазме крови через 5 мин. Около 90% системной экспозиции гликопиррония приходится на всасывание в легких, и 10% на всасывание в ЖКТ. Абсолютная биодоступность гликопиррония после ингаляции оценивается в 40% от доставляемой дозы. На фоне регулярных ингаляций (1 раз/сут) C ss гликопиррония бромида достигается в течение 1 недели. Экспозиция гликопиррония в равновесном состоянии была в 1.4-1.7 раз выше, чем после первой ингаляции. C max гликопиррония в равновесном состоянии (при ингаляции в рекомендуемой дозе 1 раз/сут) и концентрация гликопиррония в плазме крови непосредственно перед приемом очередной дозы равны 166 пг/мл и 8 пг/мл соответственно. После в/в введения V ss составил 83 л и V z — 376 л. Кажущийся объем распределения в терминальной фазе после ингаляции (V z /F) составил 7310 л, что отражает более медленное выведение его после ингаляции. In vitro связывание гликопиррония с белками плазмы крови человека составляет 38-41% при концентрации 1-10 нг/мл. Указанные концентрации как минимум 6 раз превышают С mах в равновесном состоянии при применении в дозе 50 мкг 1 раз/сут. In vitro было отмечено, что гидроксилирование гликопиррония приводит к образованию различных моно- и бис-гидроксилированных метаболитов, а прямой гидролиз приводит к образованию производных карбоновой кислоты (M9). Исследования in vitro показали, что изоферменты CYP вносят свой вклад в окислительную биотрансформацию гликопиррония. Гидролиз до M9, по-видимому, катализируется ферментами семейства холинэстераз. Т.к. исследования in vitro не выявили метаболизма действующего вещества в легких, а вклад М9 в циркуляцию был минимальным (4% от C max и AUC гликопиррония) после в/в введения, предполагается, что М9 образуется из фракции действующего вещества, поступившей через ЖКТ после ингаляции путем пресистемного гидролиза и/или при «первом прохождении» через печень. После ингаляции или в/в введения только минимальное количество М9 было обнаружено в моче (≤0.5% введенной дозы). Глюкуроновые и/или сульфатные конъюгаты гликопиррония были обнаружены в моче человека после повторных ингаляций в количестве приблизительно 3% доставляемой дозы. Выведение гликопиррония почками достигает 60-70% общего плазменного клиренса, 30-40% выводится другими путями — с желчью или за счет метаболизма. У здоровых добровольцев и пациентов с ХОБЛ, получавших гликопирроний в дозах от 50 до 200 мкг 1 раз/сут однократно и многократно, средний почечный клиренс гликопиррония составлял от 17.4 до 24.4 л/ч. Выведение гликопиррония почками обусловлено активной канальцевой секрецией. До 23% дозы обнаруживается в моче в неизмененном виде. Концентрация гликопиррония бромида в плазме крови снижается многофазно. Средний конечный Т 1/2 более продолжителен после ингаляции (33-57 ч), чем после в/в (6.2 ч) или перорального введения (2.8 ч). Характер выведения позволяет предположить длительное всасывание абсорбцию в легких и/или проникновение гликопиррония в системный кровоток во время и после 24 ч после ингаляции. У пациентов с ХОБЛ системная экспозиция, а также выведение почками гликопиррония в равновесном состоянии повышались пропорционально дозе в диапазоне от 50 мкг до 200 мкг.
Индакатерол. Среднее время достижения C max индакатерола в сыворотке крови составляет около 15 мин после однократной или повторных ингаляций. Концентрация индакатерола в сыворотке крови повышается при повторном применении препарата 1 раз/сут. C ss вещества в крови достигается в течение 12-15 дней применения препарата. При ингаляции препарата в дозе от 60 до 480 мкг (доза, доставляемая в легкие) с частотой 1 раз/сут в течение 14 дней коэффициент кумуляции индакатерола, оцененный по значению AUC препарата на 1-й и 14-й или 15-й дни, составляет от 2.9 до 3.8. После в/в введения объем распределения в терминальной фазе (V z ) индакатерола составлял 2361-2557 л, что указывает на значительное распределение препарата. Связывание с белками плазмы крови человека in vitro составляет примерно 95%. При приеме внутрь меченого радиоактивным изотопом индакатерола неизмененный индакатерол является основным компонентом сыворотки и составляет приблизительно 1/3 суточной AUC препарата. Из метаболитов индакатерола в сыворотке крови в наибольшей степени определяется гидрокислированное производное индакатерола. В меньшем количестве обнаруживаются фенольный О-глюкуронид индакатерола и гидроксилированный индакатерол. Кроме того, выявляются диастереомеры гидроксилированного производного, N-глюкуронид индакатерола и продукты С- и N-дезалкилирования. Изофермент UGT1A1 является единственным изоферментом, метаболизирующим индакатерол до фенольного О-глюкуронида. Гидроксилирование индакатерола в основном происходит с помощью изофермента CYP3A4. Также установлено, что индакатерол является низкоафинным субстратом для мембранного переносчика молекул Р-гликопротеина (P-gp). Количество неизмененного индакатерола, выделяющегося почками, составляет менее 2.5% от доставляемой дозы. Почечный клиренс индакатерола составлял в среднем 0.46-1.2 л/ч. Учитывая, что сывороточный клиренс индакатерола составляет 18.8-23.3 л/ч, очевидно, что его выведение почками незначительное (приблизительно 2-5% системного клиренса). При приеме внутрь индакатерол выводился в основном через кишечник: в неизмененном виде (54% дозы) и в виде гидроксилированных метаболитов (23% дозы). Концентрация индакатерола в сыворотке крови снижается многофазно со средним значением конечного T 1/2 в диапазоне от 45.5 до 126 ч. Эффективный T 1/2 , рассчитанный на основании кумуляции индакатерола после повторного применения, варьировал от 40 до 52 ч, что согласуется с установленным временем достижения равновесного состояния (12-15 дней). AUC индакатерола в равновесном состоянии повышалась пропорционально доставляемой дозе в диапазоне от 120 до 480 мкг. Системная экспозиция индакатерола увеличивается пропорционально повышению дозы (от 150 до 600 мкг). Системная экспозиция препарата обусловлена его всасыванием как в легких, так и в ЖКТ.
Показания активных веществ препарата Ультибро ® Бризхалер ®
Длительная поддерживающая терапия нарушений бронхиальной проходимости у пациентов с хронической обструктивной болезнью легких, облегчающая симптомы и снижающая количество обострений.
Источник
Ультибро бризхайлер : инструкция по применению
Описание
Капсулы с прозрачной желтой крышечкой и натуральным прозрачным корпусом, с логотипом Новартиса черного цвета на крышечке и надписью «IGP110.50» синего цвета под двумя синими полосами на корпусе.
Состав
Одна капсула содержит 143 мкг индакатерола малеата (эквивалентно 110 мкг индакатерола), и 63 мкг гликопиррония бромида (эквивалентно 50 мкг гликопиррония).
Целевая высвобождаемая доза (доза, доставляемая из мундштука ингалятора) эквивалентна 85 мкг индакатерола и 43 мкг гликопиррония.
Наполнение капсулы: лактозы моногидрат, магния стеарат.
Компоненты оболочки капсулы: гипромеллоза, вода очищенная, каррагинан, калия хлорид, краситель тартразин (Е 102), чернила черные (шеллак, пропиленгликоль, калия гидроксид, вода очищенная, краситель железа оксид черный (Е 172), чернила синие (шеллак, индигокармин (Е 132), титана диоксид, пропиленгликоль).
Поддерживающая бронходилатирующая терапия для облегчения симптомов и снижения частоты обострений у пациентов с хронической обструктивной болезнью легких (ХОБЛ).
Дозы и способ применения
Общая целевая категория пациентов
Рекомендуемая доза Ультибро Бризхайлера принимается путем ингаляции содержимого одной капсулы (110/50 мкг действующих веществ) с использованием ингалятора Бризхайлер 1 раз в сутки.
Особые группы пациентов
Нарушение функции почек
У пациентов с почечной недостаточностью легкой и средней степени тяжести может применяться стандартная рекомендуется доза Ультибро Бризхайлера. У пациентов с почечной недостаточностью тяжелой степени или терминальной стадией почечной недостаточности, требующей проведение гемодиализа, Ультибро Бризхайлер должен применяться только в случае, если предполагаемая польза превышает потенциальный риск. См. также разделы Меры предосторожности и Клиническая фармакология.
Нарушение функции печени
У пациентов с печеночной недостаточностью легкой и средней степени тяжести может применяться стандартная рекомендуется доза Ультибро Бризхайлера. Данных о применении препарата у пациентов с тяжелыми нарушениями функции печени не получено. См. также раздел Клиническая фармакология.
Ультибро Бризхайлер не применяется для лечения детей в возрасте до 18 лет.
Пожилые пациенты (75 лет и старше)
У пожилых пациентов в возрасте 75 лет и старше может применяться стандартная рекомендуется доза Ультибро Бризхайлера.
Капсулы Ультибро Бризхайлер предназначены только для ингаляций через рот с помощью специального устройства — ингалятора Бризхайлер. Капсулы Ультибро Бризхайлер нельзя глотать (см. также раздел Передозировка).
Ингаляцию Ультибро Бризхайлера проводят ежедневно один раз в сутки в одно и то же время дня. В случае пропуска дозы ее необходимо принять как можно быстрее. Пациенты должны быть проинструктированы не принимать более одной дозы препарата в сутки.
Капсулы Ультибро Бризхайлер должны храниться в блистере для защиты от влаги и извлекаться непосредственно перед использованием (см. также раздел Фармацевтическая информация).
Пациентов необходимо инструктировать о том, как правильно применять препарат. Пациентов, у которых не наступает улучшение дыхания, следует спросить, не глотают ли они капсулы вместо того, чтобы использовать их для ингаляции.
Противопоказания
Ультибро Бризхайлер противопоказан пациентам с повышенной чувствительностью к индакатеролу или гликопирронию, которые входят в состав Ультибро Бризхайлер, а также к любому из вспомогательных веществ.
Меры предосторожности
Ультибро Бризхайлер нельзя применять одновременно с лекарственными средствами, содержащими другие бета-адреномиметики длительного действия или М-холиноблокаторы длительного действия — классы лекарственных средств, к которым относятся компоненты препарата Ультибро Бризхайлер (см. раздел Взаимодействия).
В связи с отсутствием данных по применению Ультибро Бризхайлера у больных с бронхиальной астмой, препарат не следует использовать для лечения бронхиальной астмы.
При применении бета2-адреномиметиков длительного действия для лечения бронхиальной астмы возрастает риск возникновения серьезных нежелательных явлений, связанных с бронхиальной астмой, в том числе летального исхода.
Не предназначен для купирования приступов
Ультибро Бризхайлер не предназначен для лечения приступов бронхоспазма.
На фоне применения индакатерола или гликопиррония, которые входят в состав препарата Ультибро Бризхайлер, были зарегистрированы случаи развития реакций гиперчувствительности немедленного типа. Если имеются признаки, свидетельствующие о развитии аллергической реакции, в частности, ангионевротического отека (включает затрудненное дыхание или глотание, отек языка, губ и лица), крапивницы, кожной сыпи, препарат необходимо отменить и подобрать другую терапию.
Как и при применении других ингаляционных препаратов, при использовании Ультибро Бризхайлера могут возникать случаи парадоксального бронхоспазма, потенциально представляющих угрозу для жизни. В случае возникновения парадоксального бронхоспазма Ультибро Бризхайлер должен быть немедленно отменен и назначена другая терапия.
Антихолинергические эффекты, связанные с применением гликопиррония
Как и другие антихолинергические препараты, Ультибро Бризхайлер необходимо использовать с осторожностью у пациентов с закрытоугольной глаукомой или задержкой мочи.
Пациенты должны быть проинформированы о симптоматике, сопутствующей острому приступу закрытоугольной глаукомы, и о необходимости прекратить применение Ультибро Бризхайлера, а также незамедлительно сообщить своему врачу при возникновении любого из этих симптомов.
Пациенты с тяжелым нарушением функции почек
У пациентов с почечной недостаточностью тяжелой степени (расчетная скорость клубочковой фильтрации 30 мл/мин/1,73 м2), включая пациентов с терминальной стадией почечной недостаточности, требующей проведения гемодиализа, лекарственное средство Ультибро Бризхайлер должно применяться только в случае, если предполагаемая польза превышает потенциальный риск (см. раздел Клиническая фармакология). Данные пациенты должны находиться под тщательным наблюдением на предмет появления нежелательных реакций на лекарственное средство.
Системные эффекты бета-адреномиметиков
При применении Ультибро Бризхайлера в рекомендованной дозе клинически значимого влияния на сердечно-сосудистую систему не наблюдается. Тем не менее, у пациентов с сердечно-сосудистыми нарушениями (ишемическая болезнь сердца, острый инфаркт миокарда, сердечные аритмии, артериальная гипертензия), у пациентов с судорожными расстройствами или тиреотоксикозом, а также у пациентов с нестандартной реакцией на бета2-адреномиметики Ультибро Бризхайлер, как и другие препараты, содержащие бета2-адреномиметики, следует применять с осторожностью.
Как и при применении других препаратов, содержащих ингаляционные бета2-адреномиметики, Ультибро Бризхайлер нельзя использовать чаще или в больших дозировках, чем это рекомендуется.
Влияния бета-адреномиметиков на сердечно-сосудистую систему
Как и другие препараты, содержащие бета2-адреномиметики, Ультибро Бризхайлер у некоторых пациентов может оказывать клинически значимое влияние на сердечно-сосудистую систему, что выражается в увеличении частоты сердечных сокращений, артериального давления крови и/или появления другой симптоматики. При появлении таких эффектов может потребоваться отмена препарата. Кроме того, при применении бета2-адреномиметиков могут отмечаться следующие электрокардиографические изменения: уплощение зубца Т, удлинение интервала QT и депрессия сегмента ST. Однако клиническая значимость этих изменений не установлена.
В клинических исследованиях Ультибро Бризхайлера при его применении в рекомендуемых терапевтических дозах значимого удлинения интервала QTc не отмечалось (см. раздел Клиническая фармакология).
Гипокалиемия при применении бета-адреномиметиков
У некоторых пациентов при применении бета2-адреномиметиков может возникать значительная гипокалиемия, приводящая к развитию нежелательных эффектов со стороны сердечно-сосудистой системы. Снижение сывороточного уровня калия обычно является преходящим, и не требует восполнения дефицита калия. У пациентов с ХОБЛ тяжелой степени гипокалиемия может быть усилена за счет гипоксии и сопутствующей терапией (см. раздел Взаимодействия), что, в свою очередь, может повышать вероятность развития сердечных аритмий.
В клинических исследованиях Ультибро Бризхайлер при применении препарата в рекомендуемых терапевтических дозах клинически значимых эффектов в виде гипокалиемии не наблюдалось (см. раздел Клиническая фармакология).
Гипергликемия при применении бета-адреномиметиков
При ингаляции высоких доз бета2-адреномиметиков возможно повышение уровня глюкозы в плазме крови. У пациентов с сахарным диабетом при начале терапии Ультибро Бризхайлером следует чаще контролировать концентрацию глюкозы в плазме крови.
Побочное действие
Профиль безопасности Ультибро Бризхайлера основан на опыте применения как самого препарата, так и его отдельных компонентов при монотерпии.
Резюме профиля безопасности
Данные о безопасности Ультибро Бризхайлера основаны на опыте применения препарата в течение периода до 15 месяцев в рекомендуемой терапевтической дозе (110/50 мкг).
Программа клинической разработки Ультибро Бризхайлера III фазы включала 11 исследований и охватывала выборку из более 10000 пациентов с клиническим диагнозом ХОБЛ от умеренной до очень тяжелой степени выраженности. Данные о безопасности, полученные в девяти из этих исследований с длительностью терапии 4 недель и более, были объединены в общий пул с включением 4352 пациентов, получавших Ультибро Бризхайлер в дозе 110/50 мкг один раз в сутки.
Профиль безопасности характеризовался типичными антихолинергическими и бета-адренергическими симптомами, обусловленными действием отдельных компонентов, входящих в состав данного комбинированного препарата. Другими наиболее частыми нежелательными реакциями на препарат, связанными с применением данного лекарственного препарата (≥ 3% и более чем плацебо) были головная боль, назофаригит.
Профиль нежелательных реакций у пациентов с ХОБЛ при ингаляции Ультибро Бризхайлера в рекомендованных дозах включал клинически незначимые системные бета2-адреномиметические эффекты. Средняя частота сердечных сокращений изменялась менее чем на один удар в минуту, а тахикардия развивалась нечасто и с меньшей частотой, чем в группе применения плацебо. Частота развития значимого удлинения интервала QTcF была сходной с таковой в группе применения плацебо. Частота заметного удлинения интервалов QTcF (>450 мс) и частота сообщений о гипокалиемии были такими же, как и в группе плацебо.
Табличная сводка нежелательных реакций на препарат, наблюдаемых в клинических исследованиях
Нежелательные реакции на лекарственное средство перечислены в соответствии с системно органными классами (таблица 7-1). Частота нежелательных реакций основана на трех сгруппированных фазы III плацебо-контролируемых исследованиях продолжительностью 6 и 12 месяцев. Соответствующая категория частоты для каждой нежелательной реакции на препарат, определяется по следующим правилам (CIOMS III): очень частые (≥ 1/10), частые (≥ 1/100 до
Фармакотерапевтическая группа
Фармакотерапевтическая группа: адренергические средства в комбинации с антихолинергическими.
Код ATX: R03AL04.
Индакатерол и гликопирроний при их совместном применении в составе препарата Ультибро Бризхайлер оказывают взаимно усиливающийся эффект, благодаря тому, что они обладают разными механизмами действия, воздействуя на разные рецепторы и пути, и обеспечивая расслабление гладкой мускулатуры. Вследствие различий в плотности распределения бета2-адренорецепторов и М3-рецепторов в центральных и периферических отделах дыхательных путей, бета2-адреномиметики более эффективно расслабляют дистальные отделы дыхательных путей (меньшего калибра), а антихолинергический компонент более эффективно воздействует на проксимальные (большего калибра) отделы дыхательных путей. Таким образом, для оптимальной бронходилатации во всех отделах дыхательных легких у человека, наиболее оптимальным путем может быть использование комбинации бета2-адреномиметика и блокатора мускариновых холинорецепторов.
Индакатерол является бета2-адреномиметиком ультра-длительного действия, предназначенным для приема один раз в сутки. Фармакологические эффекты бета2-адреномиметиков, включая индакатерол, как минимум частично связаны со стимуляцией внутриклеточной аденилатциклазы, фермента, который катализирует превращение аденозинтрифосфата (АТФ) в циклический 3′,5′-аденозинмонофосфат (циклический монофосфат). Повышение содержания циклического АМФ приводит к расслаблению гладкой мускулатуры бронхов. Исследования in vitro показали, что стимулирующее действие индакатерола на бета2-адренорецепторы в 24 раза сильнее, чем на бета1-адренорецепторы, и в 20 раз сильнее, чем на бета3-адренорецепторы. Схожим профилем селективности обладает формотерол.
После ингаляции индакатерол оказывает местное бронходилатирующее действие в легких. Индакатерол является практически полным агонистом бета2-адренорецепторов человека, и оказывает эффекты, достигая наномолярных концентраций. В изолированных бронхах человека индакатерол оказывает быстрое и продолжительное действие.
Бета2-адренорецепторы доминируют среди адренорецепторов в гладкомышечных клетках бронхов, а в сердце у человека доминируют бета1-адренорецепторы. Тем не менее, в сердце человека бета1-адренорецепторы могут достигать 10% — 50% от общего числа адренорецепторов. Точная функция бета2-адренорецепторов в сердце не установлена, однако их присутствие создает вероятность того, что даже высокоселективные бета2-адреномиметики будут оказывать влияние на сердце.
Гликопирроний представляет собой ингаляционный м-холиноблокаторов (антихолинергическое средство) длительного действия, предназначенный для поддерживающей бронходилатационной терапии с применением один раз в сутки у пациентов с хронической обструктивной болезнью легких (ХОБЛ). Парасимпатические нервы в дыхательных путях представляют собой основной нервный путь, отвечающий за бронхоконстрикцию, а холинергический тонус является ключевым обратимым компонентом обструкции дыхательных путей при ХОБЛ. Действие гликопиррония опосредовано блокадой бронхоконстрикторного действия ацетилхолина на гладкомышечные клетки дыхательных путей, что приводит к бронходилатирующему эффекту.
В организме человека выявлено 5 подтипов мускариновых рецепторов (М1-5). Известно, что в легких у человека только подтипы М1-3 обладают определенной физиологической функцией. Гликопиррония бромид является блокатором мускариновых рецепторов, который обладает высокой аффинностью именно к рецепторам данных трех подтипов. В исследованиях конкурентного связывания было установлено, что гликопиррония бромид обладает в 4-5 раз большей селективностью в отношении Ml и М3 подтипов рецепторов человека, по сравнению с М2 подтипом рецепторов человека. Он обеспечивает быстрое возникновение эффекта, что констатировано на основании наблюдаемых кинетических параметров связывания и диссоциации с рецепторами, а также на основании результатов клинических исследований с ингаляционным применением препарата.
Большая продолжительность действия препарата может быть частично обусловлена длительным поддержанием терапевтической концентрации препарата в легких, что подтверждается более длительным терминальным периодом полувыведения гликопиррония после его ингаляционного применения с помощью специального ингалятора гликопиррония, по сравнению с внутривенным введением (см. раздел Клиническая фармакология — выведение). Фармакокинетические параметры, наблюдаемые в легких крыс после ингаляции гликопиррония бромида, также доказывают данную точку зрения.
Основные фармакодинамические эффекты
Эффект комбинации индакатерола и гликопиррония в препарате Ультибро Бризхайлер наступает быстро — в течение 5 минут после применения (см. табл. 12-2). Данный эффект сохраняется на постоянном уровне на протяжении 24-х часового интервала дозирования (см. рис. 12-1 и 12-2).
Средний эффект бронходилатации, наблюдаемый по результатам измерения объема форсированного выдоха за первую секунду (ОФВ1) на 26 неделе терапии, выражался в повышении данного показателя в среднем на 0,32 л по сравнению с пациентами, получавшими плацебо, и на 0,11 л по сравнению с пациентами, получавшими отдельно индакатерол, гликопиррония бромид или тиотропиума бромид (разница 0,11 л, для каждого сравнения) (серия спирометрических тестов).
В течение периода терапии признаков тахифилаксии к Ультибро Бризхайлеру по сравнению с плацебо, а также по сравнению с отдельными компонентами препарата, не наблюдалось.
Вторичные Фармакодинамические эффекты
Системные побочные эффекты ингаляционной терапии с применением бета2-адреномиметиков и блокаторов мускариновых холинорецепторов являются результатом активации системных бета2-адренорецепторов и блокады мускариновых холинорецепторов после системной абсорбции препаратов. Профиль побочных эффектов Ультибро Бризхайлера исследовался на здоровых пациентах и на пациентах, страдающих ХОБЛ.
Влияние на частоту сердечных сокращений
Влияния на частоту сердечных сокращений у здоровых добровольцев исследовали посредством применения одной дозы Ультибро Бризхайлера 440/200 мкг, которую применяли в четыре этапа с интервалом один час между приемами, и сравнивали с плацебо, 600 мкг индакатерола, 200 мкг гликопиррония и 200 мкг сальметерола.
Максимальное, скорректированное по времени увеличение частоты сердечных сокращений при применении Ультибро Бризхайлера по сравнению с плацебо составило +5,69 ударов в минуту, а максимальное снижение составило -2,51 ударов в минуту. В целом, влияние на частоту сердечных сокращений в динамике по времени не свидетельствовало о наличии стойкого фармакодинамического эффекта Ультибро Бризхайлера.
При сравнении Ультибро Бризхайлера с индакатеролом и гликопирронием по отдельности значимого эффекта на частоту сердечных сокращений не наблюдалось, тем не менее после ингаляции 200 мкг сальматерола она несколько возрастала (максимальная разница составляла 11 ударов в минуту).
Частота сердечных сокращений у пациентов с ХОБЛ исследовалась при применении доз Ультибро Бризхайлера, превышавших терапевтические и достигавших 150/100, 300/100 и 600/100 мкг. Значимых влияний Ультибро Бризхайлера на среднюю частоту сердечных сокращений в течение 24 часов и частоту сердечных сокращений, измеренную через 30 минут, 4 часа и 24 часа, не выявлено.
Компоненты препарата Ультибро Бризхайлер (индакатерол и гликопирроний) в клинических дозах не обладают способностью удлинять QT-интервал. Детальное исследование интервала QT (исследование TQT) у здоровых добровольцев при ингалируемых дозах индакатерола, достигающих 600 мкг, не выявило клинически значимого влияния на интервал QT. В исследовании TQT также и при ингаляционном применении гликопиррония в дозе 400 мкг не наблюдалось удлинения интервала QT.
Влияние Ультибро Бризхайлера на интервал QTc исследовали на здоровых добровольцах после ингаляции препарата в дозе 440/200 мкг, разделенных на 4 приема с интервалами между приемами в один час. Наибольшая скорректированная по времени разница по отношению к плацебо составляла 4,62 мс (90% ДИ 0,40, 8,85 мс), наибольшее скорректированное по времени снижение составляло -2,71 мс (90% ДИ -6,97, 1,54 мс), что доказывало отсутствие значимого влияния Ультибро Бризхайлера на интервал QT, как это ожидалось на основании данных о свойствах отдельных компонентов, входящих в состав данного препарата.
У пациентов ХОБЛ Ультибро Бризхайлер в дозах до 600/100 мкг также не оказывал значимого влияния на интервал QTc при многократных оценках ЭКГ, выполненных в период с 15 минуты до 24 часа после приема препарата. В группе пациентов, у которых Ультибро Бризхайлер применялся в дозе 600/100 мкг, у несколько большей доли участников наблюдалось удлинение интервала QTc свыше 450 мс. Чисто заметных изменений интервала QTcF в сравнении с исходным этапом (>30 мс) было схожим во всех группах активной терапии (Ультибро Бризхайлер 600/100 мкг, 300/100 мкг, 150/100 мкг и индакатерол 300 мкг), но при этом было ниже в группе плацебо.
Уровень калия в сыворотке крови и уровень глюкозы в крови
У здоровых добровольцев после применения Ультибро Бризхайлер в дозе 440/200 мкг, влияние на уровень калия в сыворотке крови был крайне мал (максимальная разница -0,14 ммоль/л по сравнению с плацебо). Максимальный эффект на уровень глюкозы в крови составлял 0,67 ммоль/л. При сравнении Ультибро Бризхайлера в дозе 440/200 мкг с сальметеролом в дозе 200 мкг, влияние первого на уровень калия в сыворотке крови (максимальная разница 0,21 ммоль/л) и уровень глюкозы в крови было меньшим (максимальная разница соответственно 0,21 и 1,19 ммоль/л).
После ингаляции Ультибро Бризхайлера среднее время достижения максимальных концентраций в плазме крови индакатерола и гликопиррония бромида в плазме крови составляли 15 минут и 5 минут соответственно.
По данным исследования in vitro, в котором изучали эффективность ингаляции, доза индакатерола, доставляемая в легкие при применении Ультибро Бризхайлера 110/50 мкг, соответствует дозе, доставляемой при применении индакатерола в отдельности. Экспозиция индакатерола в равновесном состоянии при ингаляционном применении Ультибро Бризхайлера 110/50 мкг соответствует или может быть незначительно ниже системной экспозиции при ингаляции индакатерола в дозе 150 мкг в отдельности.
Абсолютная биодоступность индакатерола при применении Ультибро Бризхайлера 110/50 мкг составляет от 47% до 66%, гликопиррония — около 40%.
Экспозиция гликопиррония в равновесном состоянии при ингаляционном применении Ультибро Бризхайлера в дозе 110/50 мкг соответствует системной экспозиции при ингаляции гликопиррония в дозе 50 мкг в отдельности.
Медиана времени достижения пиковой концентрации индакатерола в сыворотке крови составляет около 15 мин после однократной или повторных ингаляций.
Концентрация индакатерола в сыворотке крови повышается при повторном применении препарата один раз в сутки. Равновесное состояние достигалось в течение 12-15 дней. При ингаляции препарата в дозе от 75 до 600 мкг (доза, доставляемая в легкие) с частотой 1 раз в сутки в течение 14 дней средний коэффициент кумуляции индакатерола, оцененный по значению площади под кривой «концентрация-время» (AUC) препарата в течение 24 часов на 14-й или 15-й дни по сравнению с 1 днем,
составляет от 2,9 до 3,8.
После ингаляции через рот с помощью ингалятора гликопирроний быстро абсорбируется и достигает пиковых концентраций в плазме крови через 5 минут после применения.
Около 90% системной экспозиции гликопиррония бромида обусловлено абсорбцией в легких, и 10% — абсорбцией в желудочно-кишечном тракте. Абсолютная биодоступность гликопиррония после его приема внутрь согласно оценкам составляет примерно 5%.
На фоне регулярных ингаляций один раз в сутки равновесное фармакокинетическое состояние гликопиррония у пациентов с ХОБЛ достигается в течение одной недели терапии. Равновесные средние максимальные и минимальные концентрации гликопиррония в плазме крови при его приеме один раз в сутки в дозе 50 мкг составляли соответственно 166 пкг/мл и 8 пкг/мл. При приеме один раз в сутки доз по 100 и 200 мкг, равновесная экспозиция гликопиррония (показатель AUC в течение интервала дозирования) была примерно в 1,4-1,7 раз выше, таковой, достигаемой после первого приема препарата. Данные о выделении с мочой в равновесном состоянии по сравнению с условиями после приема первой дозы свидетельствует о том, что в диапазоне применяемых доз 25-200 мкг системное накопление препарата не зависит от дозы.
После внутривенной инфузии объем распределения (Vz) индакатерола составлял от 2361 до 2557 л, что указывает на широкое распределение данного вещества. В условиях in vitro связывание с белками сыворотки крови и связывание с белками плазмы крови составляло соответственно 94,1-95,3% и 95,1-96,2%.
После внутривенного введения равновесный объем распределения (Vss) гликопиррония составлял 83 л, а объем распределения в терминальной фазе (Vz) составлял 376 л. Кажущийся объем распределения в терминальной фазе после ингаляционного приема (Vz/F) составлял 7310 л, что отражает наличие значительно более медленной элиминации вещества после его ингаляционного приема. В условиях in vitro связывание гликопиррония с белками плазмы крови составляло примерно 38% — 41% при концентрациях от 1 до 10 нг/мл. Эти концентрации были как минимум в 6 раз выше, чем равновесные средние пиковые уровни, достигаемые в плазме крови при режиме дозирования 50 мкг один раз в сутки.
В исследовании ADME (абсорбция, распределение, метаболизм, выведение) при приеме внутрь меченого радиоактивным изотопом индакатерола неизмененный индакатерол являлся основным компонентом сыворотки и в течение 24 часов составлял приблизительно 1/3 от суточного показателя AUC данного вещества. Из метаболитов индакатерола в сыворотке крови в наибольшей степени определяется гидрокислированное производное индакатерола. Другие преобладающие метаболиты также были представлены фенольными О-глюкуронидами индакатерола и гидроксилированным индакатеролом. Кроме того, выявляются диастереомеры гидроксилированного производного, N-глюкуронид индакатерола и продукты С- и N-дезалкилирования.
Исследования in vitro показали, что UGT1A1 является единственной изоформой уридин-дифосфат глюкуронил трансферазы (УДФ, UGT), которая участвует в метаболизме индакатерола с формированием фенольного О-глюкуронида. При инкубации с рекомбинантными изоферментами CYP1A1, CYP2D6 и CYP3A4 обнаружены окисленные метаболиты. Установлено, что CYP3A4 является доминирующим изоферментом, ответственным за гидроксилирование индакатерола. Исследования in vitro также показали, что индакатерол является субстратом с низким сродством для выводящего насоса Р-гликопротеина (P-gp).
Исследования метаболизма в условиях in vitro показали наличие одинаковых метаболических путей для гликопиррония бромида у человека и животных. Специфических метаболитов, свойственных только для человека не обнаружено. Было отмечено, что гидроксилирование гликопиррония бромида приводит к образованию различных моно- и бис-гидроксилированных метаболитов, а прямой гидролиз приводит к образованию производных карбоновой кислоты (М9).
Исследования in vitro показали, что в окислительную биотрансформацию гликопиррония свой вклад вносит целый ряд изоферментов CYP. Гидролиз до М9, по-видимому, катализируется ферментами семейства холинэстераз.
После ингаляции системная экспозиция М9 в среднем достигала такого же порядка, как и экспозиция исходного вещества. Так как исследования in vitro не выявили метаболизма действующего вещества в легких, и М9 вносит незначительный вклад в циркуляцию (4% от Сmах и AUC исходного вещества) после внутривенного введения, предполагается, что М9 образуется из абсорбируемой из ЖКТ (после ингаляции) фракции действующего вещества путем пресистемного гидролиза и/или при первом прохождении через печень. После ингаляции или внутривенного введения только минимальное количество М9 было обнаружено в моче (≤ 0,5% введенной дозы). Глюкуроновые и/или сульфатные конъюгаты гликопиррония были обнаружены в моче человека после повторных ингаляций в количестве приблизительно 3% от принятой дозы.
Исследования ингибирования in vitro показали, что гликопиррония бромид не обладает значимой способностью подавлять активность изоферментов CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 или CYP3A4/5, транспортных белков MDR1, MRP1 или MXR, опосредующих выведение лекарственных препаратов из клеток, а также белков-переносчиков ОАТР1В1, ОАТР1В3, ОАТ1, ОАТ3, ОСТ1 или ОСТ2. Исследования индукции ферментов in vitro не выявили у гликопиррония бромида клинически значимой способности индуцировать любой из исследованных изоферментов цитохрома Р450, фермент UGT1A1 и белки-переносчики MDR1 и MRP2.
В клинических исследованиях, в которых осуществлялся сбор мочи, количество экскретируемого с мочой в неизмененном виде индакатерола составляло в целом менее 2% от всей принятой дозы. Почечный клиренс индакатерола составлял в среднем 0,46-1,2 л/ч. Учитывая, что сывороточный клиренс индакатерола составляет 18,8-23,3 л/ч, очевидно, что выведение препарата через почки играет незначительную роль (приблизительно 2-6% системного клиренса) в выведении индакатерола из системной циркуляции.
В исследовании ADME на людях, где индакатерол принимался внутрь, фекальный путь выведения преобладал над путем выведения с мочой. У человека индакатерол выводился с калом преимущественно в неизмененном виде (54% от принятой дозы) и, в меньшей степени выводился в виде гидроксилированных метаболитов индакатерола (23% от дозы). Баланс по массе достигался при экскреции ≥ 90% дозы.
Концентрация индакатерола в сыворотке крови снижается многофазно со средним значением конечного периода полувыведения в диапазоне от 45,5 до 126 ч. Эффективный период полувыведения, рассчитанный на основании кумуляции индакатерола после повторного применения, варьировал от 40 до 56 ч, что согласуется с наблюдаемым временем достижения равновесного состояния (равного примерно 12-15 дней).
После внутривенного введения людям [3Н]-меченного гликопиррония бромида средняя величина выведения радиоактивности с мочой в течение 48 часов достигала 85% от общей дозы. Еще 5% от дозы обнаруживалось в желчи. Таким образом, баланс масс был практически полным.
Выведение исходного вещества почками достигает 60-70% от общего плазменного клиренса системно доступного гликопиррония, 30-40% выводится другими неренальными путями. Билиарный клиренс также участвует в непочечном выведении вещества, однако, полагается, что основная часть непочечного клиренса обусловлена метаболизмом.
У здоровых добровольцев и пациентов с ХОБЛ, одно- и многократно получавших ингаляции гликопиррония в дозах от 50 до 200 мкг один раз в сутки, средний почечный клиренс гликопиррония составлял от 17,4 до 24,4 л/ч. Выведение гликопиррония бромида через почки обусловлено активной канальцевой секрецией. До 20% от дозы обнаруживается в моче в неизмененном виде.
Концентрация гликопиррония в плазме крови снижается многофазно. Средний конечный период полувыведения более продолжителен после ингаляции (33-57 ч), чем после внутривенного (6,2 ч) или перорального введения (2,8 ч). Характер выведения позволяет предположить длительную абсорбцию в легких и/или проникновение гликопиррония бромида в системный кровоток во время и после 24 ч после ингаляции.
Системная экспозиция индакатерола возрастала по мере повышения его дозы (от 150 мкг до 600 мкг) пропорционально дозе. Системная экспозиция достигается в результате всасывание вещества в легких и в кишечнике.
У пациентов с ХОБЛ AUC, а также общая экскреция почками гликопиррония бромида в равновесном состоянии повышалась пропорционально дозе в диапазоне от 50 мкг до 200 мкг.
Особые группы пациентов
Популяционный фармакокинетический анализ среди пациентов с ХОБЛ показал, что возраст, пол и масса тела (безжировая) не оказывают существенного влияния на системную экспозицию индакатерола и гликопиррония. Было установлено, что безжировая масса тела (которая определяется по массе тела и росту) является независимой переменной. Выявлена отрицательная корреляция между системной экспозицией и безжировой массой тела (или массой тела), однако, поскольку системная экспозиция изменялась незначительно, а прогностическая ценность безжировой массы тела невелика, не рекомендуется корректировать дозу в зависимости от этого параметра.
Курение и исходные показатели ОФВ1 не оказывают видимого влияния на системную экспозицию индакатерола и гликопиррония при ингаляционном применении препарата Ультибро Бризхайлер.
Популяционный анализ влиянии возраста, пола и массы тела на системную экспозицию у пациентов с ХОБЛ после ингаляции препарата показал, что индакатерол можно применять в рекомендуемой дозе у пациентов всех возрастов с любой массой тела, независимо от пола. Фармакокинетические характеристики индакатерола исследовали среди лиц с двумя разными генотипами UGT1A1 — полностью функциональным [(ТА)6, (ТА)6] генотипом и генотипом с низкой активностью [(ТА)7, (ТА)7] (Генотип при синдроме Жильбера). В исследовании было показано, что показатели AUC и Сmах индакатерола в равновесном состоянии были в 1,2 раза выше при генотипе [(ТА)7, (ТА)7], что говорит лишь о незначительном изменении экспозиции индакатерола в результате такой генотипической вариации UGT1A1.
Результаты популяционного фармакокинетического анализа данных среди пациентов с ХОБЛ выявили, что масса тела и возраст являются факторами, обусловливающими различия системной экспозиции у разных пациентов. Гликопирроний в дозе 50 мкг один раз в сутки можно использовать в рекомендуемой дозе у пациентов в любом возрасте и с любой массой тела.
Пол, курени и исходный показатель ОФВ1 не оказывали заметного влияния на системную экспозицию.
Нарушение функции печени
Исходя из клинических фармакокинетических свойств каждого из компонентов, применяемых по отдельности, Ультибро Бризхайлер можно применять в рекомендуемой дозе пациентам с легкими и средней степени нарушениями функции печени. Данные по применению препарата у пациентов с тяжелыми нарушениями функции печени отсутствуют.
У пациентов с легкими и средней степени тяжести нарушениями функции печени значимых изменений показателей Сmах или AUC индакатерола не наблюдалось, также не наблюдалось изменений связывания с белками плазмы крови по сравнению со здоровыми контрольными лицами. Применение препарата у пациентов с тяжелыми нарушениями функции печени не изучалось.
Клинических исследований среди пациентов с печеночной недостаточностью не проводили. Выведение гликопиррония бромида происходит главным образом за счет экскреции почками (см. раздел Клиническая фармакология — выведение). Предполагается, что ухудшение метаболизма гликопиррония в печени не приведет к клинически значимому повышению системной экспозиции.
Нарушение функции почек
Исходя из фармакокинетических свойств каждого из компонентов, применяемых по отдельности, Ультибро Бризхайлер можно применять в рекомендуемой дозе пациентам с легкими и средней степени тяжести нарушениями функции почек. У пациентов с тяжелыми нарушениями функции почек или с терминальной стадией хронической почечной недостаточности, требующей гемодиализа, Ультибро Бризхайлер следует применять лишь в том случае, если ожидаемая польза превышает возможный риск.
Поскольку индакатерол выводится почками в незначительной степени, фармакокинетика препарата у пациентов с нарушениями функции почек не изучалась.
Почечная недостаточность влияет на системную экспозицию гликопиррония. Умеренное среднее повышение общей системной экспозиции (AUC) до 1,4 раз наблюдалось у пациентов с почечной недостаточностью легкой и средней степени тяжести, и до 2,2 раз у пациентов с почечной недостаточностью тяжелой степени и терминальной стадией. Использование популяционного фармакокинетического анализа позволило сделать вывод, что у пациентов с ХОБЛ с сопутствующей почечной недостаточностью легкой и средней степени тяжести (оцениваемой по скорости клубочковой фильтрации (СКФ) ≥ 30 мл/мин/1,73 м2), гликопирроний может применяться в рекомендуемых дозах.
Раса/ Этническая принадлежность
После коррекции на массу тела статистически значимого влияния этнической принадлежности (сравнили Японцев с другими этническими группами) на экспозицию обоих действующих веществ препарата выявлено не было.
Никаких различий в зависимости от этнической принадлежности не выявлено. Опыт применения препарата у чернокожих лиц ограничен.
Значимых различий в рамках общей системной экспозиции (AUC) между Японцами и Европеоидной расой не выявлено. В отношении других этнических групп и рас получено недостаточно данных о фармакокинетике.
Срок годности
2 года. Препарат нельзя использовать после окончания срока годности.
Источник




