- Промышленный методы получения уксусной кислоты
- История открытия уксусной кислоты, основные характеристики, производство и применение. Основные способы получения уксусной кислоты, технологический процесс производства уксусной кислоты окислением ацетальдегида, получение из метанола и оксида углерода.
- Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
- Уксусная кислота
- Содержание
- История
- Физические свойства
- Получение
- В промышленности
- Окислительные методы
- Каталитическое карбонилирование метанола
- Биохимический способ производства
- Химические свойства
- Применение
- Безопасность
Промышленный методы получения уксусной кислоты
История открытия уксусной кислоты, основные характеристики, производство и применение. Основные способы получения уксусной кислоты, технологический процесс производства уксусной кислоты окислением ацетальдегида, получение из метанола и оксида углерода.
| Рубрика | Химия |
| Вид | курсовая работа |
| Язык | русский |
| Дата добавления | 19.04.2012 |
| Размер файла | 173,0 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Уксусная кислота — первая из органических кислот, которая стала известна человеку. Впервые она была получена И. Глаубером в 1648 г. и в концентрированном виде путем вымораживания ее водных растворов и разложением ацетата кальция серной кислотой Г. Шталем в 1666—1667 гг. Элементный состав уксусной кислоты был установлен Я. Берцелиусом в 1814 г. До начала XIX века уксусную кислоту производили исключительно из природного сырья: пирогенетической обработкой древесины и окислительным уксуснокислым брожением пищевого этанола. В настоящее время производство уксусной кислоты из лесохимического сырья имеет второстепенное значение, хотя масштабы его измеряются сотнями тысяч тонн. В этом методе уксусную кислоту выделяют из сконденсированной части парообразных продуктов термической обработки древесины (жижки), получаемой в процессе углежжения. Выход кислоты составляет около 20 кг на 1 м 3 древесины.
Биохимический метод производства уксусной кислоты используют только для производства натурального пищевого уксуса.
Появление синтетических методов производства уксусной кислоты связано с разработкой и промышленной реализацией реакции получения ацетальдегида по Кучерову. В1910—1911 гг. патентуется способ производства уксусной кислоты окислением ацетальдегида, а в годы первой мировой войны в Германии и Канаде по этому методу было организовано промышленное производство. С некоторыми технологическими изменениями этот метод сохранил свое значение и в течение более пятидесяти лет является одним из основных.
Уксусная кислота была единственной, которую знали древние греки.
Отсюда и ее название: «оксос» — кислое, кислый вкус. Уксусная кислота это простейший вид органических кислот, которые являются неотъемлемой частью растительных и животных жиров. В небольших концентрациях она присутствует в продуктах питания и напитках и участвует в метаболических процессах при созревании фруктов. Уксусная кислота часто встречается в растениях, в выделениях животных. Соли и эфиры уксусной кислоты называются ацетатами.
1. Аналитический обзор
Уксусная кислота — слабая (диссоциирует в водном растворе только частично). Тем не менее, поскольку кислотная среда подавляет жизнедеятельность микроорганизмов, уксусную кислоту используют при консервировании пищевых продуктов, например, в составе маринадов.
Получают уксусную кислоту окислением ацетальдегида и другими методами, пищевую уксусную кислоту уксуснокислым брожением этанола. Применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетата целлюлозы), в виде столового уксуса при изготовлении приправ, маринадов, консервов. Уксусная кислота участвует во многих процессах обмена веществ в живых организмах. Это одна из летучих кислот, присутствующая почти во всех продуктах питания, кислая на вкус и главная составляющая уксуса. Строение уксусной кислоты заинтересовало химиков со времени открытия Дюма трихлоруксусной кислоты, так как этим открытием был нанесен удар господствовавшей тогда электрохимической теории Берцелиуса. Последний, распределяя элементы на электроположительные и электроотрицательные, не признавал возможности замещения в органических веществах, без глубокого изменения их химических свойств, водорода (элемента электроположительного) хлором (элементом электроотрицательным), а между тем по наблюдениям Дюма («Comptes rendus» Парижской академии, 1839) оказалось, что «введение хлора на место водорода не изменяет совершенно внешних свойств молекулы почему Дюма и задается вопросом «покоятся ли электрохимические воззрения и представления о полярности, приписываемой молекулам (атомам) простых тел, на столь ясных фактах, чтобы их можно было считать предметами безусловной веры; если же их должно рассматривать как гипотезы, то подходят ли эти гипотезы к фактам? Должно признать, продолжает он, что дело обстоит иначе.
Берцелиусу пришлось допустить возможность замещения водорода хлором без изменения химической функции первоначального тела, в котором происходить замещение. Не останавливаясь на приложении его воззрений к другим соединениям, переходим к работам Кольбе, который для уксусной кислоты, а затем и для других предельных одноосновных кислот нашел ряд фактов, гармонировавших со взглядами Берцелиуса (Жерара). Исходной точкой для работ Кольбе послужило изучение кристаллического вещества, состава CCl4SO2, полученного ранее Берцелиусом и Марсэ при действии царской водки на CS2 и образовавшегося у Кольбе при действии на CS2 влажного хлора. При действии света и хлора на C2Cl4, находившийся под водою, Кольбе получил на ряду с гексахлорэтаном и трихлоруксусную кислоту и выразил превращение таким уравнением: (Так как С2Сl4 может быть получен из CCl4 при пропускании его через накаленную) трубку, а ССl4 образуется при действии, при нагревании, Cl2 на CS2 то реакция Кольбе была первым по времени синтезом уксусной кислоты из элементов.
Работами Кольбе строение уксусной кислоты, а вместе с тем и всех других органических кислот было окончательно выяснено и роль последующих химиков свелась только к делению — в силу теоретических соображений и авторитета Жерара, формул Кольбе пополам и к переведению их на язык структурных воззрений, благодаря чему формула C2H6.C2O4H2 превратилась в CH3CO(OH).
Мировое производство уксусной кислоты составляет в настоящее время свыше 3,5 млн. т в год, в нашей стране в 1980 г. было произведено 250 тыс. т. Основная масса уксусной кислоты производится из ацетальдегида, окислением бутановой и бензиновой фракций.
Первая установка по производству синтетической уксусной кислоты каталитическим окислением ацетальдегида была пущена на Чернореченском химическом заводе в 1932 г., а в 1948 г. было организовано ее промышленное производство. К 60-м годам уксусная кислота производилась также пиролизом ацетона через кетен, окислением узких фракций бензина, а также выделением из продуктов окисления твердого парафина. В результате развития синтетических методов производства уксусной кислоты удельный вес их вырос с 50% в 1963 г. до 70% в 1965 г. и до 90% в 1970 г. За эти же годы общий объем производства уксусной кислоты в стране вырос в три раза.
В 1963 г. были введены в строй новые предприятия по совместному производству уксусной кислоты и уксусного ангидрида каталитическим окислением ацетальдегида в жидкой фазе и к 1965 г. производство уксусной кислоты этим методом составляло уже 17% от общего объема ее производства в стране. В эти же годы было освоено в промышленном масштабе производство уксусной кислоты карбонилированием метанола.
1.1 Теоретические сведения об уксусной кислоте
Карбоновые кислоты — органические соединения, содержащие одну или несколько карбоксильных групп — СООН, связанных с углеводородным радикалом. Карбоксильная группа сочетает в себе две функциональные группы — карбонил и гидроксил, взаимно влияющие друг на друга: кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О-Н.
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.
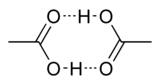
Уксусная кислота (этановая кислота) представляет бесцветную жидкость с резким запахом, с температурой кипения 118,1°С, температурой плавления 16,75°С и плотностью 1,05 т/м3. Безводная, так называемая «ледяная» уксусная кислота образует за счет водородных связей димер циклического строения.
Критическая температура составляет 321,6°С. Уксусная кислота смешивается во всех отношениях с этанолом, диэтиловым эфиром, бензолом и другими органическими растворителями и с водой. Растворяет некоторые неорганические и органические вещества, например, серу, фосфор, ацетаты целлюлозы. С воздухом уксусная кислота образует взрывчатые смеси с пределами воспламенения от 3,3 до 22,0% об. Температура вспышки равна 34°С, температура самовоспламенения 354°С.
Уксусная кислота слабая. Константа ее диссоциации 1,75*10-5. Образует многочисленные растворимые в воде соли (ацетаты) и этерифицируется спиртами с получением сложных эфиров. Уксусная кислота обладает высокой коррозионной активностью по отношению ко многим металлам, особенно в парах и при температуре кипения, что необходимо учитывать при выборе материалов для аппаратуры. В ледяной кислоте стойки как на холоду, так и при температуре кипения, алюминий, кремнистый и хромистый чугуны, некоторые сорта нержавеющей стали, но разрушается медь. Техническая уксусная кислота обладает большей коррозионной активностью, которая усиливается в контакте с воздухом. Из неметаллических материалов стойки по отношению к уксусной кислоте специальные сорта керамики и эмали, кислотоупорные цементы и бетоны и некоторые виды полимерных материалов (полихлорвиниловые и фенолальдегидные пластмассы). Ингибитор коррозии в растворах уксусной кислоты — перманганат калия.
В парах уксусная кислота обладает раздражающим действием на дыхательные пути, ПДК для нее составляет 5 мг/м3.
Синтетическая пищевая уксусная кислота — легковоспламеняющаяся жидкость, по степени воздействия на организм относится к веществам 3-го класса опасности. При работе с уксусной кислотой следует применять индивидуальные средства защиты (фильтрующие противогазы). Первая помощь при ожогах — обильное промывание водой.
Синтетическую пищевую уксусную кислоту заливают в чистые железнодорожные цистерны, автоцистерны с внутренней поверхностью из нержавеющей стали, в контейнеры, емкости и бочки из нержавеющей стали вместимостью до 275 дм 3 , а также в стеклянные бутыли и полиэтиленовые бочки вместимостью до 50 дм 3 . Полимерная тара пригодна для залива и хранения уксусной кислоты в течение одного месяца. Синтетическую пищевую уксусную кислоту хранят в герметичных резервуарах из нержавеющей стали. Контейнеры, емкости, бочки, бутыли и полиэтиленовые фляги хранят в складских помещениях или под навесом.
Не допускается совместное хранение с сильными окислителями (азотная кислота, серная кислота, перманганат калия и др.).
Транспортируется в ж/д цистернах, изготовленных из нержавеющей стали марки 12Х18H10Т или 10Х17H13М2Т, с верхним сливом.
Таблица 1. Физические свойства уксусной кислоты
Бесцветная, прозрачная жидкость без механических примесей
Источник
Уксусная кислота
| Уксусная кислота | |
 | |
 | |
| Общие | |
|---|---|
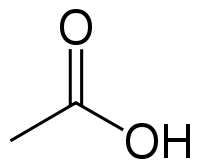
| Химическая формула | CH3COOH |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветная жидкость |
| Молярная масса | 60,05 г/моль |
| Плотность | 1,0492 г/см³ |
| Термические свойства | |
| Температура плавления | 16,75 °C |
| Температура кипения | 118,1 °C |
| Критическая точка | 321,6 °C, 5,79 МПа |
| Молярная теплоёмкость (ст. усл.) | 123,4 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | −487 кДж/моль |
| Химические свойства | |
| pKa | 4,76 (Ka=1,75*10-5) |
| Оптические свойства | |
| Показатель преломления | 1,372 |
| Структура | |
| Дипольный момент | 1,74 Д |
| Классификация | |
| Рег. номер CAS | 64-19-7 |
У́ксусная кислота (эта́новая кислота) — органическое вещество с формулой CH3COOH. Слабая, предельная одноосно́вная карбоновая кислота. Производные уксусной кислоты носят название «ацетаты».
Содержание
История
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к третьему веку до н. э. Греческий ученый Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения «свинцовых белил», а также ярь-медянки (зелёной смеси солей меди, содержащей помимо всего ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». «Сапа» содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют «свинцовым сахаром» или «сахаром Сатурна». Высокая популярность «сапы» была причиной хронического отравления свинцом, распространенного среди римской аристократии. [1]
В VIII веке арабский алхимик Джабир ибн Хайян впервые получил концентрированную уксусную кислоту путем перегонки.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается ацетон, вполне промышленный способ до середины 20 века).
Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов на самом деле являются двумя разными веществами. Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреа Либавиусом (нем. Andreas Libavius ) и французским химиком Пьером Августом Адэ (фр. Pierre Auguste Adet ) [1] .
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту. [2]
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тыс. тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго. [1] [3]
Физические свойства
Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров [4] .
Абсолютная уксусная кислота называется ледяной, ибо при замерзании образует льдовидную массу (см. изображение справа).
- Давление паров (в мм. рт. ст.):
- 10 (17,1 °C)
- 40 (42,4 °C)
- 100 (62,2 °C)
- 400 (98,1 °C)
- 560 (109 °C)
- 1520 (143,5 °C)
- 3800 (180,3 °C)
- Диэлектрическая проницаемость: 6,15 (20 °C)
- Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (25,2 °C); 0,79 (50 °C)
- Поверхностное натяжение: 27,8 мН/м (20 °C)
- Удельная теплоемкость при постоянном давлении: 2,01 Дж/г·K (17 °C)
- Стандартная энергия Гиббса образования ΔfG 0 (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия образования ΔfS 0 (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл: 11,53 кДж/моль
- Температура вспышки в воздухе: 38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания: 876,1 кДж/моль
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
| Вещество | tкип, °C | массовая доля уксусной кислоты |
|---|---|---|
| четыреххлористый углерод | 76,5 | 3 % |
| циклогексан | 81,8 | 6,3 % |
| бензол | 88,05 | 2 % |
| толуол | 104,9 | 34 % |
| гептан | 91,9 | 33 % |
| трихлорэтилен | 86,5 | 4 % |
| этилбензол | 114,65 | 66 % |
| о-ксилол | 116 | 76 % |
| п-ксилол | 115,25 | 72 % |
| бромоформ | 118 | 83 % |
-
- Уксусная кислота образует тройные азеотропные смеси
- с водой и бензолом (tкип 88 °C);
- с водой и бутилацетатом (tкип 89 °C).
- Уксусная кислота образует тройные азеотропные смеси
Получение
- Уксусную кислоту можно получить окислением ацетальдегидакислородом воздуха. Процесс проводят в присутствии катализатора — ацетата марганца (II) Mn(CH3COO)2 при температуре 50-60 °С:
В промышленности
Окислительные методы
Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана [5] .
Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 %.
Окисление н-бутана проводилось при температуре 150—200 °C и давлении 150 атм. Катализатором этого процесса являлся ацетат кобальта.
Оба метода базировались на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными, и были вытеснены более совершенными каталитическими процессами карбонилирования метанола [5] .
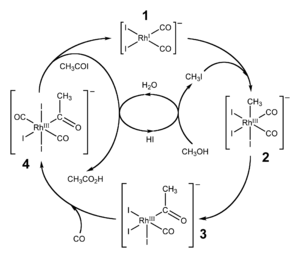
Каталитическое карбонилирование метанола
Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола моноксидом углерода [6] , которое происходит по формальному уравнению:
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом. [7] Катализатором превращения служил йодид кобальта.
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году. [8] [9] Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO). [5]
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты. [10]
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
Биохимический способ производства
При биохимическом производство уксусной кислоты используется способность некоторых микроорганизмов окислять этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этилового спирта [11] .
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольоксидазы. Это сложный многоступенчатый процесс, который описывается формальным уравнением [12] :
Химические свойства
Уксусная кислота обладает всеми свойствами карбоновых кислот. Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.
В результате диссоциации уксусной кислоты образуется ацетат-ион CH3COO − и протон H + . Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1.0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %.
Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями. [13]
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты.
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота.
Этим путем могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты.
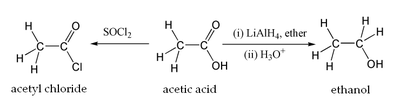
Уксусная кислота вступает во все реакции, характерные для карбоновых кислот. Она может быть восстановлена до этанола действием алюмогидрида лития. Уксусная кислота также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусный кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана.
Применение
Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной. 70-80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3-15 % — уксусом [14] . Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
Безопасность
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Порог восприятия запаха уксусной кислоты в воздухе находится в районе 0,4 мг/л. ПДК в атмосферном воздухе составляет 0,06 мг/м³, в воздухе рабочих помещений — 5 мг/м³. [4]
Действие уксусной кислоты на биологические ткани зависит от степени её разбавления водой. Опасными считаются растворы, в которых концентрация кислоты превышает 30 %. [4] Концентрированная уксусная кислота способна вызывать химические ожоги, инициирующие развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины [15] .
Токсикологические свойства уксусной кислоты не зависят от способа, которым она была получена [16] . Смертельная доза составляет примерно 20 мл.
Последствиями приёма концентрированной уксусной кислоты являются тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка; последствия всасывания уксусной эссенции — ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлыми желудочно-кишечными кровотечениями. Характерно значительное сгущение крови из-за потери плазмы через обожжённую слизистую оболочку, что может вызвать шок. К опасным осложнениям отравления уксусной эссенцией относятся острая почечная недостаточность и токсическая дистрофия печени.
При приёме уксусной кислоты внутрь следует выпить большое количество жидкости. Вызов рвоты является крайне опасным, так как вторичное прохождение кислоты по пищеводу усугубит ожог. Показано промывание желудка через зонд. Необходима немедленная госпитализация.
Источник