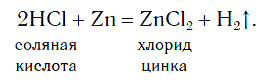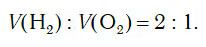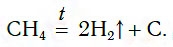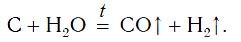- Урок 26. Получение водорода и его применение
- Получение водорода в лаборатории
- Получение водорода в промышленности
- Применение водорода
- Способы получения водорода в промышленности и лаборатории
- Получение водорода в промышленности
- Потенциальные способы получения водорода в промышленности
- Получение водорода в лаборатории
- Технологии получения Н2
- ЭЛЕКТРОЛИЗ
- ИОНИЗАТОРЫ ВОДЫ
- ГЕНЕРАТОРЫ ВОДОРОДНОЙ ВОДЫ
- ОТЛИЧИЯ ОБЫЧНОГО ЭЛЕКТРОЛИЗА ОТ СОВРЕМЕННЫХ ПОЛИМЕРНЫХ МЕМБРАН
- ХИМИЧЕСКАЯ РЕАКЦИЯ МЕТАЛЛОВ С ВОДОЙ
- ЩЕЛОЧНЫЕ АЛКАЛИНОВЫЕ СТЕРЖНИ НЕ ВЫДЕЛЯЮТ ВОДОРОД.
- БАРБОТИРОВАНИЕ
- ВОДОРОДНАЯ ВОДА В ПРИРОДЕ
- ЦЕЛЕБНЫЕ ВОДОРОДНЫЕ ИСТОЧНИКИ В МИРЕ
Урок 26. Получение водорода и его применение
В уроке 26 «Получение водорода и его применение» из курса «Химия для чайников» узнаем о получении водорода в лабораториях и в промышленности, а также выясним в каких отраслях промышленности его применяют.
Водород находит широкое применение в технике и лабораторных исследованиях. Мировое промышленное производство водорода из меряется десятками миллионов тонн в год.
Выбор промышленного способа получения простых веществ зависит от того, в какой форме соответствующий элемент находится в природе. Водород находится в природе преимущественно в соединениях с атомами других элементов. Поэтому для его получения необходимо использовать химические методы. Эти же методы применяют для получения водорода и в лабораторной практике.
Получение водорода в лаборатории
В лабораториях водород получают уже известным вам способом, действуя кислотами на металлы: железо, цинк и др. Поместим на дно пробирки три гранулы цинка и прильем небольшой объем соляной кислоты. Там, где кислота соприкасается с цинком (на поверхности гранул), появляются пузырьки бесцветного газа, которые быстро поднимаются к поверхности раствора:
Атомы цинка замещают атомы водорода в молекулах кислоты, в результате чего образуется простое вещество водород Н2, пузырьки которого выделяются из раствора. Для получения водорода таким способом можно использовать не только хлороводородную кислоту и цинк, но и некоторые другие кислоты и металлы.
Соберем водород методом вытеснения воздуха, располагая пробирку вверх дном (объясните почему), или методом вытеснения воды и проверим его на чистоту. Пробирку с собранным водородом наклоняем к пламени спиртовки. Глухой хлопок свидетельствует о том, что водород чистый; «лающий» громкий звук взрыва говорит о загрязненности его примесью воздуха.
В химических лабораториях для получения относительно небольших объемов водорода обычно применяют способ разложения воды с помощью электрического тока:
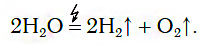
Из уравнения процесса разложения следует, что из 2 моль воды образуются 2 моль водорода и 1 моль кислорода. Следовательно, и соотношение объемов этих газов также равно:
Получение водорода в промышленности
Очевидно, что при огромных объемах промышленного производства сырьем для получения водорода должны быть легкодоступные и дешевые вещества. Такими веществами являются природный газ (метан СН4) и вода. Запасы природного газа очень велики, а воды — практически неограниченны.
Самый дешевый способ получения водорода — разложение метана при нагревании:
Эту реакцию проводят при температуре около 1000 °С.
В промышленности водород также получают, пропуская водяные пары над раскаленным углем:
Существуют и другие промышленные способы получения водорода.
Применение водорода
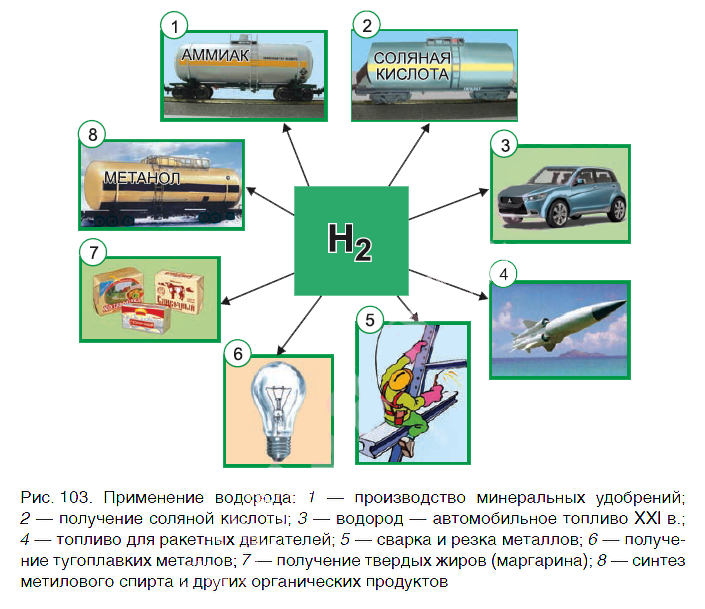
Водород находит широкое практическое применение. Основные области его промышленного использования показаны на рисунке 103.
Значительная часть водорода идет на переработку нефти. Около 25 % производимого водорода расходуется на синтез аммиака NH3. Это один из важнейших продуктов химической промышленности. Производство аммиака и азотных удобрений на его основе осуществляется в нашей стране на ОАО «Гродно Азот». Республика Беларусь поставляет азотные удобрения во многие страны мира.
В большом количестве водород расходуется на получение хлороводородной кислоты. Реакция горения водорода в
кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Водород применяют и для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам.
В пищевой промышленности водород используют в производстве маргарина из растительных масел. Реакцию горения водорода в кислороде применяют для сварочных работ. Если использовать специальные горелки, то можно повысить температуру пламени до 4000 о С. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.
В настоящее время в ряде стран, в том числе и в Беларуси, начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт — вода. А углекислый газ, вызывающий парниковый эффект (потепление окружающей среды), не выделяется.
Предполагают, что с середины XXI в. должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом.
Краткие выводы урока:
- В лаборатории водород получают действием кислот на металлы.
- В промышленности для получения водорода используют доступное и дешевое сырье — природный газ, воду.
- Водород — это перспективный источник энергии XXI в.
Надеюсь урок 26 «Получение водорода и его применение» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Источник
Способы получения водорода в промышленности и лаборатории
Получение водорода в промышленности
В промышленности водород получают главным образом из природных и попутных газов, коксового газа и продуктов газификации топлива (водяного и паровоздушного газов), путем неполного окисления углеводородов.
Основным источником водорода в промышленности является конверсия (от лат. “превращение”) углеводородов, главным образом природного газа, парами воды (пароводяная конверсия):
CH4 + H2O → CO + 3H2, 800-900 °C, ΔH298 0 = 206,2 кДж/моль
С последующим каталитическим взаимодействием оксида углерода (II) с парами воды:
Катализатором этой реакции служит Fe2O3 с активирующими добавками (Cr2O3, Al2O3, K2O и др.).
Эндотермичность процесса конверсии метана можно частично восполнить энергией, выделяющейся при неполном его окислении.
Этот процесс называется кислородной конверсией метана. Поэтому в промышленности часто комбинируют все эти три процесса в один. Для этого природный газ смешивается с водяным паром и кислородом:
Диоксид углерода удаляют промывкой газовой смеси водой под давлением и окончательно – поглощением растворами щелочей.
Все описанные выше процессы используются как по отдельности, так и в сочетании друг с другом.
Помимо природного газа для получения водорода путем конверсии используют генераторный (CO + N2), водяной (CO + H2) – пароводяная конверсия, попутные газы – пароводяная и (или) кислородная конверсия.
В связи с уменьшением запасов углеводородного сырья большой интерес приобретает метод получения водорода восстановлением водяного пара раскаленным углем:
C + H2O → CO + H2, 1000 °C, ΔH298 0 = 131 кДж/моль
При этом образуется генераторный газ. Затраты энергии на его получение можно компенсировать за счет реакции неполного окисления угля:
C + 1/2O2 → CO, ΔH298 0 = -110,5 кДж/моль
При комбинировании этих процессов получается водяной газ, состоящий в основном из смеси водорода и угарного газа:
Важным следствием является то, что получаемые генераторный и водяной газы можно использовать для дальнейшего получения водорода методом пароводяной конверсии.
Из газовых смесей с большим содержанием водорода (коксовый газ, газы нефтепереработки) его получают путем глубокого охлаждения смеси, при котором практически все газы кроме водорода сжижаются.
Водород высокой чистоты получают электролизом водных растворов щелочей (NaOH или KOH). Раньше для этого использовалась серная кислота. Однако это нерационально из-за быстрого коррозионного разрушения стальной аппаратуры. Хотя образующаяся в процессе электролиза пероксодисерная кислота H2S2O8 может использоваться для получения пергидроля:
В случае щелочей концентрация этих растворов выбирается такой, которая отвечает их максимальной электрической проводимости (25% для NaOH и 34% для KOH). Электроды обычно изготавливают из листового никеля. Этот металл не подвергается коррозии в растворах щелочей, даже будучи анодом. В случае надобности получающийся водород очищают от паров воды и следов кислорода. Этим способом целесообразно получать водород в районах с дешевой электроэнергией.
Водород образуется также как побочный продукт в процессе получения хлора и щелочей электролизом водных растворов хлоридов щелочных металлов.
Потенциальные способы получения водорода в промышленности
1. Термолиз воды:
2H2O → 2H2 + O2, 2000 °C, электрическая дуга.
Недостаток – большие расходы энергии.
3. Биохимическое разложение воды под действием бактерий.
4. Химическое разложение воды, восстановление водорода:
Получение водорода в лаборатории
Восстановление металлами и неметаллами различных водородсодержащих соединений: воды, кислот, щелочей. Чаще используется взаимодействие разбавленных кислот (соляной, серной) с цинком, реже с железом. Если реакция выделения водорода проходит очень медленно, к кислоте добавляют несколько капель любого раствора CuCl2 (к соляной кислоте) или CuSO4 (к серной кислоте). Медь выделяется на цинке (или железе) и образует с ним гальваническую пару, что ускоряет выделение водорода. Реакции обычно проводят в аппарате Кипа.
Цинк обычно содержит примеси мышьяка, сурьмы и др. элементов, поэтому выходящий из аппарата водород немного загрязнен AsH3 и др. газами. Такой газ взрывоопасен, поэтому перед его использованием водород проверяют на чистоту. Для этого из аппарата Киппа через некоторое время после начала его работы отбирают в пробирку (держа ее вверх дном) пробу газа и подносят отверстие пробирки к пламени горелки. Если при этом водород горит спокойно (без хлопка), то он не содержит примеси воздуха. В противном случае следует еще раз удалить из аппарата часть газа и повторить испытание. Этот процесс повторяют до получения спокойного, слабо светящегося пламени водорода. В противном случае нужно менять цинк (железо) на более чистые.
Для демонстрационных опытов можно использовать такую установку:
Очень чистый водород в лаборатории можно получить электролизом водных растворов щелочей.
Для получения водорода в лаборатории также можно использовать гидрид кальция:
Пропускание паров воды через раскаленную железную трубку:
Источник
Технологии получения Н2
Существует несколько способов получения водородной воды, включая электролиз (например, ионизаторы воды или специальные водородные генераторы), химическая реакция щелочными металлами и воды (например, алюминий, магний) или просто барботирование газообразного H2 в воду.
ЭЛЕКТРОЛИЗ
На рынке существует множество приборов и устройств, способных изменять химические и физические показатели воды при помощи электрического тока. Современные технологии научилась определять какие именно показатели воды имеют полезные и терапевтические свойства.
В настоящее время для производства водородной воды используется 2 метода электролиза, это электрические системы, которые воздействуют электрическим током через минеральные соли в воде, а именно, ионизаторы щелочной воды и генераторы водородной воды с нейтральным рН.
ИОНИЗАТОРЫ ВОДЫ
Ионизатором воды является любое устройство или изделие, которое увеличивает концентрацию заряженных частиц — ионов и свободных электронов. В данном методе образуется щелочная среда с насыщением водорода на катоде и кислая среда с насыщением кислорода на аноде, где анод и катод разделены барьером.
Приборы ионизации воды существуют очень давно и в настоящее время ежегодно появляются новые приборы и изделия для изменения свойств воды.
Что такое ионизация воды?
Под ионом подразумевается электрически заряженная частица (положительная или отрицательная) в виде атома или молекулы, которые образовываются при присоединении или потери электронов. Поэтому любое устройство, которое увеличивает концентрацию ионов является ионизатором воды.
После научного открытия ионизации воды путем электролиза М.Фарадея были обнаружены и другие возможности ионизации воды. Процесс ионизации можно получить несколькими способами, но его эффективность и себестоимость будет существенно отличаться.
Важно обратить внимание на то, что ионизаторы щелочной воды были разработаны до того, как стало известно о терапевтических свойствах Н2. Таким образом, эти устройства были оптимизированы для щелочного pH, а не для высокой концентрации растворенного водорода.
Только после 2007 года ученые обнаружили, что терапевтическое свойство в щелочной ионизированной воде представляет собой газообразный водород Н2. Поэтому для терапевтического эффекта важна концентрация Н2 в воде.
Важно также отметить, что, хотя некоторые ионизаторы воды могут создавать очень высокую концентрацию Н2 за счет замедления потока воды, эта продуцируемая вода часто имеет очень высокий уровень рН, что может сделать воду неприемлемой. В этом случае легко снизить pH путем добавления нескольких капель лимонного сока (лимонной кислоты) для снижения рН при сохранении более высокого уровня, растворенного Н2.
ГЕНЕРАТОРЫ ВОДОРОДНОЙ ВОДЫ
Генераторы водорода изначально разработаны для производства водорода, где конструкция, электроды и поток воды сделаны для получения высокой концентрации Н2. Однако прогресс не стоит на месте и недавно появились современные протонообменные мембраны (PEM) на основе твердого полимерного электролита (SPE).
Протонообменная мембрана, это прорыв в электролизе воды, которая позволяет получить более высокую концентрацию чистого Н2 с отделением побочных продуктов электролиза кислорода (О2), озона (О3), и хлора (Cl2).
Как происходит электролиз в SPE/PEM мембране?
Вода проникает через поры мембраны в анодное пространство. На границе анода и мембраны происходит электроокисление воды с выделением кислорода:
2H2O + 4e» —► O2 + 4H+
Непроницаемость PEM мембраны для кислорода препятствует его проникновению в катодное пространство и образованию взрывоопасной гремучей смеси кислорода и водорода. В итоге, кислород удаляется из реакционной зоны.
Далее протоны Н+ движутся через мембрану к катоду, где происходит их восстановление с электронами с выделением газообразного водорода:
Протекание катодной и анодной реакций стимулируется введением на границе раздела электродов и полимерных катализаторов — мелкодисперсных платины и оксида иридия, что делает процесс электролиза более эффективным.
В результате вы получаете воду с высокой концентрацией чистого Н2 (более 1,2 мг/л всего за 5 мин) без примесей продуктов распада электролиза и ОВП до -500 мВ.
ОТЛИЧИЯ ОБЫЧНОГО ЭЛЕКТРОЛИЗА ОТ СОВРЕМЕННЫХ ПОЛИМЕРНЫХ МЕМБРАН
Современные полимерные мембраны SPE/PME сами являются электролитом, поэтому им не требуется вода с содержанием минералов для проводимости тока, в связи с чем они имеют огромное технологическое преимущество, долгий срок службы и способны производить высокую концентрацию чистого Н2.
Благодаря более низкому электрическому сопротивлению между анодом и катодом в полимерной мембране происходит меньшее падение напряжения и более эффективный электролитический выход H2. Увеличение срока службы мембраны связано с тем, что рН питьевой воды практически не меняется, соответственно не происходит образования минерального налета на электродах.
Почему это важно, что в приборе есть протонобменная мембрана/ Твердый полимерный электролит?
Вода в приборе не является электролитом, электролиз идет внутри мембраны, вода только насыщается чистым водородом. Рекомендуется использовать дистиллированную воду или воду обратного осмоса. Это позволяет долгое время сохранять работоспособность мембраны, без необходимости в промывках.
Бывают ли приборы, разделяющие при электролизе водород и кислород, но без протонобменной мембраны?
Да, даже самые в первых приборах для электролиза в виде U образной трубки водород и кислород получались отдельно. Но электролитом в них является раствор солей в воде и помимо водорода и кислорода будут выделяться другие соединения. Бывают также приборы с мембраной, отделяющей водород, но при этом мембрана не является твердым полимерным электролитом. Эти приборы требуют использования воды с солями, поэтому мембрана засоряется и требует частых промывок. Узнайте, может ли прибор работать с дистиллированной водой, чтобы понять используется ли в нем SPE/PEM мембрана.
ХИМИЧЕСКАЯ РЕАКЦИЯ МЕТАЛЛОВ С ВОДОЙ
Другой простой и удобный способ получения воды, насыщенной Н2 заключается на химической реакции щелочноземельных металлов и воды. Например, хорошо известно, что добавление металлического натрия или калия к воде приводит к огненному взрыву.
Обратите внимание, что это металлическая форма натрия, а не ионная соль (т.е. металлический натрий, а не хлорид натрия [Na+ Cl- ]). Причина, по которой происходит эта реакция, заключается в том, что металлы быстро отдают свой внешний валентный электрон воде, которая производит молекулярный водород и гидроксид натрия: (2Na + 2H2 O -> H 2 + 2NaOH). Полученный гидроксид натрия (NaOH) диссоциирует с образованием ионов натрия (Na+ ) и гидроксид-ионов (OH- ) в соответствии с: NaOH -> Na + + OH — . Эти металлы настолько бурно реагируют с водой, что выделяется достаточно тепла, чтобы воспламенить образовавшийся газообразный водород.
Самой безопасной химической реакцией металла с водой для получения Н2 является магний. Mg+2H2O->H2 +Mg(OH)2.
Гидроксид магния (Mg(OH-)2) диссоциирует на ионы магния (Mg2+) и гидроксид ионы (ОН-) в соответствии с равновесием:
Есть магниевые палочки, которые можно поместить в воду, таблетки магния, которые растворяются в воде, таблетки, которые можно употреблять (которые производят H2 в желудке), или устройства картриджного типа, которые можно поместить в воду, быстро производя 2-4 мг/кг. Концентрация LH 2 , а также фильтры для воды, содержащие залитую магниевую среду. Как и электролиз, все эти методы увеличивают pH воды, поскольку они снижают концентрацию ионов H +.
В нашем магазине Вы можете купить водородные таблетки «Шипучий магний Drink HRW» позволяют получать самые высокие концентрации растворенного водорода в воде (более 7,0мг/л) всего за 1 минуту.
ЩЕЛОЧНЫЕ АЛКАЛИНОВЫЕ СТЕРЖНИ НЕ ВЫДЕЛЯЮТ ВОДОРОД.
На рынке воды существует большое количество недорогих щелочных алкалиновых стержней либо минеральных солей (турмалин, шунгит, кремний, оксиды и соли Mg, K, Ca, Na,Fe). Алкалиновые стержни делают воду щелочной, за счет обмена ионами и не выделяют водород в достаточном количестве.
Такие изделия имеют более низкую стоимость, и они воздействуют только на кислотно-щелочной баланс организма, минимально влияя на свободные радикалы.
Важно! Обращайте внимание на состав изделия и названия минералов. Только металлический магний образует газообразный водород, который имеет терапевтический эффект!
БАРБОТИРОВАНИЕ
Еще одним из популярных методов обогащения воды газом Н2 является Барботирование.
Барботирование — это процесс пропускания газа или пара через слой жидкости. Газ продавливается через слой жидкости с помощью трубки с мелкими отверстиями.
Данный метод часто используется в промышленности и в быту, например насыщение кислородом аквариумов.
На качество насыщения воды водородом влияют следующие характеристики барботажа:
- Давление газа. Чем больше давление, тем лучше растворение.
- Размер пузырьков. Чем меньше размер, тем лучше растворяется.
- Время прохождения пузырьков через слой воды. Чем дольше пузыри находятся в воде, тем больше насыщение.
- Температура воды. В холодной воде растворение водорода происходит лучше.
Для уменьшения пузырьков используют специальные полимерные аэраторы, которые позволяют получить нано пузырьки, в результате насыщение воды водородом увеличится в разы.
Данный метод часто используется для водородных ванн и других больших емкостей с водой.
ВОДОРОДНАЯ ВОДА В ПРИРОДЕ
Известно, что в природе существует очень полезная вода. Например, из горных источников, а люди, живущие с ней рядом и постоянно употребляя ее, являются долгожителями.
Известный факт, что средняя продолжительность жизни мужчин и женщин на Северном Кавказе составляет 112 и 114 лет соответственно. В горных источниках присутствует «легкий водород» в питьевой воде и пониженное содержание кислорода в воздухе, что и является одними из главных источников долгожительства.
Польза такой воды обусловлена тем, что она проходит через земные минералы, в результате чего обогащается полезными свойствами. Эффективность такой воды имеет место только при употреблении ее из источника т.к. при длительном взаимодействии с атмосферным воздухом (10-12 часов) вода теряет свои целебные свойства.
ЦЕЛЕБНЫЕ ВОДОРОДНЫЕ ИСТОЧНИКИ В МИРЕ
На земле имеются, известные на весь мир, источники целебной воды, такие как Лурд во Франции, Норденау в Германии, Тлакота в Мексике и Надана в Индии.
Каждый год огромное количество людей с самыми разными заболеваниями приезжают к этим святым местам. Все они хотят испить целебной воды из святых источников, чтобы избавиться от своих заболеваний. Целебность этих источников подтверждена многими уникальными случаями.
Ученые стали изучать свойства этих вод и обнаружили единственное схожее свойство, делающее их уникальными – это большое содержание газообразного водорода. Концентрация Н2 в этих водах составляет 0,2 – 0,8 мг/л. Для сравнения, в обычной воде водородный показатель воды приблизительно равен 0,018 ppm. Поэтому такую воду стали называть – водородная вода.
Лурдская вода Франции
66 пациентов с неизлечимыми заболеваниями получили свидетельства об их выздоровлении. Концентрация водорода: 800ppb (0,8 мг/л)
Колодец Тлакота в Мексике
Он стал известен благодаря Magic Johnson, игроку NBA, о его СПИДе. Концентрация водорода: 200 ppb (0,2 мг/л)
Подземная вода рудника Норденауэр в Германии
Было зарегистрировано исцеления от рака крови и диабета. Концентрация водорода: 420 ppb (0,42 мг/л)
Колодец Наданы Индии
Это знаменитая достопримечательность для лечения кожных заболеваний, полиомиелита и т. д. Концентрация водорода: 180 ppb (0,18 мг/л)
Источник