- 7. Регуляция процессов синтеза и распада гликогена
- Регуляция активности гликогенфосфорилазы и глигогенсинтазы
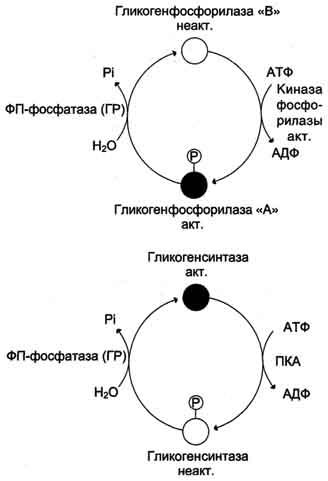
- 1) Фосфорилированная — активная (форма а); 2) дефосфорилированная — неактивная (форма в).
- Регуляция метаболизма гликогена в печени
- 59. Гликоген, биологическое значение. Биосинтез и мобилизация гликогена. Регуляция синтеза и распада гликогена.
7. Регуляция процессов синтеза и распада гликогена
Регуляция осуществляется на уровне двух ферментов: гликогенсинтетазы, участвующей в синтезе гликогена, ифосфорилазы, катализирующей расщепление гликогена.
Основным механизмом регуляции активности этих ферментов является их ковалентная модификация путем фосфорилирования-дефосфорилирования. Фосорилированная фосфорилаза или фосфорилаза «a» высокоактивна, в то же время фосфорилированная гликогенсинтетаза или синтетаза «b» неактивна. Таким образом, если оба фермента находятся в фосфорилированной форме, в клетке идет расщепление гликогена с образованием глюкозы. В дефосфорилированном состоянии, наоборот, неактивна фосфорилаза ( в форме «b») и активна гликогенсинтетаза ( в форме «a» ), в этой ситуации в клетке идет синтез гликогена из глюкозы.
Поскольку гликоген печени играет роль резерва глюкозы для всего организма, его синтез или распад должен контролироваться надклеточными регуляторными механизмами, работа которых должна быть направлена на поддержание постоянной концентрации глюкозы в крови. Эти механизмы должны обеспечивать включение синтеза гликогена в гепатоцитах при повышенных концентрациях глюкозы в крови и усиливать расщепление гликогена при падении содержания глюкозы в крови.
Итак, первичным сигналом, стимулирующим мобилизацию гликогена в печени, является снижение концентрации глюкозы в крови. В ответ на него альфа-клетки поджелудочной железы выбрасывают в кровь свой гормон — глюкагон. Глюкагон, циркулирующий в крови, взаимодействует со своим белком-рецептором, находящемся на внешней стороне наружной клеточной мембраны гепатоцита. образуя гор мон-рецепторный комплекс. Образование гормон-рецепторного комплекса приводит с помощью специального механизма к активации фермента аденилатциклазы, находящегося на внутренней поверхности наружной клеточной мембраны. Фермент катализирует образование в клетке циклической 3,5-АМФ ( цАМФ ) из АТФ. В свою очередь, цАМФ активирует в клетке фермент цАМФ-зависимую протеинкиназу. Неактивная форма протеинкиназы представляет собой олигомер, состоящий из четырех субъединиц: 2 регуляторных и двух каталитических. При повышении концентрации цАМФ в клетке к каждой из регуляторных субъединиц протеинкиназы присоединяется по 2 молекулы цАМФ, конформация регуляторных субъединиц изменяется и олигомер распадается на регуляторные и каталитичес кие субъединицы. Свободные каталитические субъединицы катализирует фосфорилирование в клетке ряда ферментов, в том числе фосфорилирование гликогенсинтетазы с переводом ее в неактивное состояние, выключая таким образом синтез гликогена . Одновременно идет фос форилирование киназы фосфорилазы, а этот фермент, активируясь при его фосфорилировании, в свою очередь катализирует фосфорилирование фосфорилазы с переводом его в активную форму, т.е. в форму «a». В результате активации фосфорилазы включается расщепление гликогена и гепатоциты начинают поставлять глюкозу в кровь.
Попутно отметим, что при стимуляции расщепления гликогена в печени катехоламинами в качестве главных посредников выступают b — рецепторы гепатоцитов, связывающие адреналин. При этом происходит повышение содержания ионов Са в клетках, где они стимулируют Са/кальмодулинчувствительную киназу фосфорилазы, которая в свою очередь активирует фосфорилазу путем её фосфорилирования.
Повышение концентрации глюкозы в крови является внешним сигналом для гепатоцитов в отношении стимуляции синтеза гликогена и связывания таким образом излишней глюкозы из русла крови.
Срабатывает следующий механизм: при повышении концентрации глюкозы в крови возрастает и ее содержание в гепатоцитах. Повышение концентрации глюкозы в гепатоцитах, в свою очередь, достаточно сложным путем активирует в них фермент фосфопротеинфосфатазу, которая катализирует отщепление от фосфорилированных белков остатков фосфорной кислоты. Дефосфорилирование активной фосфорилазы переводит ее в неактивную форму, а дефосфорилирование неактивной гликогенсинтетазы активирует фермент. В результате система переходит в состояние, обеспечивающие синтез гликогена из глюкозы [8,10].
В снижении фосфорилазной активности в гепатоцитах определенную роль играет гормон b-клеток поджелудочной железы инсулин. Он выделяется b-клетками в ответ на повышение содержания глюкозы в крови. Его связывание с инсулиновыми рецепторами на поверхности гепатоцитов приводит к активации в клетках печени фермента фосфодиэстеразы, катализирующего превращение цАМФ в обычную АМФ, не обладающую способность стимулировать образование активной протеинкиназы. Этим путем прекращается нарабатывание в гепатоцитах активной фосфорилазы, что также имеет значение для ингибирования расщепления гликогена.
Вполне естественно, что механизмы регуляции синтеза и распада гликогена в клетках различных органов имеют свои особенности. В качестве примера можно указать, что в миоцитах покоящихся мышц или мышц, выполняющих небольшую по интенсивности работу, практически нет фосфорилазы «a», но расщепление гликогена все же идет [10]. Дело в том, что мышечная фосфорилаза, находящаяся в дефосфорилированном состоянии или в форме «b», является аллостерическим ферментом и активируется имеющимися в миоцитах АМФ и неорганическим фосфатом. Активированная таким образом фосфорилаза «b» обеспечивает скорость мобилизации гликогена, достаточную для выполнения умеренной физической работы. Однако при выполнении интенсивной работы, в особенности если нагрузка резко возрастает, этого уровня мобилизации гликогена становится недостаточно. В таком случае срабатывают надклеточные механизмы регуляции. В ответ на внезапно возникшую потребность в интенсивной мышечной деятельности в кровь поступает гормон адреналин из мозгового вещества надпочечников. Адреналин, связываясь с рецепторами на поверхности мышечных клеток, вызывает ответную реакцию миоцитов, близкую по своему механизму к только что описанной реакции гепатоцитов на глюкагон. В мышечных клетках появляется фосфорилаза «a» и инактивируется гликогенсинтетаза, а образовавшийся гл-6-ф используется как энергетическое «топливо», окислительный распад которого обеспечивает энергией мышечное сокращение [8].
Следует заметить, что высокие концентрации адреналина, наблюдающиеся в крови людей в условиях эмоционального стресса, ускоряют расщепление гликогена в печени, повышая тем самым содержание глюкозы в крови — защитная реакция, направленная на экстренную мобилизация энергетических ресурсов.
Источник
Регуляция активности гликогенфосфорилазы и глигогенсинтазы
Действие этих гормонов в конечном счете сводится к изменению скорости реакций, катализируемых ключевыми ферментами метаболических путей обмена гликогена – гликогенсинтазой и гликогенфосфорилазой, активность которых регулируется аллостерически и фосфорилированием/ десфорилированием.
Гликогенфосфорилаза существует в 2 формах:
1) Фосфорилированная — активная (форма а); 2) дефосфорилированная — неактивная (форма в).
Фосфорилирование осуществляется путём переноса фосфатного остатка с АТФ на гидроксильную группу одного из сериновых остатков фермента. Следствие этого — конформационные изменения молекулы фермента и его активация.
Взаимопревращения 2 форм гликогенфосфорилазы обеспечиваются действием ферментов киназы фосфорилазы и фосфопротеинфосфатазы (фермент, структурно связанный с молекулами гликогена). В свою очередь, активность киназы фосфорилазы и фосфопротеинфосфатазы также регулируется путём фосфорилирования и дефосфорилирования.
Активация киназы фосфорилазы происходит под действием протеинкиназы А — ПКА (цАМФ-зависимой). цАМФ сначала активирует протеинкиназу А, которая фосфорилирует киназу фосфорилазы, переводя её в активное состояние, а та, в свою очередь, фосфорилирует гликогенфосфорилазу. Синтез цАМФ стимулируется адреналином и глюкагоном.
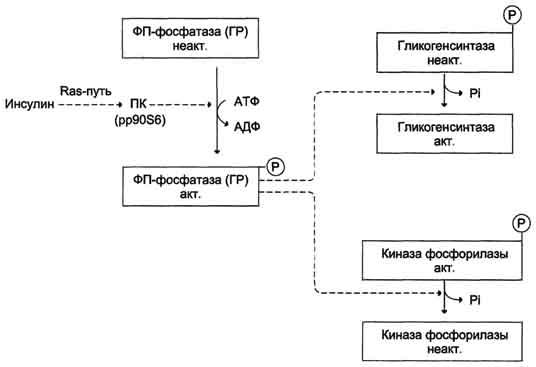
Активация фосфопротеинфосфатазы происходит в результате реакции фосфорилирования, катализируемой специфической протеинкиназой, которая, в свою очередь, активируется инсулином посредством каскада реакций с участием других белков и ферментов. Активируемая инсулином протеинкиназа фосфорилирует и тем самым активирует фосфопротеинфосфатазу. Активная фосфопротеинфосфатаза дефосфорилирует и, следовательно, инактивирует киназу фосфорилазы и гликогенфосфорилазу.
Влияние инсулина на активность гликогенсинтазы и киназы фосфорилазы. ФП-фосфатаза (ГР) — фосфопроте-инфосфатаза гранул гликогена. ПК (pp90S6) — протеинкиназа, активируемая инсулином.
Активность гликогенсинтазы также изменяется в результате фосфорилирования и дефосфорилирования. Однако есть существенные различия в регуляции гликогенфосфорилазы и гликогенсинтазы:
фосфорилирование гликогенсинтазы катализирует ПК А и вызывает её инактивацию;
дефосфорилирование гликогенсинтазы под действием фосфопротеинфосфатазы, наоборот, её активирует.
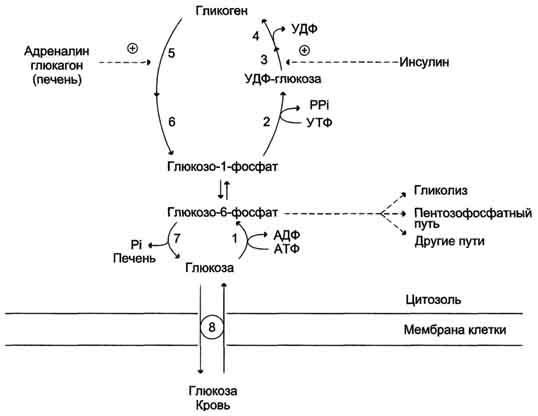
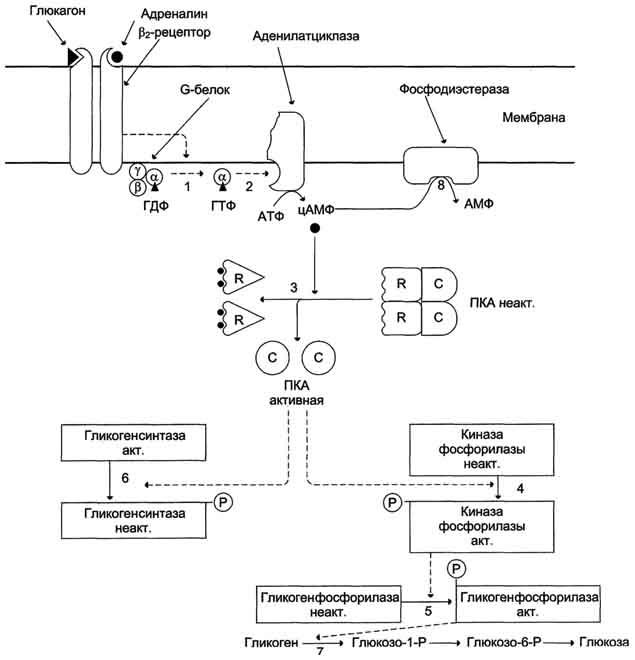
Регуляция метаболизма гликогена в печени
Повышение уровня глюкозы в крови стимулирует синтез и секрецию β-клетками поджелудочной железы гормона инсулина. Инсулин передает сигнал в клетку через мембранный каталитический рецептор — тирозиновую протеинкиназу. Взаимодействие рецептора с гормоном инициирует ряд последовательных реакций, приводящих к активации фосфопротеинфосфатазы гранул гликогена. Этот фермент дефосфорилирует гликогенсинтазу и гликогенфосфорилазу, в результате чего гликогенсинтаза активируется, а гликогенфосфорилаза становится неактивной.
Таким образом, в печени ускоряется синтез гликогена и тормозится его распад.
При голодании снижение уровня глюкозы в крови является сигналом для синтеза и секреции α-клетками поджелудочной железы глюкагона. Гормон передает сигнал в клетки через аденилатциклазную систему. Это приводит к активации проттеинкиназы А, которая фосфорилирует гликогенсинтазу и киназу фосфорилазы. В результате фосфорилирования гликогенсинтаза инактивируется и синтез гликогена тормозится, а киназа фосфорилазы становится активной и фосфорилирует гликогенфосфорилазу, которая становится активной. Активная гликогенфосфорилаза ускоряет мобилизацию гликогена в печени.
1 — глюкагон и адреналин взаимодействуют со специфическими мембранными рецепторами. Комплекс гормон-рецептор влияет на конформацию G-белка, вызывая диссоциацию его на протомеры и замену в α-субъединице ГДФ на ГТФ;
2 — α-субъединица, связанная с ГТФ, активирует аденилатциклазу, катализирующую синтез цАМФ из АТФ;
3 — в присутствии цАМФ протеинкиназа А обратимо диссоциирует, освобождая обладающие каталитической активностью субъединицы С;
4 — протеинкиназа А фосфорилирует и активирует киназу фосфорилазы;
5 — киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя её в активную форму;
6 — протеинкиназа А фосфорилирует также гликогенсинтазу, переводя её в неактивное состояние;
7 — в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы гликоген включается в процесс распада;
8 — фосфодиэстераза катализирует распад цАМФ и тем самым прерывает действие гормонального сигнала. Комплекс α-субъединица-ГТФ затем распадается.
При интенсивной физическеой работе и стрессе в крови повышается концентрация адреналина. В печени есть два типа мембранных рецепторов адреналина. Эффект адреналина в печени обусловлен фосфорилированием и активацией гликогенфосфорилазы. Адреналин имеет сходный с глюкагоном механизм действия. Но возможно включение и другой эффекторной системы передачи сигнала в клетку печени.
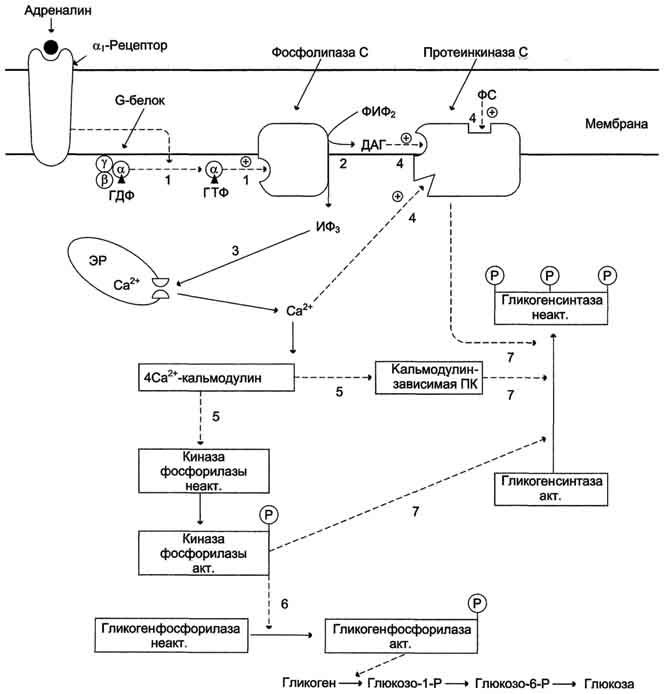
Регуляция синтеза и распада гликогена в печени адреналином и Са 2+ .
ФИФ2— фосфатидилинозитолбисфосфат; ИФ3— инозитол-1,4,5-трифосфат; ДАГ — диацилглицерол; ЭР — эндоплазматический ретикулум; ФС — фосфодитилсерин.
1 — взаимодействие адреналина с α1-рецептором трансформирует сигнал через активацию G-белка на фосфолипазу С, переводя её в активное состояние;
2 — фосфолипаза С гидролизует ФИФ2 на ИФ3 и ДАГ;
3 — ИФ3 активирует мобилизацию Са 2+ из ЭР;
4 — Са 2+ , ДАГ и фосфодитилсерин активируют протеинкиназу С. Протеинкиназа С фосфорилирует гликогенсинтазу, переводя её в неактивное состояние;
5 — комплекс 4Са 2+ — кальмодулин активирует киназу фосфорилазы и кальмодулин-зависимые протеинкиназы;
6 — киназа фосфорилазы фосфорилирует гликогенфосфорилазу и тем самым её активирует;
7 — активные формы трёх ферментов (кальмодулинзависимая протеинкиназа, киназа фосфорилазы и протеинкиназа С) фосфорилируют гликогенсинтазу в различных центрах, переводя её в неактивное состояние.
Какая система передачи сигнала в клетку будет использована, зависит от типа рецепторов, с которыми взаимодействует адреналин. Так, взаимодействие адреналина с β2-рецепторами клеток печени приводит в действие аденилатциклазную систему. Взаимодействие же адреналина с α1-рецепторами «включают» инозитолфосфатный механизм трансмембранной передачи гормонального сигнала. Результат действия обеих систем — фосфорилирование ключевых ферментов и переключение процессов с синтеза гликогена на его распад. Следует отметить, что тип рецепторов, который в наибольшей степени вовлекается в ответ клетки на адреналин, зависит от концентрации его в крови.
В период пищеварения преобладает влияние инсулина, так как инсулин-глюкагоновый индекс в этом случае повышается. В целом инсулин влияет на обмен гликогена противоположно глюкагону. Инсулин снижает концентрацию глюкозы в крови в период пищеварения, действуя на метаболизм печени следующим образом:
снижает уровень цАМФ в клетках и тем самым активируя протеинкиназу В. Протеинкиназа В, в свою очередь, фосфорилирует и активирует фосфодиэстеразу цАМФ — фермент, гидролизующий цАМФ с образованием АМФ;
активирует фосфопротеинфосфатазу гранул гликогена, которая дефосфорилирует гликогенсинтазу и таким образом её активирует. Кроме того, фосфопротеинфосфатаза дефосфорилирует и, следовательно, инактивирует киназу фосфорилазы и гликогенфосфорилазу;
индуцирует синтез глюкокиназы, тем самым ускоряя фосфорилирование глюкозы в клетке.
Источник
59. Гликоген, биологическое значение. Биосинтез и мобилизация гликогена. Регуляция синтеза и распада гликогена.
Многие ткани синтезируют в качестве резервной формы глюкозы гликоген. Синтез и распад гликогена обеспечивают постоянство концентрации глюкозы в крови и создают депо для её использования тканями по мере необходимости.
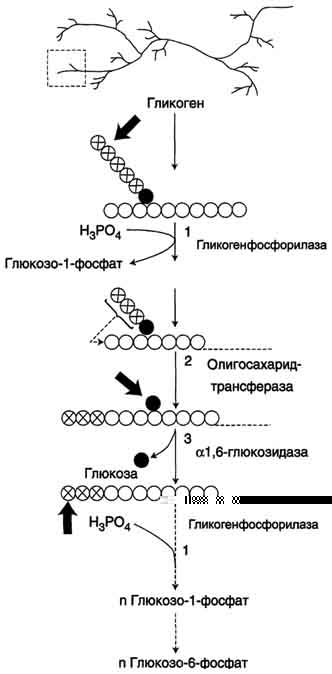
Гликоген — разветвлённый гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках α-1,4-гликозидной связью. В точках ветвления мономеры соединены α-1,6-гликозидными связями. Эти связи образуются примерно с каждым десятым остатком глюкозы. Следовательно, точки ветвления в гликогене встречаются примерно через каждые десять остатков глюкозы. Так возникает древообразная структура с молекулярной массой >10 7 Д, что соответствует приблизительно 50 000 остатков глюкозы (рис. 7-21). Таким образом, в молекуле гликогена имеется только одна свободная аномерная ОН-группа и, следовательно, только один восстанавливающий (редуцирующий) конец.
В клетках животных гликоген — основной резервный полисахарид. При полимеризации глюкозы снижается растворимость образующейся молекулы гликогена и, следовательно, её влияние на осмотическое давление в клетке. Это обстоятельство объясняет, почему в клетке депонируется гликоген, а не свободная глюкоза.
Гликоген хранится в цитозоле клетки в форме гранул диаметром 10-40 нм. С гранулами связаны и некоторые ферменты, участвующие в метаболизме гликогена, что облегчает их взаимодействие с субстратом. Разветвлённая структура гликогена обусловливает большое количество концевых мономеров, что способствует работе ферментов, отщепляющих или присоединяющих мономеры при распаде или синтезе гликогена, так как эти ферменты могут одновременно работать на нескольких ветвях молекулы. Гликоген депонируется главным образом в печени и скелетных мышцах.
После приёма пищи, богатой углеводами, запас гликогена в печени может составлять примерно 5% от её массы. В мышцах запасается около 1% гликогена, однако масса мышечной ткани значительно больше и поэтому общее количество гликогена в мышцах в 2 раза больше, чем в печени. Гликоген может синтезироваться во многих клетках, например в нейронах, макрофагах, клетках жировой ткани, но содержание его в этих тканях незначительно. В организме может содержаться до 450 г гликогена.
Распад гликогена печени служит в основном для поддержания уровня глюкозы в крови в постабсорбтивном периоде. Поэтому содержание гликогена в печени изменяется в зависимости от ритма питания. При длительном голодании оно снижается почти до нуля. Гликоген мышц служит резервом глюкозы — источника энергии при мышечном сокращении. Мышечный гликоген не используется для поддержания уровня глюкозы в крови. Как уже упоминалось ранее, в клетках мышц нет фермента глюкозо-6-фосфатазы, и образование свободной глюкозы невозможно. Расход гликогена в мышцах зависит в основном от физической нагрузки .
Рис. 7-23. Синтез гликогена. 1 — глюкокиназа или гексокиназа; 2 — фосфоглюкомутаза; 3 — УДФ-глюкрпирофосфорилаза; 4 — гликогенсинтаза (глюкозилтрансфераза); 5 — фермент «ветвления» (амило-1,4 → 1,6-глюкозилтрансфераза), светлые и заштрихованные кружки — глюкозные остатки, закрашенные кружки — глюкозные остатки в точке ветвления.
Рис. 7-25. Распад гликогена. В рамке — фрагмент гликогена с точкой ветвления. Закрашенный кружок — глюкозный остаток, связанный α-1,6-гликозидной связью; светлые и заштрихованные кружки — глюкозные остатки в линейных участках и боковых ветвях, связанные α-1,4-гликозидной связью. 1 — Гликогенфосфорилаза; 2 — олигосахаридтрансфераза; 3 — α-1,6-глюкозидаза
Рис. 7-26. Синтез и распад гликогена. 1 — гексокиназа или глюкокиназа (печень); 2 — УДФ-глюкопирофосфорилаза; 3 — гликогенсинтаза; 4 — амило-1,4 → 1,6-глюкозилтрансфераза (фермент ветвления); 5 — гликогенфосфорилаза; 6 — «деветвящий» фермент; 7 — глюкозо-6-фосфатаза (печень); 8 — транспортные системы ГЛЮТ.
Рис. 7-27. Изменение активности гликогенфосфорилазы и гликогенсинтазы. Кружками обозначены молекулы фермента: активные — чёрные, неактивные — белые. ФП-фосфатаза (ГР) — фосфопротеинфосфатаза гранул гликогена.
60. Уровень глюкозы крови как гомеостатический параметр внутренней среды организма. Роль инсулина, глюкагона, адреналина, аденилатциклазной и инозитол-фосфатной систем в регуляции уровня глюкозы.
Как уже отмечалось, первичный сигнал для синтеза инсулина и глюкагона — изменение концентрации глюкозы в крови. Инсулин и глюкагон постоянно присутствуют в крови, но при смене абсорбтивного периода на постабсорбтивный изменяется их относительная концентрация, что является главным фактором, переключающим метаболизм гликогена в печени. Отношение концентрации инсулина в крови к концентрации глюкагона называют «инсулинглюкагоновый индекс». В постабсорбтивном периоде инсулинглюкагоновый индекс снижается, и решающее значение в регуляции концентрации глюкозы в крови приобретает концентрация глюкагона
Влияние инсулина на активность гликогенсинтазы и киназы фосфорилазы. ФП-фосфатаза (ГР) — фосфопроте-инфосфатаза гранул гликогена. ПК (pp90S6) — протеинкиназа, активируемая инсулином.
Регуляция синтеза и распада гликогена в печени глюкагоном и адреналином. 1 — глюкагон и адреналин взаимодействуют со специфическими мембранными рецепторами. Комплекс гормон-рецептор влияет на конформацию G-белка, вызывая диссоциацию его на протомеры и замену в α-субъединице ГДФ на ГТФ; 2 — α-субъединица, связанная с ГТФ, активирует аденилатциклазу, катализирующую синтез цАМФ из АТФ; 3 — в присутствии цАМФ протеинкиназа А (цАМФ-зависимая) обратимо диссоциирует, освобождая обладающие каталитической активностью субъединицы С; 4 — протеинкиназа А фосфорилирует и активирует киназу фосфорилазы; 5 — киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя её в активную форму; 6-протеинкиназа А фосфорилирует также гликогенсинтазу, переводя её в неактивное состояние; 7 — в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы гликоген включается в процесс распада; 8 — фосфодиэсте-раза катализирует распад цАМФ и тем самым прерывает действие гормонального сигнала. Комплекс ос-субъединица-ГТФ затем распадается, α-, β- и γ-субъединицы G-белка реассоциируются.
Регуляция синтеза и распада гликогена в печени адреналином и Са 2+ . ФИФ2— фосфатидилинозитолбисфосфат; ИФ3— инозитол-1,4,5-трифосфат; ДАГ — диацилглицерол; ЭР — эндоплазматический ретикулум; ФС — фосфодитилсерин. 1 — взаимодействие адреналина с α1-рецептором трансформирует сигнал через активацию G-белка на фосфолипазу С, переводя её в активное состояние; 2 — фосфолипаза С гидролизует ФИФ2 на ИФ3 и ДАГ; 3 — ИФ3 активирует мобилизацию Са 2+ из ЭР; 4 — Са 2+ , ДАГ и фосфодитилсерин активируют протеинкиназу С. Протеинкиназа С фосфорилирует гликогенсинтазу, переводя её в неактивное состояние; 5 — комплекс 4Са 2+ -кальмодулин активирует киназу фосфорилазы и кальмодулин-зависимые протеинкиназы; 6 — киназа фосфорилазы фосфорилирует гликогенфосфорилазу и тем самым её активирует; 7 — активные формы трёх ферментов (кальмодулинзависимая протеинкиназа, киназа фосфорилазы и протеинкиназа С) фосфорилируют гликогенсинтазу в различных центрах, переводя её в неактивное состояние.
Источник