Медицинские интернет-конференции
Языки
Использование ферментных препаратов в медицине
Столярова Е.А.,Байгузина Д.Р.
Использование ферментных препаратов в медицине
Столярова Е.А., Байгузина Д.Р.
Научный руководитель: к.х.н., ст. преп. Куликова Л.Н.
ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава РФ
Кафедра общей, биоорганической и фармацевтической химии
Успехи современной биохимии позволили учение о ферментах превратить в интенсивно развивающуюся область знания.
Ферменты (от лат. fermentum — закваска) – белковые катализаторы, которые с высокой специфичностью и эффективностью в миллионы раз ускоряют химические превращения при обмене веществ. Дыхание, пищеварение, мышечные сокращения и другие процессы в живом организме осуществляются с помощью ферментов.
Целью исследования было выяснить способы использования ферментов в медицинской практике и сравнить некоторые препараты по эффективности основного действия.
Применение ферментов в медицине разнообразно. Протеолитические ферменты (трипсин, фибринолизин) применяют для обработки гнойных ран с целью расщепления погибших клеток, для удаления сгустков крови или вязких секретов при воспалениях дыхательных путей, при тромбозах. Фермент гиалуронидазу, катализирующий расщепление гиалуроновой кислоты, используют для рассасывания рубцов после ожогов и операций. Аспарагиназа нашла применение для лечения лейкозов. Ферменты на твердом носителе применяют в анализе – ферментные электроды, тест-полоски и т.д.
При нарушении пищеварения применяются ферментные препараты, делимые на группы, в том числе:
1. Панкреатические энзимы, представленные амилазой, липазой и трипсином (панкреатин, мезим-форте, креон).
2. Комбинированные ферменты, содержащие панкреатин в комбинации с компонентами желчи, гемицеллюлозой (фестал, энзистал).
Для сравнения эффективности расщепления жиров нами были выбраны доступные препараты из 1 и 2 группы — панкреатин и фестал.
Методом исследования выбран титриметрический анализ. Он позволил оценить скорость расщепления жиров пищи липазой по скорости накопления кислот.
Скорость и эффективность воздействия на жир панкреатина оказалась выше, чем у фестала. Заявлено, что в организме фестал, за счет желчных кислот, увеличивает панкреатическую секрецию. В условиях опыта это недостижимо. Панкреатин же работает находящимися в нем панкреатическими ферментами, не дожидаясь помощи организма.
Источник
Рекомендации к назначению ферментных препаратов при синдромах нарушенного пищеварения и всасывания
Пищеварение — это процесс, обеспечивающий пополнение энергетических и пластических ресурсов организма за счет переработки различных пищевых субстратов, поступающих в пищеварительный тракт. В его осуществлении принимают участие прежде всего пищеварительны
Пищеварение — это процесс, обеспечивающий пополнение энергетических и пластических ресурсов организма за счет переработки различных пищевых субстратов, поступающих в пищеварительный тракт. В его осуществлении принимают участие прежде всего пищеварительные железы, в секрете которых содержатся ферменты (табл. 1).
Нарушение процессов пищеварения (мальдигестия) и всасывания (мальабсорбция) являются наиболее распространенными синдромами в практике врача-терапевта и гастроэнтеролога. Их развитие может быть обусловлено недостаточной продукцией пищеварительных ферментов или снижением их активности. Механизмы нарушений процессов пищеварения и всасывания многообразны и определяются в первую очередь заболеваниями, лежащими в их основе (табл. 2).
Клинические проявления синдромов мальдигестии и мальабсорбции зависят также и от механизмов их развития (табл. 3).
При синдромах мальдигестии и мальабсорбции нередко развиваются специфические синдромы, обусловленные дефицитом в организме некоторых витаминов и микроэлементов. Например, дефицит ретинола (витамин А) сопровождается развитием гемералопии (куриная слепота), ксерофтальмии, кератомаляции, гиперкератоза; дефицит никотинамида (витамин РР) — дерматита, диареи, деменции и потери массы тела; дефицит цианкобаламина (витамин В12) — болезненной нейропатии, атаксии, парастезии, нарушением температурной чувствительности, макроцитарной анемии; дефицит аскорбиновой кислоты (витамин С) — кровоизлияниями под надкостницу и в основании волосяных фолликулов; дефицит железа — мышечной слабости, глоссита, колонихий, микроцитарной анемии и др. Основным направлением в лечении больных с синдромами нарушенного пищеварения и всасывания, особенно при невозможности устранения причин их развития, является заместительная терапия ферментами, иногда витаминами и микроэлементами.
В настоящее время в распоряжении врача имеется большое количество ферментных препаратов, отличающихся количеством входящих компонентов, степенью энзимной активности, способами производства и формами выпуска. Все ферменты условно можно разделить на две группы: панкреатин в чистом виде и панкреатин + компоненты желчи + гемицеллюлаза. Панкреатин содержит три фермента: липазу, протеазу и амилазу. Препарат считается эффективным, если в 1 г панкреатина содержится около 40 000 ЕД липазы (единицы Международной фармацевтической федерации). Липаза участвует в гидролизе эмульгированного желчью нейтрального жира, преимущественно в двенадцатиперстной кишке, так как при поступлении липазы в тощую кишку ее активность резко снижается. Протеазы в панкреатине преимущественно состоят из трипсина, под его влиянием белки, в основном животного происхождения, расщепляются на аминокислоты; кроме того, трипсин по принципу обратной связи участвует в регуляции панкреатической секреции. Амилаза расщепляет внеклеточные полисахариды (крахмал, гликоген) и практически не участвует в гидролизе растительной клетчатки. Препараты панкреатина не оказывают влияния на функцию желудка, печени, моторику билиарной системы и кишечника, но снижают секрецию панкреатического сока.
В состав ряда современных ферментных препаратов наряду с панкреатином входят желчные кислоты (желчь) и гемицеллюлаза. Препараты, содержащие желчные кислоты, увеличивают панкреатическую секрецию и холерез, стимулируют моторику кишечника и желчного пузыря. Желчные кислоты увеличивают осмотическое давление кишечного содержимого, а в условиях микробной контаминации кишечника происходит их деконъюгация с последующим развитием осмотической и секреторной диареи. Желчные кислоты вступают в энтерогепатическую циркуляцию и метаболизируются в печени, что увеличивает ее функциональную нагрузку. Деконъюгированные желчные кислоты повреждают слизистую оболочку желудочно-кишечного тракта.
Ферментные препараты, содержащие желчные кислоты, не следует назначать при остром и хроническом панкреатите, при гепатите и циррозе печени, диарее, язвенной болезни и воспалительных заболеваниях кишечника.
Наличие в ферментном препарате гемицеллюлазы обеспечивает расщепление полисахаридов растительного происхождения.
При назначении того или иного ферментного препарата необходимо прежде всего учитывать его состав.
Вторым фактором, определяющим активность лечения, является форма выпуска препарата. Большинство ферментных препаратов выпускаются в виде драже или таблеток диаметром 5 (и более) мм в кишечнорастворимых оболочках, что защищает ферменты от высвобождения в желудке и разрушения соляной кислотой желудочного сока. Из желудка одновременно с пищей могут эвакуироваться в двенадцатиперстную кишку твердые частицы, диаметр которых составляет не более 2 мм. Более крупные частицы, в частности ферментные препараты в таблетках или драже, эвакуируются в межпищеварительный период, когда пищевой химус уже покинул двенадцатиперстную кишку. В результате препараты не смешиваются с пищей и не участвуют в пищеварении. Для обеспечения быстрого и «гомогенного» смешивания с пищевым химусом были созданы высокоактивные полиферментные препараты в виде микротаблеток (панцинтрат) и микросфер (креон), диаметр которых не превышает 2 мм. Препараты заключены в желатиновую капсулу, которая разрушается в желудке, содержимое (микротаблетки и микросферы) смешивается с пищевым химусом и вместе с ним постепенно поступает в двенадцатиперстную кишку. При pH дуоденального содержимого выше 5,5 оболочки микросфер и микротаблеток растворяются и ферменты начинают действовать на большой поверхности, аналогично физиологическим процессам пищеварения.
Третьим фактором, определяющим активность ферментных препаратов, является интрадуоденальный уровень pH и эффективная моторика двенадцатиперстной кишки, обеспечивающая длительный контакт ферментов с пищевым химусом. Если pH дуоденального содержимого снижается до 3,5 и ниже, то происходит необратимая инактивация липазы и трипсина, преципитация желчных кислот, влекущая за собой нарушение эмульгирования и всасывания жиров. Основными причинами падения pH в двенадцатиперстной кишке являются избыточный бактериальный рост в кишке, гиперацидоз, снижение секреции бикарбонатов. Для повышения pH в дуоденуме используют блокаторы H2-рецепторов гистамина (ранитидин, фамотидин), иногда блокаторы протонной помпы (омепразол и др.), антацидные препараты (маалокс, гастал и др.) и обязательно проводят деконтаминацию двенадцатиперстной кишки антибактериальными препаратами (бисептол и др.), а иногда антипаразитарными (метронидазол и др.) средствами.
Дозы препаратов и продолжительность лечения определяют индивидуально, в зависимости от ведущего механизма данного нарушения. Эффективность ферментных препаратов иногда может зависеть от моторных нарушений верхних отделов пищеварительного тракта. Для устранения этих расстройств чаще всего используют прокинетики типа мотилиум (10 мг за 15 минут до еды три-четыре раза в день).
Важнейшим фактором, определяющим успех терапии, является правильный выбор ферментного препарата, его дозы и продолжительности лечения. При выборе препарата учитывается характер заболевания и механизмы, лежащие в основе нарушений пищеварения (табл. 5).
Основной недостаток ферментной терапии в том, что ее активность порой зависит от других патогенетических механизмов. Эффект терапии ферментными препаратами может быть повышен путем устранения синдрома избыточной микробной контаминации двенадцатиперстной и других отделов тонкой кишки путем проведения курсов антимикробной терапии, а при закислении дуоденума — путем восстановления нужного pH с помощью блокаторов H2-рецепторов гистамина и антацидных средств (маалокс и др.).
Источник
Применение пищеварительных ферментов в гастроэнтерологической практике
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
ММА имени И.М. Сеченова
П ищеварительные ферменты широко используются при различной гастроэнтерологической патологии. Ферменты активно применяют при различных заболеваниях желудка, тонкой и толстой кишки, желчевыводящих путей и поджелудочной железы. Показаниями для назначения ферментной терапии служат нарушения секреции эндогенных ферментов, расстройства всасывания пищевых веществ и нарушения моторики желудочно–кишечного тракта. В настоящее время мировая фармацевтическая промышленность выпускает большое количество ферментных препаратов (Дигестал, Креон, Мезим–форте и др.), которые отличаются друг от друга как дозой содержащихся в них пищеварительных ферментов, так и различными добавками (см. табл.). Пищеварительные ферменты выпускаются в различной форме: в виде таблеток, порошка или капсул, содержащих микрогранулы с энтеросолюбильной оболочкой. Все ферментные препараты различаются по своему составу: содержащие панкреатин (экстракт поджелудочной железы, обычно свиного происхождения) или пищеварительные ферменты, растительного происхождения, экстракт слизистой оболочки желудка. В состав препарата, помимо ферментов могут входить компоненты желчи, слизистой оболочки желудка или адсорбенты (симетикон или диметикон).
Выбор препарата для лечения пациента с гастроэнтерологической патологией должен основываться на следующих показателях:
• абсолютное и относительное содержание ферментов в препарате (высокое содержание протеаз показано пациентам при снижении желудочной секреции и болевой форме хронического панкреатита; увеличение активности липазы необходимо для проведения заместительной терапии при панкреатической недостаточности);
• наличие оболочки, защищающей ферменты от переваривания желудочным соком;
• размер таблетки или гранул, наполняющих капсулы (эвакуация препарата из желудка одновременно с пищей происходит в случае, если размер его частиц не превышает 2 мм);
• наличие желчных кислот в составе препарата (желчные кислоты улучшают переваривание липидов, увеличивают всасывание жирных кислот и холестерина, вызывают усиление панкреатической секреции). Однако высокое содержание желчных кислот в кишечнике при интенсивной ферментной терапии может вызвать хологенную диарею.
Пищеварительные ферменты показаны больным с расстройствами желудочной секреции (гипо– и анацидный хронический гастрит, состояния после резекции желудка). После хирургического вмешательства на желудке может развиться синдром малабсорбции, связанный с большим количеством различных факторов: снижением продукции соляной кислоты и пепсина; нарушением перемешивания химуса и его механической обработки; нарушением фракционного поступления химуса в тонкую кишку; ускорением пассажа по тонкой кишке; снижением эндогенной стимуляции панкреатической секреции; асинхронностью поступления панкреатического сока, желчи и химуса в тонкую кишку [17]. Лечение постгастрорезекционных расстройств требует проведения комплексной терапии с использованием антацидов, средств, влияющих на моторику желудочно–кишечного тракта, пищеварительных ферментов.
При гипоацидных состояниях, сопровождающихся снижением доступности пищевых веществ, показаны препараты, содержащие желчь. Эти препараты способствуют усилению продукции желчи и сока поджелудочной железы, их следует принимать по 1–3 таблетки во время или сразу после приема пищи (не разжевывая) 3–4 раза в день курсами до 2–х месяцев.
Препараты, содержащие желчь, следует с осторожностью применять у больных хроническим гепатитом или циррозом печени, так как желчные кислоты по энтерогепатическому пути поступают в печень, где подвергаются метаболизму, а также при холестатических заболеваниях, язвенной болезни, болезни Крона и неспецифическом язвенном колите.
Гипоацидный гастрит является показанием для назначения препаратов, содержащих компоненты слизистой оболочки желудка: пепсин и соляную кислоту. Эти компоненты обеспечивают механическую и химическую обработку пищи, прежде всего – белков. Протеолиз происходит до уровня полипептидов, которые затем расщепляются протеазами поджелудочной железы и частично – до аминокислот. Пепсин стимулирует секрецию поджелудочной железы, поэтому противопоказан больным хроническим панкреатитом, особенно при наличии внутрипротоковой гипертензии. Препараты, содержащие пепсин, принимают из расчета 0,2–0,5 г пепсина на прием пищи 2–3 раза в день перед или во время приема пищи. В последнее время для лечения больных со снижением кислотообразующей функции желудка с успехом применяют препараты, содержащие чистый панкреатин, по 1 т (4 р/день в начале приема пищи).
Для лечения гипомоторной дискинезии (гипокинезии) желчевыводящих путей и нарушений солюбилизации жира с успехом применяют ферментные препараты, содержащие желчные кислоты. Желчные кислоты и соли повышают сократительную функцию желчного пузыря, нормализуют биохимические свойства желчи.
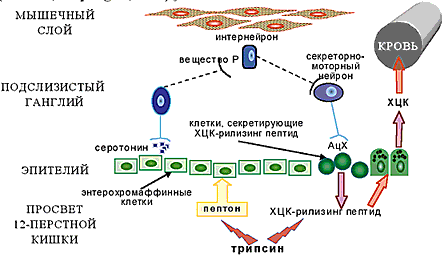
Лечение панкреатита с выраженным болевым синдромом требует строгого ограничения диеты, назначения антисекреторных средств, спазмолитиков и препаратов чистого панкреатина в высокой дозе. Эти средства являются наиболее универсальными для нормализации пищеварения в желудочно–кишечном тракте и могут использоваться в составе комплексной терапии при всех типах расстройств. Ферментные средства, содержащие чистый панкреатин, имеют в своем составе протеазы, амилазу, липазу. В препарат Дигестал входит гемоцеллюлаза, которая обеспечивает расщепление целлюлозы. Современные исследования показывают, что пищеварительные панкреатические ферменты в традиционной неэнтеросолюбильной форме обеспечивают купирование болей в период обострения [20]. Попадание ферментов поджелудочной железы (прежде всего трипсина) в двенадцатиперстную кишку разрушает рилизинг–пептиды секретина и холецистокинина и вызывает уменьшение панкреатической секреции, обеспечивая функциональный покой органа (рис. 1).
Рис. 1. Регуляция секреции ПЖ с помощью рилизинг-пептидов (по Li Y., Owyang C., 1996)
С пищеварительными ферментами растительного и грибкового происхождения было связано много надежд, и прежде всего из–за высокой кислотоустойчивости растительной и грибковой липаз. Однако в экспериментальных условиях бактериальная липаза оказалась в 75 раз менее активной, чем свиная, в связи с чем эти препараты пока не находят применения в клинической практике. Панкреатин не влияет на моторику желудочно–кишечного тракта, секрецию желчи, функцию желчевыводящих путей.
Заместительная терапия экзокринной панкреатической недостаточности необходима при различных заболеваниях, когда наступает атрофия более чем 90% паренхимы органа [19] (рис. 2), возникающая чаще всего на поздней стадии хронического панкреатита. Показаниями служат стеаторея (потеря жира с калом более 15 г/сут, при норме до 7 г/сут), прогрессирующее похудание, диарея, диспепсические симптомы. Лечение внешнесекреторной недостаточности поджелудочной железы до сих пор остается сложной задачей. В настоящее время наиболее устоявшимся можно считать проведение терапии по нескольким направлениям: отказ от употребления алкоголя, соблюдение диеты с частым приемом небольших количеств пищи, заместительная ферментная терапия, борьба с витаминной недостаточностью, анальгетики (парацетамол, трамадол), психотропные препараты.
Рис. 2. Этиология внешнесекреторной панкреатической недостаточности
Ферментная терапия при развитии экзокринной недостаточности поджелудочной железы требует применения капсул, содержащих микрогранулы (микротаблетки) панкреатина. При нарушениях гидролиза пищевых веществ капсулы достоверно превышают по эффективности таблетки панкреатина обычных размеров. Особенность этих препаратов заключается в том, что содержащиеся в них ферменты высвобождаются только в щелочной среде тонкой кишки и таким образом избегают разрушения желудочным соком (рис. 3), что значительно повышает эффективность заместительной терапии при панкреатической стеаторее. Устойчивость препарата в кислой среде – очень важное свойство препаратов (основные составляющие ферментных препаратов – липаза и трипсин быстро теряют активность в кислой среде: липаза при рН=4, трипсин при рН=3; до попадания препарата в двенадцатиперстную кишку может разрушаться до 92% липазы). Это свойство значительно повышает эффективность заместительной терапии, уменьшает или устраняет необходимость в назначении препаратов, блокирующих желудочную секрецию. Так, при использовании препарата, имеющего энтеросолюбильную оболочку, всасывание жиров выше в среднем на 20%, чем при применении обычного средства в такой же дозе. Однако у больных хроническим панкреатитом значительно снижена продукция бикарбонатов, что приводит к нарушению защелачивания в двенадцатиперстной кишке и нарушению активации принятых ферментов. В этом случае эффективность капсулированных ферментов может значительно снизиться.
Рис. 3. Действие микротаблетированного препарата с энтеросолюбильной оболочкой
Обратной стороной препаратов в энтеросолюбильной оболочке является то, что ферменты не успевают активизироваться в двенадцатиперстной кишке – основном месте выработки регуляторных пептидов поджелудочной железы. Низкая активность протеаз в двенадцатиперстной кишке не позволяет прервать стимуляцию панкреатической секреции по механизму отрицательной обратной связи, не снижает давление в протоках и паренхиме поджелудочной железы. Высокое интрапанкреатическое давление считается основным механизмом развития интенсивной боли при хроническом панкреатите, в связи с чем капсулированные ферменты рекомендуют лишь в качестве заместительной терапии, а для купирования боли (особенно при внутрипротоковой гипертензии) – традиционные таблетки или порошок панкреатина.
Тем не менее, согласно нашим собственным данным, проведение терапии хронического панкреатита с использованием капсулированного панкреатина привело к достоверному снижению интенсивности болей в животе у обследованных больных (p=0,0063; рис. 4). При этом степень уменьшения боли достоверно зависела от степени снижения активности эластазы кала по сравнению с исходных уровнем (p= 0,0219). Таким образом, анальгетический эффект проводимой терапии напрямую зависел от степени подавления экзокринной функции поджелудочной железы у больного. Экзокринная функция поджелудочной железы по данным эластазного теста (определение эластазы кала иммунореактивным методом) достоверно снизилась по сравнению с фоном: 279,46±27,41 мкг/г и 254,87±26,74 мкг/г (n=52, p=0,0152).
Рис. 4. Интенсивность боли до лечения и на фоне приема КПМЭС
Размер частиц микрогранулированных препаратов не должен превышать 2 мм, что обеспечивает одновременную эвакуацию из желудка пищи и ферментов. Дальнейшее уменьшение размера гранул не приводит к повышению эффективности переваривания пищи [13]. Назначение капсул панкреатина в дозе 16–18 тыс. ед на прием пищи больным хроническим панкреатитом после оперативных вмешательств на поджелудочной железе (панкреатодуоденэктомия и дренирование вирзунгова протока) в течение 2,5 лет позволило уменьшить потерю жира с калом с 33,6 г/сут до 15,3 г/сут [7]. Наблюдалось статистически достоверное повышение массы тела больных и биохимических показателей трофологического статуса (сывороточное железо, общая железосвязывающая способность сыворотки крови, общее число лимфоцитов).
По сведениям, полученным Farkas G., Takacs T. и соавт. (1999), назначение больным после оперативного вмешательства на поджелудочной железе микрогранулированного панкреатина в дозе 25 тыс. ед. 3 раза в сутки в течение 10 дней не привело к изменению функции ПЖ по сравнению с приемом плацебо [12]. Тем не менее проводимая терапия позволила эффективно устранить симптомы мальдигестии, стабилизировать вес тела (в группе сравнения – похудание на 3,5 кг за то же время) и повысить расщепление углеводов на 35%.
Адекватная терапия синдрома экзокринной панкреатической недостаточности требует использования высоких доз ферментных препаратов. Обычно бывает необходимо применять ферменты в капсулированной форме. Режим дозирования препарата следующий: по 1–4 капсулы ферментного препарата при основных приемах пищи (в начале приема пищи) и 1 капсула (таблетка) при приеме небольшого количества пищи. Больному следует избегать употребление пищи, богатой клетчаткой, поскольку она снижает активность ферментов как in vitro, так и in vivo. Основным компонентом ферментного препарата, определяющим эффективность терапии расстройств пищеварения, является липаза. В то же время протеазы и прежде всего трипсин являются главными ингибиторами липазы. Поэтому для купирования стеатореи не следует стремиться к значительному повышению протеолитической активности химуса. Нередко высокая доза ферментов, поступающих в желудок, не обеспечивает желаемого результата: основные составляющие ферментных препаратов – липаза и трипсин быстро теряют активность в кислой среде. Поэтому эффективность ферментной терапии может быть повышена одновременным назначением антацидных или антисекреторных препаратов, но необходимо помнить, что антациды, содержащие кальций или магний, ослабляют действие ферментных препаратов.
В оценке эффективности ферментной, в частности, заместительной терапии и определении оптимальных доз остается много открытых вопросов. Так, существуют две группы больных: пациенты, у которых секреция ПЖ превышает 10%, но тем не менее наблюдается стеаторея; и те, у которых секреция липазы практически отсутствует, однако сохраняется нормальное переваривание и всасывание жира. Это может быть связано, соответственно, с различной резервной секреторной способностью поджелудочной железы и с действием непанкреатических липаз (продуцируемых слизистой оболочкой языка и желудка, преимущественно верхней частью большой кривизны). По оценкам исследователей, у больных с экзокринной недостаточностью поджелудочной железы может всасываться более 50% жира, поступающего с пищей, в отсутствие регистрируемой активности панкреатической липазы. Показано, что у больных тяжелым панкреатитом со стеатореей при приеме 100 г жира с пищей 20–50 г жира может всасываться без заместительной ферментной терапии. По данным Abrams C.K., Hamosh M. и соавт. (1987) [5], у больных с панкреатической экзокринной недостаточностью непанкреатические липазы дают более 90% общей липолитической активности на уровне дуодено–еюнального перехода, тогда как у здоровых – 7%. Это наблюдение, по крайней мере отчасти, может объяснить, почему некоторые больные не нуждаются в заместительной ферментной терапии после операции тотальной панкреатэктомии.
Однако в двойном слепом перекрестном исследовании Neoptolemos J.P., Ghaneh P. и соавт. (1999) у 37 больных ХП с внешнесекреторной недостаточностью после обширной резекции поджелудочной железы не наблюдалось достоверных различий в частоте стула, объеме кала и суточной потере жира с калом на фоне приема стандартной или высокой дозы панкреатина. В связи с этим авторы делают вывод, что основное преимущество современных препаратов с высоким содержанием панкреатина в одной капсуле – удобство для пациента, что обеспечивает более точное соблюдение схемы терапии. В другом исследовании при назначении капсулированного препарата больным хроническим панкреатитом не было обнаружено зависимости содержания жира в кале от дозы препарата [15], что позволяет предположить наличие некоего порога эффективности ферментов, при достижении которого дальнейшее повышение дозы не приводит к уменьшению стеатореи.
Лечение больных с нарушениями двигательной функции и тонуса толстой кишки, например, при синдроме раздраженного кишечника, помимо спазмолитиков, обволакивающих, психотропных препаратов иногда требует применения пищеварительных ферментов. Применение ферментов, в составе которых есть компоненты желчи, вызывает усиление моторики кишечника и способствует разрешению имеющихся у больных запоров. Ферментные препараты, которые содержат гемицеллюлазу (Дигестал), улучшают переваривание растительной пищи и уменьшают вздутие живота, что дает хороший симптоматический эффект.
Здоровые лица могут принимать пищеварительные ферменты для купирования диспепсических симптомов после переедания. Эпизодический прием небольших доз пищеварительных ферментов (1–2 таблетки) не оказывает влияния на функцию поджелудочной железы и считается безопасным. В этой ситуации наилучшим образом зарекомендовали себя препараты с компонентами желчи.
Причины неэффективности заместительной терапии могут быть связаны как с неточной диагностикой заболевания, так и с неадекватной терапией. Иногда для снижения стоимости курса лечения назначают более низкую дозу препарата. Больные могут неверно соблюдать назначенную схему лечения: снижать кратность приема или принимать фермент в неправильное время (до или после еды). Ферментные препараты неэффективны при стеаторее внепанкреатического происхождения (целиакия, лямблиоз и др.). Действие ферментов нарушается при расстройствах моторики кишечника. Неверная схема лечения: назначение ферментов, не имеющих кислотозащитной оболочки без ингибиторов желудочной секреции; использование препаратов, которые из–за больших размеров гранул поступают в двенадцатиперстную кишку не одновременно с пищей.
Побочные эффекты ферментной терапии обычно не носят тяжелого характера. Наиболее опасный из них – развитие фиброзирующей колопатии возникает у больных муковисцидозом детей при длительном приеме очень высоких доз капсулированных ферментов – более 50 тыс. ед липолитической активности на 1 кг веса в сутки. Помимо этого, у пациентов могут возникать болезненные ощущения в ротовой полости (обычно при приеме ферментов в виде порошка), раздражение кожи в перианальной области, чувство дискомфорта в животе. Длительная ферментная терапия в высоких дозах может вызвать гиперурикемию, в некоторых случаях возникают аллергические реакции на свиной белок (в т.ч. у родственников больных с экзокринной панкреатической недостаточностью и медицинского персонала). Образование комплексов с ферментами иногда приводит к нарушению всасывания фолиевой кислоты.
Список литературы Вы можете найти на сайте http://www.rmj.ru
Дигестал (торговое название)
1. Геллер Л. И., Пашко М. М., Обухова Г. Г. Экзокринные и эндокринные панкреатические нарушения при хроническом панкреатите. // Сов. Мед. – 1989. – №8. – C. 4–7.
2. Яковенко Э.П. Ферментные препараты в клинической практике // Клин. фарм. и тер., 1998, №1, с. 17–20.
3. A primer of pancreatitis P.G.Lankisch, M.Buchler, J.Mossner, S.Muller–Lissner // Springer, 1997.
4. Abrams C.K., Hamosh M., Lee T.C., Ansher A.F., Collen M.J., Lewis J.H., Benjamin S.B., Hamosh P. Gastric lipase: localization in the human stomach. // Gastroenterol. – 1988. – Vol. 95. – P. 1460–1464.
5. Abrams CK, Hamosh M, Dutta SK, Hubbard VS, Hamosh P. Role of nonpancreatic lipolytic activity in exocrine pancreatic insufficiency.// Gastroenterol. – 1987. –Vol. 92. – P. 125–129.
6. Banks P.A. Acute and chronic pancreatitis. In: Sleisenger and Fordtran’s gastrointestinal and liver disease: pathophysiology/diagnosis/management / [edited by] Mark Feldman, Bruce F. Scharschmidt, Marvin H. Sleisenger–6th ed. W.B.Saunders company, 1998.
7. Braga M., Cristallo M., De Franchis R., Mangiagalli A., Agape D., Primignani M., Di Carlo V. Correction of malnutrition and maldigestion with enzyme supplementation in patients with surgical suppression of exocrine pancreatic function. // Surg. Gynecol. Obstet. – 1988. – Vol. 167, Dec. – No. 6. – P. 485–492.
8. Creutzfeldt W., Kern E., Kummerle F., Schumacher J. Die radikale Entfernung der Bauch–speicheldruse beim Menschen – Indikationen, Ergebnisse, Folgeerscheinungen. // In: Heilmeyer L, Schoen R, de Rudder B (eds) Ergebnisse der Inneren Medizin. – Springer, Berlin–Gottin–gen–Heidelberg. – 1961. – Vol. 16. – P. 79–124.
9. DiMagno E.P. Future aspects of enzyme replacement therapy. In Lankisch (Ed.) Pancreatic enzymes in health and disease, pp. 209–214, Springer–Verlag, Berlin, Heidelberg, 1991.
10. DiMagno E.P. Patterns of human exocrine pancreatic secretion and fate of human pancreatic enzymes during aboral transit. In Lankisch (Ed.) Pacreatic enzymes in health and disease, pp. 1–10, Springer–Verlag, Berlin, Heidelberg, 1991.
11. Diseases of the gut and pancreas. J.J.Misiewicz, R.E.Pounder, C.W.Venables eds., Blackwell scientific publication, 1994, vol. 1.
12. Farkas G., Takacs T., Baradnay G., Szasz Z. Effect of pancreatin replacement on pancreatic function in the postoperative period after pancreatic surgery. // Orv. Hetil. – 1999. – Dec 5. – vol. 140. – No. 49. – P. 2751–2754.
13. Halm U., Loser C., Lohr M., Katschinski M., Mossner J. A double–blind, randomized, multicentre, crossover study to prove equivalence of pancreatin minimicrospheres versus microspheres in exocrine pancreatic insufficiency. // Aliment. Pharmacol. Ther. – 1999 – Vol. 13. – No. 7. – P. 951–957.
14. Lankisch P. G., Banks P. A. Pancreatitis. Springer–Verlag: Berlin, Heidelberg. – 1998. – P. 377.
Источник