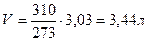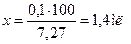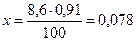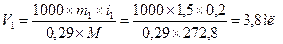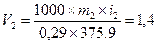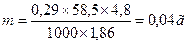Работа 4. Определение изотонического коэффициента i электролита в водном растворе методом криоскопии



Цель работы: Определить температуру замерзания растворителя и температуру начала замерзания раствора, по величине ∆Tm рассчитать изотонический коэффициент i, рассчитать осмотическое давление раствора.
Порядок выполнения работы:
1. Подготовить криометр (рис.2.1) к работе. Для этого промыть пробирку 1 и резервуар термометра 2 дистиллированной водой. Заполнить стакан 4 охлаждающей смесью из льда, NaCI и воды.
2. Измерить температуру замерзания воды. Для этого в пробирку 1 налить такой объем дистиллированной воды, чтобы ее уровень был на 0,5-1 см выше резервуара термометра и поместить ее в криометр (сосуд 3). Наблюдать за понижением температуры воды, непрерывно перемешивая жидкость мешалкой 5. Начиная с температуры 2 — 3°С, отмечать показания термометра каждые 30 секунд и записывать их в таблицу 2.1. Обычно температура жидкости постепенно снижается до значения ниже температуры замерзания (переохлаждение), затем после начала кристаллизации ее температура быстро повышается до постоянного значения, которое и является температурой замерзания чистого растворителя Т0. Записать температуру замерзания воды в таблицу 2.2. Вынуть пробирку из криометра, расплавить кристаллы, нагревая пробирку рукой, и повторить определение температуры замерзания воды.
3. 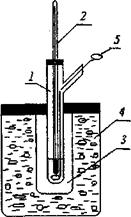
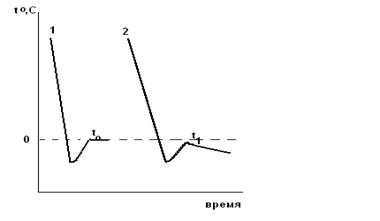
Рис 2.1 а). Изменение температуры в процессе охлаждения 1-воды, 2-раствора; б) Криометр.
Важно помнить, что температура кристаллизации раствора будет постепенно понижаться по мере выпадения кристаллов растворителя и повышения концентрации раствора (рис.2а). Температура кристаллизации растворителя из раствора исходной концентрации соответствует наивысшей температуре после переохлаждения (T1). Измерения повторить 2-3 раза.
4. По данным таблицы 2.1 построить кривые охлаждения воды и раствора.
5. По экспериментально найденному значению ∆Tm=T0—T1, рассчитать величину изотонического коэффициента i=∆Tm/Кс, и сравнить найденное значение с максимально возможным для раствора данного вещества.
6. По формуле (2.6), полученной из формул (2.3) и (2.5), рассчитать осмотическое давление исследуемого раствора:
7. Установить изотоничность раствора исследуемого вещества крови. Для этого по формуле (2.7) рассчитать осмотическое давление раствора при 310 К:
Полученное значение сравнить с осмотическим давлением крови (783 кПа).
Зависимость температуры раствора(t1) от времени охлаждения .
| Растворитель | Раствор | ||
| время, мин. | t0,°C | время, мин. | t1,°C |
| 0,5 | |||
| 1,0 | |||
 …. …. |
Масса растворителя. Масса вещества………………
| Температура кристаллизации | ∆Tm | С | i | π273 | π310 |
| растворитель | раствор |
Контрольные вопросы
Перед выполнением работы:
1. Сформулируйте цель работы.
2. Какова последовательность выполнения эксперимента?
3. Как будет изменяться температура растворителя в процессе его охлаждения? Какое показание термометра принимают за температуру замерзания растворителя?
4. Как будет изменяться температура раствора в процессе его охлаждения? Какое показание термометра принимают за температуру замерзания раствора?
К защите работы:
1. Как зависит температура замерзания раствора от концентрации растворенного вещества. Запишите формулу для расчета ∆Tm .
2. Каков физический смысл криоскопической постоянной?
3. Какое давление называют осмотическим?
4. Как оценить осмотическое давление раствора по температуре его замерзания?
5. Зависит ли осмотическое давление раствора от природы растворенного вещества?
6. В каких случаях величина осмотической концентрации совпадает с аналитической?

7. Каково максимальное значение изотонического коэффициента КСl, Na2SO4?
8. Будет ли одинаковым понижение температуры замерзания растворов сахарозы и NaСl одной и той же моляльной концентрации?
9. Будет ли изотоничен 0,85% раствору NaCl раствор А : глюкоза 1%; СаCl2 0,85%; мочевина 1,2%; КСl 4%?
10. Имеются растворы Ва(NО3)2 и А12(SО4)3 с одинаковой моляльной концентрацией. Какой из растворов обладает большим осмотическим давлением (кажущуюся степень ионизации солей считать одинаковой)?
Источник
Расчеты изотонических концентраций
ИЗОТОНИЧЕСКИЕ РАСТВОРЫ
ПЛАН ЛЕКЦИИ
ИЗОТОНИЧЕСКИЕ И ПЛАЗМОЗАМЕЩАЮЩИЕ РАСТВОРЫ
ЛЕКЦИЯ 27
1. Изотонические растворы.
2. Расчет изотонических концентраций.
3. Плазмозамещающие растворы.
4. Сложные солевые растворы
Растворы, у которых осмотическое давление равно осмотическому давлению плазмы крови, называются изотоническими. Кровяная плазма, лимфа, слезная и спинномозговая жидкости имеют постоянное осмотическое давление, которое поддерживается специальными осморегуляторами. Введение в кровяное русло больших количеств инъекционных растворов с другим значением осмотического давления может привести к сдвигу осмотического равновесия и вызвать тяжелые последствия. Это связано со следующими обстоятельствами. Как известно, клеточная оболочка полупроницаема. Она способна пропускать воду и не пропускать растворенные в ней вещества. Если ввести в кровь раствор с высоким осмотическим давлением (гипертонический раствор), возникнет разность осмотических давлений внутри эритроцитов и в окружающей их плазме. Жидкость из эритроцитов направится в плазму. Эритроциты сморщиваются. Такое явление называется плазмолизом. Если же ввести раствор с малым осмотическим давлением (гипотонический раствор), то жидкость пойдет внутрь клетки. Эритроцит разбухает, клеточная оболочка может лопнуть, а клетка — погибнуть. Это опасное явление называется гемолизом (лизисом). Чтобы избежать осмотических сдвигов, многие инфузионные растворы изотонируют — доводят их осмотическое давление до осмотического давления биологических жидкостей организма. В норме это 7,4 атм (или 0,74 МПа).
Для расчета изотонических концентраций применяют несколько методов:
1) на основании закона Вант-Гоффа. Согласно закону Вант-Гоффа, разбавленные растворы неэлектролитов ведут себя аналогично газам и поэтому подчиняются газовым законам. Исходя из этого, 1 моль любого недиссоциирующего вещества при t= 0° С и давлении Р=1 атм занимает объем V= 22,4 л. Чтобы создать давление 7,4 атм, необходимо растворить вещество в меньшем объеме:
V2 =
Учитывая, что осмотическое давление в растворе пропорционально температуре, вносят поправку на t.
t тела= 37°С = 310 К
t°раствора= 0°С = 273 К
Следовательно, чтобы получить изотонический раствор, 1 моль вещества необходимо растворить в 3,44 л воды. Тогда для приготовления 1 л раствора необходимо 0,29 М вещества:
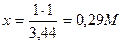
(Муравьев И.А. называет фактором изотонии электролитов)
Так, для приготовления 1 л изотонического раствора глюкозы необходимо:
М.м. глюкозы = 180
0,29 ∙ 180 = 52,2 г
Изотоническая концентрация глюкозы:
Аналогично проводят расчет изотонической концентрации гексаметилентетрамина:
2) Фактор изотонии можно вывести и из уравнения Менделеева-Клапейрона:
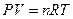
Произведение давления раствора на его объем прямо пропорционально числу грамм-молей и температуре. Число молей — это масса вещества, деленная на молекулярную массу. Подставим в уравнение Менделеева-Клапейрона:
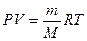
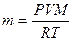
R — универсальная газовая постоянная = 0, 082 атмосферо-литров.
Т — абсолютная температура.
Приведенные расчеты верны, если речь идет о неэлектролитах. Если же растворяют в воде электролиты необходимо учитывать, что в растворе они диссоциируют на ионы.
Осмотическое давление будет тем больше , чем выше степень диссоциации. В уравнение для расчета количества вещества m = 0,29 М вводится изотонический коэффициент i. Он показывает, во сколько раз возрастает осмотическое давление раствора вследствие диссоциации и во столько раз меньше необходимо взять вещества для получения изотонического раствора
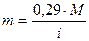
и во столько раз меньше необходимо взять вещества для получения изотонического раствора.
Коэффициент i рассчитывают по формуле

где a – степень электролитической диссоциации;
m– число частиц, образующихся из 1 молекулы при диссоциации.
Для разных групп электролитов коэффициент i может быть рассчитан следующим образом:
а) для бинарных электролитов с однозарядными ионами типа К + А —
(a= 0,86, m ∙ = 2), i = 1 + 0,86 (2-1) = 1,86
Относятся NaCl, KCl, NaNO3 , AgNO3 , пилокарпина гидрохлорид, эфедрина гидрохлорид.
б) для бинарных электролитов с двузарядными ионами типа K 2+ A 2- .
(a=0,5; m = 2), i = 1 + 0,5 (2-1) = 1,5
Относятся: ZnSO4 , MgSO4 , CuSO4 , FeSO4 , атропина сульфат.
в) для тринарных электролитов типа K + A 2- ; K 2+ A —
(a=0,75; m =3), i = 1+ 0,75 (3-1) = 2,5
г) для слабых электролитов i = 1,1.
Относятся: борная кислота, лимонная кислота.
В практической работе изотоничность растворов часто достигается с помощью других веществ, вводимых в лекарственную форму. Это бывает в тех случаях, когда основные вещества прописаны в количествах, не обеспечивающих изотоничность раствора. Чаще всего используют в качестве изотонирующих агентов NaCl, Na2SO4 или NaNO3 .
Rp.: Papaverini hydrochloridi 0,1
Natrii chloridi q. s.
ut f. solutio isotonica 10,0
Прописан 1 % раствор папаверина гидрохлорида. Вначале рассчитаем его изотоническую концентрацию:
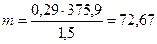
Чтобы получить 10 мл изотонического раствора попаверина гидрохлорида, необходимо было бы его взять 7,27 на 100 мл или 0,73 на 10 мл, а по прописи — только 0,1. Необходимо вводить дополнительное вещество — NaCl.
Определим теперь, какое количество раствора может быть изотонировано 0,1 г вещества:
На долю NaCl приходится 8,6 мл раствора. Его нужно взять:
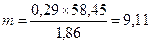
В работе для расчета изотонирующих веществ используют формулы.
1. Если изотоничность раствора достигается одним веществом

m — количество вещества, добавляемого для получения изотонического раствора (г);

V — объем прописанного раствора (мл);
M — молекулярная масса вещества.
2. Если изотоничность раствора вещества достигается с помощью другого (дополнительного) вещества
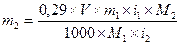
M1 — молекулярная масса основного вещества;
M2— молекулярная масса дополнительного вещества;
m1 — количество основного вещества, в г;
m2 — количество дополнительного вещества, в г;
V — объем прописанного раствора, в мл.
3. При более сложных прописях (с тремя и более компонентами) сначала находят, какой объем изотонического раствора могут дать вещества, количества которых известны. Затем по разности определяют, какой V приходится на долю дополнительного вещества. Потом определяют и его количество.
Rp.: Novocaini hydrochloridi 0,2
Papaverini hydrochloridi 0,1
Natrii chloridi q. s.
Aq. pro inject. 10 ml ut f. solutio isotonica
По закону Дальтона, осмотическое давление многокомпонентного раствора складывается из парциальных давлений отдельных компонентов:
На долю каждого компонента приходится изотонирование соответствующего объема раствора
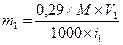
10 мл — 5,2 мл = 4,8 мл
Количество натрия хлорида:
3). Криоскопический метод (расчет на основе закона Рауля) Согласно следствию из закона Рауля, понижение температуры замерзания раствора прямо пропорционально его концентрации: Dt = K ∙ C,
где: Dt — депрессия (понижение) температуры замерзания раствора;
C — концентрация раствора;
K — криоскопическая константа.
Отсюда изотонические растворы любых солей замерзают при одной и той же температуре, т. е. имеют одинаковую температурную депрессию. Депрессия сыворотки крови 0,52°С. Если приготовленный раствор будет иметь такую же депрессию, он будет изотоничен сыворотке крови.
Для расчетов установлены температурные депрессии 1% растворов фармацевтических субстанций (приводятся в специальных таблицах). Например, ∆t 1 % раствора глюкозы 0,1. Отсюда легко рассчитать изотоническую концентрацию глюкозы:
х% – 0,52 х = 0,52/0,1 = 5,2 %
Общей для расчета является формула:
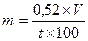
m — количество вещества в г, необходимое для изотонирования;
V — объем раствора;
t — температурная депрессия 1 % раствора.
При расчете многокомпонентных систем пользуются следующими формулами.
При двух компонентах в прописи:
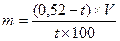
При трех и более компонентах:
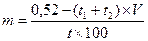
Rp.: Novocaini 0,2
Natrii chloridi q. s.
ut f. sol. isotonica 20,0
Депрессия температуры замерзания 1 % раствора новокаина Dt = 0,15, 2% раствора – 0,30.
Депрессия 1 % раствора глюкозы 0,1.
Депрессия 1 % раствора NaCl — 0,576 .
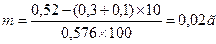
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник