Сравнительная характеристика свойств галогеноводородов
Задача 816.
Дать сравнительную характеристику свойств галогеноводородов, указав характер изменения: а) температур кипения и плавления; б) термической устойчивости; в) восстановительных свойств. Объяснить наблюдаемые закономерности.
Решение:
а) Температуры кипения и плавления галогеноводородов в ряду HI — HBr — HCl закономерно уменьшаются, тогда, как при переходе к HF они резко возрастают, Объясняется это тем, что с ростом порядкового номера увеличивается радиус атомов и возрастает поляризуемость молекул, что, естественно, приводит к увеличению межмолекулярного дисперсионного взаимодействия и обуславливает возрастание температур кипения и плавления веществ. Аномально высокие температуры кипения и плавления HF, по сравнению с другими галогеноводородами, объясняется тем, что молекулы фтороводорода ассоциированы, главным образом, в (HF)4, в результате возникновения между ними водородных связей.
б) Термическая устойчивость галогеноводородов закономерно падает в ряду HF — HCl — — HBr — HI. Прочность химической связи в молекулах галогеноводородов падает в ряду HF — HCl — — HBr — HI, потому что с ростом радиуса атома область перекрывания электронных облаков атома водорода и атома галогена располагается на большом расстоянии от ядра атома галогена, сильнее экранируется возросшим числом промежуточных электронных слоёв. Кроме того, в ряду F — Cl — Br — I электроотрицательность атома галогена уменьшается, поэтому электронное облако атома водорода смещается в сторону атома галогена всё меньше и меньше в молекулах HF, HCl, HBr, HI. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков и, тем самым, к ослаблению связи между атомами. С уменьшением прочности связи в молекулах галогеноводородов падает и их устойчивость к нагреванию
в) Все галогеноводороды в водных растворах диссоциируют на катионы водорода и анионы соответствующего галогена:
НГ ↔ Н + + Г — .
Анионы галогенов за исключением фторид-иона обладают восстановительными свойствами, возрастающими в ряду Cl- — Br- — I-. Объясняется это тем, что с ростом порядкового номера элемента увеличиваются радиусы атомов и анионов. Кроме того, в ряду F — Cl — Br — I электроотрицательность атома галогена уменьшается. Поэтому энергия связи электрона иона галогена с катионом водорода уменьшается в ряду HF — HCl — — HBr — HI, восстановительные свойства, соответственно, увеличиваются в этом ряду, самым сильным восстановителем является HI.
Фторид-ион не окисляется, потому что атом фтора самый электроотрицательный элемент.
Задача 817.
Указать способы получения галогеноводородов. Почему НI нельзя получить способами, применяемыми для получения НСI?
Решение:
Известны три основных метода синтеза галогеноводородов:
1. Прямой синтез из элементов. Фтор и хлор реагируют с водородом со взрывом, что является следствием цепного механизма реакции. Однако при определенных соотношениях давлений водорода (рН2) и хлора (рCl2) водород сгорает в атмосфере хлора без взрыва. Сжигание хлора с водородом является основным промышленным способом получения HCl. Бром и иод реагируют с водородом более спокойно, однако выход невелик, поскольку равновесие
Н2 + Х2 = 2НХ (Х = Br, I) смещено влево. Поэтому получать HBr и HI нецелесообразно. Следствием высокой термической устойчивости хлористого и фтористого водорода является возможность осуществления их непосредственного синтеза из соответствующих простых веществ (механизм — пенная реакция). Менее термически устойчивые НВг и HI непосредственным синтезом при повышенной температуре в чистом виде получены быть не могут, так как выход реакции незначителен, особенно для HI.
2.Вытеснение галогенов из их солей. Газообразные НХ выделяются при действии нелетучих сильных кислот на твердые ионные галогениды металлов: (на практике пользуются 70-85%-ным раствором серной кислоты, т.к. реакция идет на поверхности кристаллов соли. Если брать концентрированную кислоту, осаждается NaHSO4. При использовании разбавленной серной кислоты значительная часть HCl остается в растворе. Выделяющийся HCl сушат над H2SO4 конц.. Оксид фосфора для этого непригоден, так как взаимодействует с HCl:
Восстановительные свойства бромоводорода и иодоводорода заметно проявляются и при взаимодействии с концентрированной серной кислотой. При этом HBr восстанавливает H 2 SO 4 до SO2:
а HI— до свободной серы или даже до H2S:
Поэтому HBr трудно, a HI практически невозможно получить действием серной кислоты на бромиды или иодиды.
Обычно эти галогеноводороды получают действием воды на соединения брома и иода с фосфором — PBr3 и IBr3.
При получении HBr и HI, обладающих сильными восстановительными свойствами, ипользуют нелетучие кислоты-неокислители, например, H3РO4:
3. Гидролиз галогенидов неметаллов. Большинство галогенидов неметаллов относятся к соединениям с ковалентной связью и гидролизуются с выделением соответствующего галогеноводорода, например,
Для получения галогеноводородов часто используют реакции гидролиза галогенидов фосфора PX3 (X = Cl, Br, I):
При получении НХ (X = Br, I) нет необходимости предварительно синтезировать PХ3. Например, для получения HI механическую смесь I2 + P(кр) обрабатывают водой:
Существуют и другие методы синтеза галогеноводородов. HF, например, можно получить нагреванием твердых бифторидов щелочных металлов:
Галогеноводороды образуются также при галогенировании органических соединений, например:
RH +Cl2 = RCl + HCl
где R — органический радикал.
Раствор иодоводорода (вплоть до 50%-ной концентрации) можно получить, пропуская H2S в водную суспензию иода. Реакция идет согласно схеме:
В промышленности HI получают также по реакции иода с гидразином:
Задача 818.
Из каких материалов можно изготовлять аппаратуру для получения фтороводорода?
Решение:
Обычно фтороводород получают действием концентрированной серной кислоты плавиковый шпат:
Фтороводород реагирует с большинством металлов. Однако во многих случаях образующаяся малорастворимая соль, вследствие чего на поверхности металла образуется защитная плёнка, которая препятствует дальнейшему растворению металла. Поэтому для получения HF нужно применить аппаратуру, изготовленную из металлов, фториды которых не растворяются. Так вдёт себя, в частности свинец, фторид которого образует защитную плёнку, что и позволяет использовать его для изготовления аппаратуры для получения фтороводорода (устойчивой к действию HF).
Источник
Методы синтеза галогеноводородов



Известны три основных метода синтеза галогеноводородов.
1. Прямой синтез из элементов. Фтор и хлор реагируют с водородом со взрывом, что является следствием цепного механизма реакции. Однако при определенных соотношениях давлений водорода (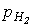
2. Вытеснение из солей. Газообразные НХ выделяются при действии нелетучих сильных кислот на твердые ионные галогениды металлов : (на практике пользуются 70-85%-ным р-ром серной к-ты, т.к. реакция идет на поверхности кристаллов соли. Если брать конц. к-ту, осаждается NaHSO4. При использовании разб серной к-ты значительная часть HCl остается в р-ре. Выделяющийся HCL сушат над конц. серной к-той. Оксид фосфора для этого непригоден так как взаимодействует с HCL: P4O10 + 12HCL = 4POCL3 + 6H2O
CaF2 + H2SO4(конц) = CaSO4 
NaCl + H2SO4(конц) = NaHSO4 + HCl
При получении HBr и HI, обладающих сильными восстановительными свойствами, используют нелетучие кислоты-неокислители, например, H3РO4:
KX + H3РO4(конц) 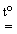
3. Гидролиз галогенидов неметаллов. Большинство галогенидов неметаллов относятся к соединениям с ковалентной связью и гидролизуются с выделением соответствующего галогеноводорода, например,
SiCl4 + 4H2O = SiO2 . 2H2O + 4HCl
Для получения галогеноводородов часто используют реакции гидролиза галогенидов фосфора PX3 (X = Cl, Br, I):
PX3 +3H2O(хол) = H3PO3 + 3HX 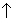
При получении НХ (X = Br, I) нет необходимости предварительно синтезировать PХ3. Например, для получения HI механическую смесь I2 + Pкр обрабатывают водой:
2Pкр + 3I2 + 6H2O = 2H3PO3 + 6HI 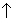
Существуют и другие методы синтеза галогеноводородов. HF, например, можно получить нагреванием твердых бифторидов щелочных металлов:
KHF2 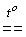
Галогеноводороды образуются также при галогенировании органических соединений, например:
RH +Cl2 = RCl + HCl 
Иодистоводородную кислоту можно получить пропусканием H2S через суспензию I2:
H2S + I2 = 2HI + S
Источник
Галогеноводороды
Галогеноводороды — соединения галогенов с водородом:
- HF(г) — фтористый водород;
- HCl(г) — хлористый водород;
- HBr(г) — бромистый водород;
- HI(г) — йодистый водород.
Все галогеноводороды имеют степень окисления -1 и ковалентную полярную связь, когда находятся в газообразном состоянии.
Галогеноводороды легко растворяются в воде, образуя сильные кислоты:
- HF(ж) — плавиковая кислота;
- HCl(ж) — соляная кислота;
- HBr(ж) — бромистоводородная кислота;
- HI(ж) — йодистоводородная кислота.
В молекуле плавиковой кислоты радиус атома галогена (фтора) самый маленький, и самая маленькая длина ковалентной связи. По направлению к HI радиус атома галогена увеличивается, растет и длина связи, при этом полярность связи уменьшается, а кислотные свойства увеличиваются, что объясняется возрастанием поляризуемости связи под влиянием молекул растворителя, что приводит к тому, что диссоциация HI протекает легче, чем HF — с увеличением радиуса атома галогена связь между атомом галогена и атомом водорода ослабляется, поэтому, под действием диполей воды от молекулы HI легче всего отщепляются ионы водорода (от молекулы HF — труднее всего).
Все вышеуказанные соединения проявляют характерные для кислот свойства — реагируют с металлами, стоящими в ряду напряжений левее водорода, вытесняя его, взаимодействуют с основными оксидами, солями, основаниями:
- реакция с металлами:
- реакция с основными оксидами:
- реакция с основаниями:
- реакция с солями:
- реакции с кислородом (фтороводород не взаимодействует с кислородом), в которых проявляются восстановительные свойства галогеноводородов:
- реакция идет при нагревании в присутствии катализатора CuCl2:
- реакция протекает медленно:
- реакция протекает быстро:
- реакции, в которых галогеноводороды являются восстановителями:
Получение и применение галогеноводородов
- В промышленных целях HCl, HBr, HI получают синтезом из простых веществ:
- Хлористый водород также получают пропуская смесь хлора с водяным паром через раскаленный уголь:
- В лабораторных условиях бромистый водород и йодистый водород получают гидролизом галогенидов фосфора:
- хлористый водород в лаборатории получают реакцией H2SO4 концентрированной на твердый хлорид натрия:
Галогеноводороды нашли достаточно широкое применение:
- соляная кислота используется в производстве хлоридов, для травления металлов, в синтезе органических веществ, в производстве соды, в качестве катализатора;
- фтористый водород используют для получения фтора, в производстве хладона и фторопласта, его применяют, как катализатор;
- бромистый водород нужен в производстве бромсодержащих соединений, как катализатор в реакциях органических веществ;
- йодистый водород применяют в производстве йодидов, и в качестве восстановителя.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник








