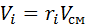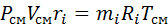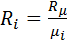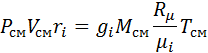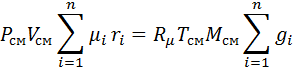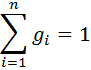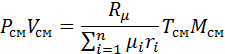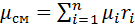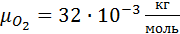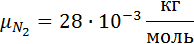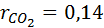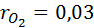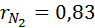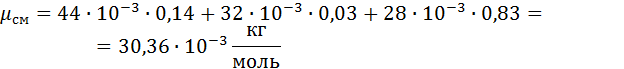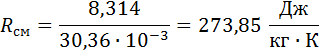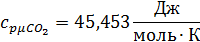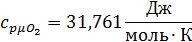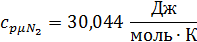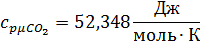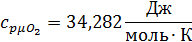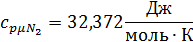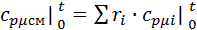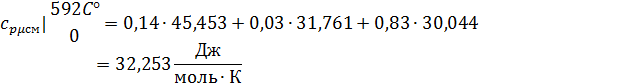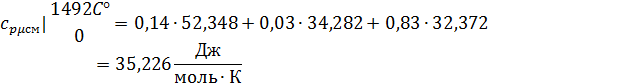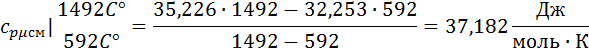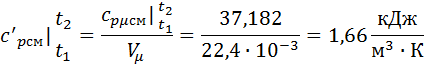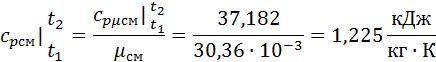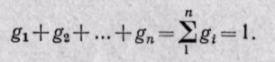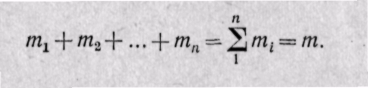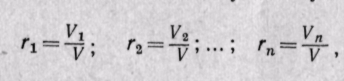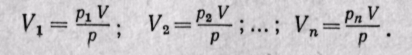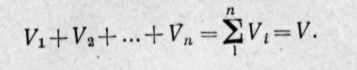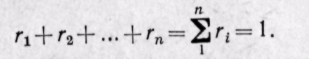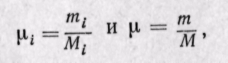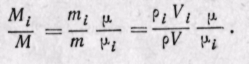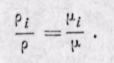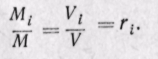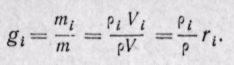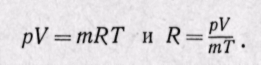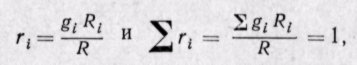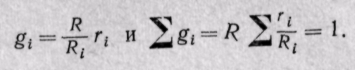Задача 1. Расчет газовой смеси
Министерство образования и науки РФ
Федеральное государственное бюджетное образовательное
Учреждение высшего профессионального образования
Рыбинский государственный авиационный технический
Университет имени П. А. Соловьева
Кафедра авиационных двигателей
Студент гр. ЭПБ-12 Сафонов И. О.
Преподаватель Лебедев В. В.
Дата защиты
Подпись
Рыбинск, 2013
Задача 1. Расчет газовой смеси
Газовая смесь состоит из нескольких компонентов, содержание которых в смеси задано в процентах по объему.
Определить: 1) кажущуюся молекулярную массу смеси; 2) газовую постоянную смеси; 3) средние мольную, объемную и массовую теплоемкости смеси при постоянном давлении в пределах температур от t1 до t2.
Дано:
Решение:
1. Вычислим кажущуюся молекулярную массу смеси:
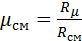
Эта формула недостаточно удобная, так как нам не дана газовая постоянная смеси, поэтому мы воспользуемся другой.
Запишем уравнение состояния для массы газа mi:
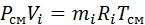
Заменим 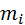
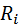
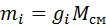
Если записать выражения для каждого компонента смеси и просуммировать, то получим:
с учетом того, что:
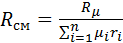
Выполнив подстановку в формулу 1, получим, что
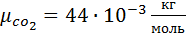
2. Вычислим газовую постоянную смеси.
Для этого воспользуемся формулой (2), выведенной в предыдущем пункте:
3. Вычислим средние мольную, объемную и массовую теплоемкости смеси при постоянном давлении в интервале температур от 592С° до 1492С°.
Определим по таблице средние мольные теплоемкости при p=constдля компонентов смеси для верхнего и нижнего предела температур:
Воспользуемся формулой для определения средней мольной теплоемкости смеси в интервале температур:
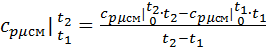
Найдем средние мольные теплоемкости смеси для t1и t2:
Подставим значения в формулу:
Зная среднюю мольную теплоемкость смеси несложно получить средние объёмную и массовую теплоемкости по известным зависимостям:
Вопросы:
1.Что называется удельной газовой постоянной? Единица ее измерения в системе СИ. Чем она отличается от универсальной газовой постоянной?
Удельной газовой постоянной называется величина, численно равная работе расширения одногомоля идеального газавизобарном процессепри увеличении температуры на 1К.
Универсальная газовая постоянная связывает объем, давление и температуру для одного моля любого вещества. Дж/(моль*К)
Удельная газовая постоянная связывает те же величины для единицы массы конкретного вещества. Дж/(кг*К).
2. Что представляют собой массовая, объемная и мольная теплоемкости? Каковы единицы их измерения в системе СИ? Какова связь между указанными теплоемкостями?
Массовая теплоемкость – теплоёмкость, отнесенная к единице массы рабочего тела. Единицей измерения массовой теплоемкости является Дж/(кг*К)
Объёмная теплоемкость – теплоёмкость, отнесенная к единице объёма рабочего тела. Единицей измерения массовой теплоемкости является Дж/(м 3 *К)
Мольная теплоемкость – теплоёмкость, отнесенная к к количеству рабочего тела(газа) в молях. Единицей измерения массовой теплоемкости является Дж/(моль*К)
3. Какие факторы влияют на величину теплоемкости.
Термодинамический процесс, при котором происходит теплопередача.
Молярная масса газа.
Источник
Газовая постоянная смеси газов
БЛОК № 5 – Гидравлика, техническая термодинамика, тепломассообмен, насосы, вентиляторы, компрессоры
Термодинамика газовых смесей, расчеты параметров и процессов горючих газов, влажного воздуха и дымовых газов (закон Дальтона, определение парциальных давлений, теплоёмкости, энтальпии).
Основные свойства газовых смесей
В технике очень часто приходится иметь дело с газообразными веществами, представляющими механическую смесь отдельных газов, например, доменный и светильный газ, отходящие газы из котельных установок, двигателей внутреннего сгорания, реактивных двигателей и других тепловых установок. Воздух также представляет собой газовую смесь, состоящую из азота, кислорода, углекислого газа, водяных паров и одноатомных газов. Поэтому для решения практических задач необходимо уметь определять основные параметры газовой смеси: газовую постоянную, среднюю молекулярную массу, парциальные давления и др.
Под газовой смесью понимается механическая смесь отдельных газов, не вступающих между собой ни в какие химические реакции. Каждый газ в смеси, независимо от других газов, полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси. Молекулы газа создают давление на стенки сосуда, которое называется парциальным (частичным). Будем считать, что каждый отдельный газ, входящий в смесь, подчиняется уравнению состояния Клапейрона, т. е. является идеальным газом.
Газовая смесь идеальных газов подчиняется закону Дальтона, который гласит: общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь: 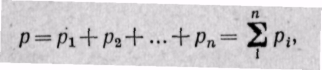
Парциальным давлением называют такое, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
Параметры газовой смеси могут быть вычислены по уравнению Клапейрона 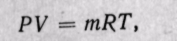
Таким образом, задачей расчета газовой смеси является определение на основании заданного состава смеси средней молекулярной массы, или газовой постоянной, смеси газов, после чего получение всех остальных параметров можно произвести по уравнению состояния для смеси.
Дополнительно часто требуется также определение и парциальных давлений газов, входящих в смесь.
При дальнейшем изложении этой главы все величины без значков будем относить к газовым смесям, а величины со значками — к отдельным газам.
Способы задания смеси газов. Газовая смесь может быть задана массовыми, объемными и мольными долями.
Массовой долей называют отношение массы каждого газа к общей массе смеси: 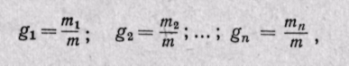
m1, m2. тn—масса каждого газа; т—масса всей смеси. Сумма массовых долей равна единице:
Сумма масс всех газов равна массе смеси:
Объемной долейназывают отношение парциального (приведенного) объема каждого газа к общему объему смеси газов:
каждого газа; V — объем смеси газов.
Парциальным объемом газа называют объем, который занимал бы этот газ, если бы его температура и давление равнялись температуре и давлению смеси газов.
Парциальный объем каждого газа можно определить по закону Бойля — Мариотта. При постоянной температуре имеем
Сложив полученные уравнения, будем иметь
Сумма парциальных объемов газов, составляющих смесь, равна объему смеси газов.
Сумма объемных долей равна единице:
Задание смеси мольными долями равнозначно заданию ее объемными долями.
Действительно, если мольной долей назвать отношение числа киломолей каждого газа (Мi) к числу киломолей смеси газов (М), то, учитывая, что
Из закона Авогадро следует, что при одинаковых давлениях и температурах
Тогда окончательно
Соотношения между массовыми и объемными долями. Между удельными объемами, плотностями, молекулярными массами и газовыми постоянными какого-нибудь газа и всей смеси в целом на основании закона Авогадро и уравнения Клапейрона — Менделеева существует следующая зависимость:
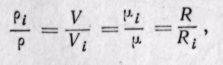
где рi — плотность каждого газа; ρ — плотность смеси газов; μi — молекулярная масса каждого газа; μ — молекулярная масса смеси газов.
Можно записать также, что
Последние два соотношения позволяют составить несколько уравнений, связывающих массовые и объемные доли:
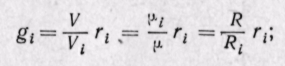
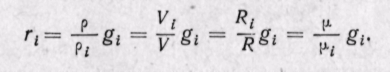
Газовая постоянная смеси газов
Смесь газов подчиняется уравнению состояния
Из уравнения (3-2″)
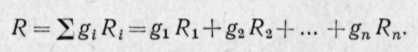
Газовая постоянная смеси газов равна сумме произведений массовых долей каждого газа на его газовую постоянную.
Другое уравнение для определения газовой постоянной смеси
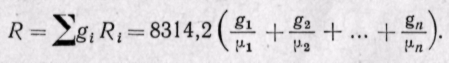
Газовую постоянную смеси можно определить по известной сред ней молекулярной массе смеси
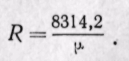
Следовательно, газовая постоянная смеси определяется по уравнению, в которое вводится средняя молекулярная масса, а газовая постоянная отдельного газа определяется по тому же уравнению, но в него вводится действительная молекулярная масса каждого газа.
Если дан объемный состав смеси, то из (3-2′)
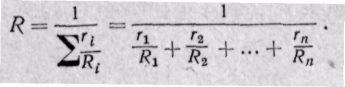
Дата добавления: 2018-02-15 ; просмотров: 4428 ; Мы поможем в написании вашей работы!
Источник