- Ацетальдегид
- Содержание
- Физические свойства
- Получение
- Реакционная способность
- Реакция конденсации
- Производные ацеталя
- Применение
- Биохимия
- Табачная зависимость
- Альцгеймерова болезнь
- Проблема алкоголя
- Канцероген
- Безопасность
- Врожденная непереносимость алкоголя
- — Ацетальдегид. Мини-справочник по химическим веществам (3340 веществ)
- Историческая справка
- Видео
- Общая формула альдегидов
- Классификация альдегидов
- Гомологический ряд, изомерия, номенклатура
- Электронное строение молекул альдегидов
- Изомерия кетонов
- Специфические способы получения формальдегида и ацетальдегида
- Химическая формула уксусного альдегида
Ацетальдегид
| Ацетальдегид | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | этаналь |
| Традиционные названия | ацетальдегид, метилформальдегид |
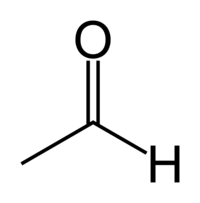
| Химическая формула | СH3СHO |
| Эмпирическая формула | С2H4O |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Молярная масса | 44.05 г/моль |
| Плотность | 0.788 г/см³ |
| Динамическая вязкость (ст. усл.) | |
| Термические свойства | |
| Температура плавления | −123.5 °C |
| Температура кипения | 20.2 °C |
| Температура воспламенения | 234,15 K (−39 °C) °C |
| Температура самовоспламенения | 458,15 K (185 °C) °C |
| Химические свойства | |
| Растворимость в воде | смешивается |
| Структура | |
| Дипольный момент | 2.7 Д |
| Классификация | |
| Рег. номер CAS | 75-07-0 |
| SMILES | O=CC |
| Регистрационный номер EC | 200-836-8 |
| RTECS | AB1925000 |
Ацетальдеги́д (у́ксусный альдегид, этана́ль, метилформальдегид) — органическое соединение класса альдегидов с химической формулой CH3-CHO . Это один из наиболее важных альдегидов, широко встречающийся в природе и производящийся в больших количествах индустриально. Ацетальдегид встречается в кофе, в спелых фруктах, хлебе, и синтезируется растениями как результат их метаболизма. Также производится окислением этанола.
Содержание
Физические свойства
Вещество представляет собой бесцветную жидкость с резким запахом, хорошо растворяется в воде, спирте, эфире. Из-за очень низкой температуры кипения (20,2 °C) хранят и перевозят ацетальдегид в виде тримера — паральдегида, из которого он может быть получен нагреванием с минеральными кислотами (обычно серной).
Получение
В 2003 глобальное производство было около миллиона тонн в год. Основной способ получения — окисление этилена (процесс Вакера [1] ):
В качестве окислителя В процессе Вакера используется хлорид палладия, регенерирущийся окислением хлоридом меди в присутствии кислорода воздуха:


Также получают уксусный альдегид гидратацией ацетилена в присутствии солей ртути (реакция Кучерова), с образованием енола, который изомеризуется в альдегид:
Этот метод раньше доминировал до появления процесса Вакера [1] окислением или дегидрированием этилового спирта, на медном или серебряном катализаторе.

Реакционная способность
По своим химическим свойствам уксусный альдегид является типичным алифатическим альдегидом и для него характерны реакции этого класса соединений. Его реакционная способность определяется двумя факторами — активностью карбонила альдегидной группы и подвижностью атомов водорода метильной группы вследствие индуктивного эффекта карбонила. Подобно другим карбонильным соединениям с атомами водорода у α-углеродного атома, ацетальдегид таутомеризуется, образуя енол — виниловый спирт, равновесие почти полностью смещено в сторону альдегидной формы (константа равновесия — только 6·10 −5 при комнатной температуре [2] ):

Реакция конденсации
Из-за маленьких размеров и доступности в виде безводного мономера (в отличие от формальдегида) является широко распространённым электрофилом в органическом синтезе. [3] Что касается реакций конденсации, альдегид прохирален. Используется, в основном, как источник синтона «CH3C + H(OH)» в альдольной и соответствующих реакциях конденсации. Реактив Гриньяра и литий-органические соединения реагируют с MeCHO, образуя производные гидроксэтила. В одной из очень интересных реакций конденсации, три эквивалента формальдегида присоединяются, а один восстанавливает образующийся альдегид, образуя из MeCHO пентаэритрит (C(CH2OH)4.)
В реакции Штрекера [4] ацетальдегид конденсируется с цианидом и аммиаком, образуя после гидролиза аминокислоту — аланин [5] . Ацетальдегид способен конденсироваться с аминами образуя имины, так как конденсация циклогексиламина даёт N-этилиденциклогексиламин. Эти имины могут быть использованы для прямой последующей реакции, таких, как альдольная конденсация. [6] Ацетальдегид также — важный строительный блок для синтезов гетероциклических соединений. Выдающийся пример — конверсия под действием аммиака до 5-этил-2-метилпиридина («альдегид-коллидин») [7]
Реакция альдольной конденсации обусловлена подвижностью водорода в альфа-положении в радикале и осуществляется в присутствии разбавленных щелочей. Ее можно рассматривать как реакцию нуклеофильного присоединения одной молекулы альдегида к другой: CH3-CH2-CH=O + CH3-CH2-CH=O → CH3-CH2-CH(OH)-CH(CH3)-CH=O +(OH)- Продукт- 2-метил-3-гидроксипентаналь.
Производные ацеталя
Три молекулы ацетальдегида конденсируются, образуя «паральделгид» — циклический тример, содержащий одиночные С-О связи. Конденсация четырёх молекул даёт циклическое соединение, называемое метальдегид.
Ацетальдегид образует стабильные ацетали при реакции с этанолом в условиях дегидратации. Продукт CH3CH(OCH2CH3)2 называется «ацеталь» [8] , хотя термин используется для описания более широкой группы соединений с общей формулой RCH(OR’)2.
Применение
Применяют уксусный альдегид для получения уксусной кислоты, бутадиена, некоторых органических веществ, альдегидных полимеров.
Традиционно ацетальдегид, в основном, использовался в качестве прекурсора к уксусной кислоте. Такое применение было отвергнуто ввиду того, что уксусная кислота более эффективно производится из метанола с помощью процессов Монсанто [9] и Катива [10] . В терминах реакции конденсации, ацетальдегид — важный прекурсор к пиридиновым производным, пентаэритролу и кротоналдегиду. Мочевина и ацетальдегид конденсируются, образуя смолы. Уксусный ангидрид реагирует с ацетальдегидом, давая этилидендиацетат, из которого получают винилацетат — мономер поливинилацетат.
Биохимия
В печени энзим алкогольдегидрогеназа окисляет этанол в ацетальдегид, который затем далее окисляется в безопасную уксусную кислоту посредством ацетальдегиддегидрогеназы. Эти две реакции окисления связаны с восстановлением NAD + в NADH [11] . В мозгу алкогольдегидрогеназа не играет особой роли в окислении этанола в ацетальдегид, это делает энзим каталаза. Конечные шаги алкогольной ферментации в бактериях, растениях и дрожжах включают конверсию пирувата в ацетальдегид под действием пируват декарбоксилаза, после чего — конверсию ацетальдегида в этанол. Последняя реакция снова катализируется алкогольдегидрогеназой, но уже в обратном направлении.
Табачная зависимость
Ацетальдегид — значительная часть дыма табака. Была продемонстрирована синергическая связь с никотином, увеличивающая появление зависимости, особенно у молодёжи. [12] [13]
Альцгеймерова болезнь
Люди, у которых отсутствует генетический фактор конверсии ацетальдегида в уксусную кислоту, могут иметь большой риск предрасположенности к болезни Альцгеймера. «Эти результаты указывают что отсутствие ALDH2 — это фактор риска для поздно возникающей болезни Альцгеймера.» [14]
Проблема алкоголя
Ацетальдегид, полученный из поглощённого этанола, связывает ферменты, образуя аддукты, связанные с заболеваниями органов. [15] Лекарство дисульфирам (Antabuse) предотвращает окисление ацетальдегида до уксусной кислоты. Это даёт неприятные ощущения при принятии алкоголя. Antabuse используется в случае, когда алкоголик сам хочет излечиться.
Канцероген
Ацетальдегид предположительно является канцерогеном для человека. [16] «Существует достаточно доказательств канцерогенности ацетальдегида (основного метаболита этанола) в экспериментах на животных», кроме того, ацетальдегид повреждает ДНК [17] и вызывает несоразмерное с общей массой тела развитие мускулов, связанное с нарушением белкового равновесия организма. [18] В результате исследования 818 алкоголиков ученые пришли к выводу, что у тех пациентов, которые подвергались действию ацетальдегида в большей степени, присутствует дефект в гене фермента алкогольдегидрогеназы. Поэтому такие пациенты подвержены большему риску развития рака верхней части ЖКТ и печени. [19]
Безопасность
Ацетальдегид токсичен при действии на кожу, ирритант и, возможно, канцероген. Он также является загрязнителем воздуха при горении, курении, в автомобильных выхлопах. Он также образуется при термической обработке полимеров и пластиков. [20]
Врожденная непереносимость алкоголя
Одним из механизмов врожденной непереносимости алкоголя является накопление ацетальдегида.
Источник
— Ацетальдегид. Мини-справочник по химическим веществам (3340 веществ)
Историческая справка
Датой первого обнаружения элемента шведским фармацевтом Карлом Вильгельмом Шееле принято считать 1774 год. Позже он был неоднократно исследован химиками Антуаном Франсуа и графом де Фуркруа. В 1835 году немецкий учёный Юстус фон Либих обозначит вещество как «альдегид». В ходе дальнейших изучений элемент получил нынешнее название.
Видео
Общая формула альдегидов
(для простейшего альдегида R=H)
Классификация альдегидов
По строению углеводородного радикала:
Гомологический ряд, изомерия, номенклатура
Альдегиды изомерны другому классу соединений — кетонам
Альдегиды и кетоны содержат карбонильную группу ˃C=O, поэтому называются
Электронное строение молекул альдегидов
Атом углерода альдегидной группы находится в состоянии sp2-гибридизации, поэтому все σ-связи в этой группе располагаются в одной плоскости.
Облака р-электронов, образующих π-связь, перпендикулярны этой плоскости и легко смещаются к более электроотрицательному атому кислорода. Поэтому двойная связь C=O (в отличие от двойной связи C=C в алкенах) сильно поляризована.
Изомерия кетонов
Для кетонов характерна изомерия углеродного скелета, изомерия положения карбонильной группы и межклассовая изомерия.
Изомерия углеродного скелета характерна для кетонов, которые содержат не менее пяти атомов углерода.
| Например. Ф ормуле С5Н10О соответствуют кетоны-изомеры углеродного скелета |
| Пентанон-2 | 3-Метилбутанон-2 |
 |  |
Изомерия положения карбонильной группы характерна для кетонов, которые содержат не менее пяти атомов углерода.
| Например. Ф ормуле С5Н10О соответствуют два кетона-изомера углеродного скелета |
| Пентанон-2 | Пентанон-3 |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Кетоны являются межклассовыми изомерами с альдегидами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для кетонов, которые содержат не менее трех атомов углерода.
| Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3 |
| Пропаналь | Ацетон (пропанон) |
 |  |
Все альдегиды и кетоны, кроме формальдегида – жидкости. Лёгкие альдегиды хорошо растворимы в воде из-за водородных связей, которые они образуют с водой.
1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
Специфические способы получения формальдегида и ацетальдегида
1. Каталитическое окисление метана
2. Гидратация ацетилена (реакция Кучерова)
Понятие о альдегиды. Состав молекулы, электронная и структурная формулы.
Функциональная карбонильная группа
Альдегидами называют органические вещества, молекулы которых содержат функциональную группу атомов 
Общая формула веществ этого класса CnH2n +1 COН или R-COН, в которой R — это атом водорода (в случае с Мурино альдегидом) или углеводородный радикал.
Группа атомов называется карбонильной группой, или карбонил.
Сравнению со спиртами в составе молекул альдегидов на два атома водорода меньше.
Это отражается в названии «альдегиды», что происходит от слов «алкоголь» и «дегидрирования», т.е. дегидрований алкоголь.
Первый член гомологического ряда альдегидов — метаналь, или формальдегид, или Мурино альдегид.
Он формулу 
Следующий за ним — этаналь, или ацетальдегид, или уксусный альдегид. Его формула 
По номенклатуре, исторически сложилась, названия альдегидов происходят от названий тех кислот, на которые они превращаются при окислении. Например, Мурино альдегид — от Мурино кислоты, уксусный альдегид — от уксусной кислоты и т. д. По систематической номенклатуре, названия альдегидов образуют от названий соответствующих предельных углеводородов путем добавления суффикса-аль: метаналь, этаналь, пропаналя т.д..
Формальдегид СН2=О (муравьиный альдегид, метаналь).
Представляет собой бесцветное горючее вещество с острым раздражающим запахом. Растворим в воде, обычно используется в виде 33-40 % водного раствора, который называют формалином. Вырабатывают формальдегид в больших количествах.
Он применяется в производстве пластмасс. Полиформальдегид с большим молекулярным весом – ценный синтетический материал, используемый в качестве заменителя металлов. В кожевенной промышленности формальдегид применяется для дубления кожи, в медицине и санитарии – для дезинфекции.
В с/х формальдегид используется для протравливания семян перед посевом (уничтожают паразитические споры). Так как формальдегид образуется при неполном сгорании различных органических веществ, то он содержится в дыме угля, дерева; на этом основано консервирующее действие дыма при получении мясных и рыбных копченостей.
Ацетальдегид СН3—СН=О (уксусный альдегид, этаналь).
Представляет собой бесцветную легколетучую, легковоспламеняющуюся жидкость с сильным характерным запахом прелых яблок.
1. уксусный альдегид+ Ag₂O => (р. серебряного зеркала) 2. уксусный альдегид+2Cu(OH)₂ =>
Хорошо растворим в воде. Используют ацетальдегид для многих промышленных синтезов. Особенно важно окисление его в уксусную кислоту, превращение в этилацетат (по реакции Тищенко); может быть восстановлен в этиловый спирт.
Ацетон СН3—СО—СН3 (диметилкетон).
Бесцветная, легковоспламеняющаяся жидкость с довольно приятным запахом. Смешивается с водой. Ацетон является ценным растворителем (в производстве лаков, искусственного шелка, взрывчатых веществ) и исходным веществом в синтезе разнообразных органических соединений.
В последнее время в технике большое значение приобрело применение ацетона для получения так называемого кетена.
Кетен – газообразное вещество, очень реакционноспособное. Применяется для получения уксусного ангидрида и ряда других ценных продуктов, в частности, очень хорошего пищевого консерванта – сорбиновой кислоты.
Химическая формула уксусного альдегида
Химическая формула уксусного альдегида C2H4O. Она показывает, что в состав данной молекулы входят два атома углерода (Ar = 12 а.е.м.), четыре атома водорода (Ar = 1 а.е.м.) и один атом кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу уксусного альдегида:
Mr(C2H4O) = 2×12 + 4×1 + 16 = 24 + 4 +16 = 44.
Источник


















