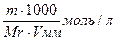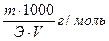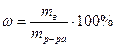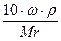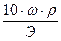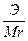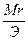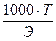Способы приготовления титрованных растворов



1 — по точной массе.Точную навеску вещества взвешивают с помощью аналитических весов, количественно переносят в мерную колбу и растворяют. Титрованные растворы, полученные таким образом, называются растворами с приготовленным титром, или стандартными растворами. Данным способом можно приготовить титрованные растворы только тех веществ, которые удовлетворяют следующим требованиям:
ü вещество должно быть химически чистым, т.е. не должно содержать посторонних примесей в таких количествах, которые могут повлиять на точность анализов (не более 0,05—0,1%);
ü состав вещества должен строго соответствовать формуле;
ü вещество должно быть устойчивым при хранении в твердом виде и в растворе;
ü желательна возможно большая величина молярной массы эквивалента вещества.
Удовлетворяющие указанным требованиям вещества называются исходными или стандартными, установочными, так как, пользуясь ими, устанавливают титры всех остальных веществ.
2 — с установленным титром. Если вещество не удовлетворяет перечисленным выше требованиям, то сначала готовят раствор его приблизительно нужной концентрацией.Впоследующем, концентрацию данного раствора устанавливают путем титрования с использованием стандартного раствора, или другого раствора с точно известной концентрацией. Например, концентрацию раствора NaOH устанавливают в результате титрования им раствора щавелевой кислоты. Щавелевая кислота может быть путем перекристаллизации получена химически чистой, строго отвечающей своей формуле H2C2O4∙2H2O. Титрованные растворы, концентрацию которых находят (как для NaOH) в результате титрования, называются стандартизированными растворами, растворами с установленным титром, иногда их называют «рабочими» растворами.
3 — из фиксаналов. Для получения титрованных растворов на практике часто пользуются имеющимися в продаже «фиксаналами». Они представляют собой запаянные в стеклянную ампулу точно отвешенные количества различных твердых веществ или точно отмеренные объемы титрованных растворов, необходимые для изготовления 1 л раствора точно известной концентрации, например 0,1 моль/л, 0,05 моль/л. Приготовление титрованного раствора из фиксанала сводится к тому, чтобы количественно перенести содержимое ампулы в мерную колбу вместимостью 1 л, после чего растворить вещество, и полученный раствор разбавить до метки водой.
Источник
Способы приготовления титрованных растворов.
Существуют три способа приготовления титрованных или стандартизированных растворов.
1. Растворением точно взвешенного количества вещества и разбавлением его до известного объёма. Для этого на аналитических весах берут точную навеску вещества, растворяют ее в мерной колбе и доводят объем раствора водой до метки. Зная массу растворенного вещества (Т) и объем полученного раствора (V), нетрудно вычислить его титр:
Титрованные растворы, полученные таким образом, называются растворами с приготовленным титром или первичными стандартами.
Первичные стандарты применяют в титриметрии для количественного определения тех или иных веществ и для установления концентрации стандартного (рабочего) раствора.
Однако такой метод приготовления растворов пригоден лишь тогда, когда вещество отвечает ряду требований.
Требования к первичным стандартам:
1) вещество должно быть химически чистым;
2) состав вещества должен точно соответствовать формуле;
3) вещество должно быть хорошо растворимым в воде;
4) вещество должно быть устойчивым при хранении и в твердом виде или растворе;
5) оно не должно содержать гидратную воду: гигроскопическое или склонное к выветриванию вещество трудно высушить и взвесить;
6) желательна возможно большая величина грамм-эквивалента вещества, что позволяет увеличить точность установления нормальности раствора. Поскольку при увеличении массы относительная ошибка взвешивания уменьшается, высокая эквивалентная масса способствует уменьшению ошибок взвешивания;
7) вещество должно быстро и до конца реагировать с другими веществами. Пользуясь первичными стандартными растворами, устанавливают титр остальных веществ. К первичным стандартам
относятся, например, NaСl, Nа2СОз, Na2B407•10Н2О, K2Cr207, Н2С2О4•2Н2О, КВгОз и другие.
2. Титрованием раствора, содержащего взвешенное количество соединения, раствором реагента точной концентрации. Если
вещество не удовлетворяет перечисленным выше требованиям, то сначала готовят раствор его приблизительно нужной нормальности. Параллельно с этим готовят раствор первичного стандарта.
Далее один из растворов оттитровывают другим и, зная концентрацию стандарта, вычисляют точную концентрацию приготовленного раствора. Титрованные растворы, концентрацию которых находят в результате титрования, называются вторичными стандартными растворами или
растворами с установленным титром; иногда их называют «рабочими» растворами. Процесс определения концентрации стандартного раствора титрованием первичным стандартом называется стандартизацией.
3. Для получения титрованных р-ров на практике часто пользуются «фиксаналами» или стандарт-титрами.
Методы приготовления титрованных растворов:
1) растворы с приготовленным титрантом: навеска на аналитических весах в мерной колбе,
2) с установленным титром: готовят раствор с приблизительной концентрацией, а точно устанавливают титрованием,
3) из фиксаналов: титр рабочего раствора устанавливают через каждые 1-3 недели.
Титр рабочих растворов нужно устанавливать в таких же условиях, как и проводить титрование.
5. Расчёты в титриметрическом анализе.
Методы расчёта в количественном анализе основаны на законе эквивалентов:
Все вещества реагируют между собой в эквивалентных соотношениях.
Молярная концентрация(молярность раствора) — это содержание моль вещества в одном литре раствора.
См=
См= 
0,1 м 0,1 — децимолярная
См=0,1 М 0,001 — сантимолярная
Сн (нормальность) — N =
Эсоли= 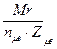
Титр — Т — количество грамм вещества в одном мл раствора:
Т = 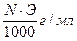
Тх/у= 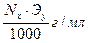
ТНСl=
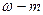
См=
N=
Cм= N
N=Cм
Т= 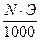
Источник
Титрованные растворы способы приготовления титрованных растворов
МЕТОДЫ ПРИГОТОВЛЕНИЯ ТИТРОВАННЫХ РАСТВОРОВ ДЛЯ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
Reagents. Methods of preparation of standard volumetric solutions for acid-base titration
Дата введения 1984-07-01
1. РАЗРАБОТАН И ВНЕСЕН Министерством химической промышленности СССР
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 23.05.83 N 2302
3. Стандарт соответствует СТ СЭВ 3674-82
4. ВВЕДЕН ВПЕРВЫЕ
5. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначение НТД, на который дана ссылка
Номер пункта, приложения
1.4, 2.1.1, 2.2.1, приложение 2
2.1.1, 2.2.1, приложение 2
6. Ограничение срока действия снято по протоколу N 7-95 Межгосударственного совета по стандартизации, метрологии и сертификации (ИУС 11-95)
7. ИЗДАНИЕ (май 2008 г.) с Изменением N 1, утвержденным в декабре 1990 г. (ИУС 3-91)
Настоящий стандарт распространяется на реактивы и устанавливает методы приготовления следующих титрованных растворов для кислотно-основного титрования и проверки их молярных концентраций:
кислота серная, растворы молярных концентраций:



кислота соляная, растворы молярных концентраций:



натрия гидроокись, растворы молярных концентраций:



1. ОБЩИЕ УКАЗАНИЯ
1.1. Титрованные растворы предназначены для титриметрических определений и содержат в определенном объеме точно известные количества активного вещества.
За основу расчетов при приготовлении и проверке титрованных растворов взято понятие «молярная масса эквивалента». Числовое значение молярной массы эквивалента равно числовому значению ранее применявшегося грамм-эквивалента.
1.2. При приготовлении титрованных растворов должны соблюдаться требования ГОСТ 27025.
При взвешивании применяют лабораторные весы общего назначения типов ВЛР-200 г и ВЛКТ-500 г-М или ВЛЭ-200 г.
Допускается применять другие средства измерения с метрологическими характеристиками и оборудование с техническими характеристиками не хуже, а также реактивы по качеству не ниже указанных.
(Измененная редакция, Изм. N 1).
1.3. Растворы индикаторов готовят по ГОСТ 4919.1. Вспомогательные реактивы и растворы — по ГОСТ 4517.
1.4. Для приготовления растворов гидроокисей используют дистиллированную воду, не содержащую углекислоты, приготовленную по ГОСТ 4517. Для приготовления других растворов и при титровании используют дистиллированную воду по ГОСТ 6709.
1.5. Для приготовления титрованных растворов используют твердые вещества, взвешивая их (результат взвешивания в граммах записывают с точностью до второго десятичного знака), и концентрированные растворы веществ, отмеряя их пипеткой (ГОСТ 29227) или бюреткой (ГОСТ 29251) с ценой деления 0,1 см . Допускается готовить титрованные растворы, используя стандарт-титры (фиксаналы) в ампулах.
При приготовлении больших объемов титрованных растворов твердые вещества взвешивают на весах ВЛКТ-1000 и концентрированные растворы отмеряют цилиндром.
1.4; 1.5. (Измененная редакция, Изм. N 1).
1.6. Приготовленные титрованные растворы тщательно перемешивают.
1.7. Определение точной молярной концентрации вещества в растворе
1.7.1. Точную молярную концентрацию , моль/дм , с коэффициентом поправки вычисляют по формуле

где — заданная молярная концентрация вещества в растворе, моль/дм ;
1.7.2. Точную молярную концентрацию , моль/дм , без коэффициента поправки вычисляют по формуле

где — масса навески установочного вещества, г;
— молярная масса эквивалента установочного вещества, г/моль;
— объем анализируемого раствора, израсходованный на титрование, см .
Точная молярная концентрация вещества в растворе выражается четырьмя значащими цифрами после запятой.
1.8. Определение коэффициента поправки
Коэффициент поправки ( ) определяют по установочным веществам или их растворам.
1.8.1. При применении установочного вещества коэффициент поправки вычисляют по формуле

Источник