Общие представления и понятия титриметрического анализа. Способы фиксации точки эквивалентности
К основным понятиям титриметрии относятся: аликвота, рабочий раствор, стандартный раствор, титрование, титрованный раствор, титрант; кривая титрования, конец титрования и точка эквивалентности. Приведем определение этих понятий.
Ø Аликвота (аликвотная часть) (Va) – точно отмеренный объем раствора (мл) взятый для титрования. Обычно это раствор, содержащий определяемый компонент, который помещают в колбу для титрования.
Ø Рабочий раствор – раствор реагента точно известной концентрации, используемый непосредственно при выполнении анализа вещества.
Ø Стандартный раствор – это раствор точно известной концентрации применяемый для стандартизации других растворов; может выполнять функции рабочего раствора.
Ø Титрованный раствор (стандартный титрованный раствор) – любой раствор, концентрация которого точноустановлена тем или иным способом.
Ø Титрант– раствор реагента или определяемого вещества, объем которого изменяется в процессе титрования и точно фиксируется в точке эквивалентности.
Ø Кривая титрования – график зависимости изменения параметров титруемого раствора от объема израсходованного титранта(Vт-та), например, при измерении кислотности среды: рН = f(Vт-та); потенциала системы: Е = f(Vт-та), где f — знак функциональной зависимости измеряемого параметра.
Ø Конец титрования – это реально фиксируемый каким-либо методом момент окончания реакции. Он близок, но не точно совпадает с точкой эквивалентности. Чем ближе фиксируемый конец титрования к точке эквивалентности, тем точнее титрование (меньше погрешность).
Ø Точка эквивалентности (стехоиметричности), обозначаемая Т.Э. или Е – это теоретически рассчитанный момент титрования, когда реагент и определяемый компонент взяты в стехиометрических количествах.
Ø Титрование — это такой процесс, когда раствор титранта добавляют в титруемую пробу малыми порциями до момента фиксации окончания реакции (точке эквивалентности).
Ø Показатель титровании (рТ) – это значение, при котором заканчивается титрование с данным индикатором при правильном его подборе. При этом показатель титрования должен быть как можно ближе к середине интервала перехода индикатора, т.е. к значению рК. Вид параметра рТ определяется типом индикатора (рТ = рН; рЕ).
Ø Показатель индикатора (рК) – это значение, которое соответствует середине интервала перехода индикатора и рассчитывается через его константу (диссоциации, устойчивости и т.д.).
Все расчеты в титриметрии основываются на законе эквивалентов и выполняются, исходя из объема титранта, измеренного в точке конца реакции, хотя на практике вместо «конец реакции» обычно употребляют термин «точка эквивалентности». Это удобнее, однако, смешивать по сути понятия «конец реакции» и «точка эквивалентности» нельзя. Одина из главных причин погрешности титриметрического метода заключается в несовпадении фиксируемого конца реакции и реальной точки эквивалентности.
В основе титриметрических определений лежит химическая реакция между титруемым раствором и титрантом, но далеко не любая химическая реакция пригодна для ее использования в титриметрии. Их выбор обусловлен следующими требованиями:
Ø реакция должна идти количественно, т.е. быть необратимой (Креак.>>1);
Ø остаточная концентрация титруемого вещества в Т.Э. не может превышать 10 -6 моль/л;
Ø должен существовать способ точной фиксации точки эквивалентности (конца реакции) — визуальный или инструментальный;
Ø скачок и Т.Э. — четко фиксируются и находятся в узком интервале расхода титранта (обычно 1- 2 капли);
Ø отсутствуют сопряженные реакции, влияющие на ход кривой титрования и положение Т.Э.;
Ø скорость реакции достаточно высока, чтобы исключить перетитровывания раствора.
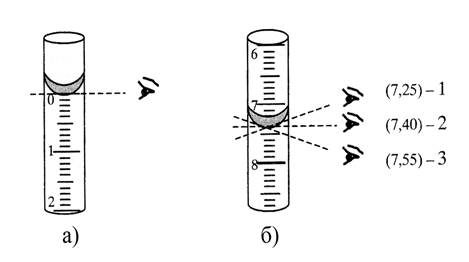
Отбор пробы для титрования (аликвоты) осуществляют пипеткой Мора, а расход титранта фиксируют по шкале бюретки в момент окончания реакции. Точность выполненных определений во многом зависит от правильности обращения с пипеткой Мора (рис. 4.5) и бюреткой (рис. 4.6). Особенно это касается измерения объемов. Объем будет определен правильно, если отсчет проводится по центральной части нижнего края мениска, расположенного на уровне глаз (рис. 4.5 и 4.6)
Рисунок 4.5 – Определение объема раствора при работе с пипеткой
Мора (а) и перенос аликвоты (снятие последней капли) в колбу
для титрования (б).
Рисунок 4.6 – Положение глаз при отсчете объема по бюретке:
а – определение нулевого положения перед началом титрования;
б – определение объема израсходованного титранта:
1 и 3 – неправильное положение глаз: объем раствора или занижен (1),
или завышен (3); 2 – правильное положение глаз при отсчете.
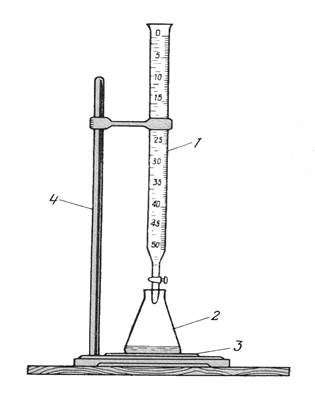
Титрование в лаборатории при визуальной фиксации точки эквивалентности выполняют на установке, показанной ниже на рисунке 4.6. Существуют два варианта проведения титриметрического анализа, обусловленные методикой отбора титруемой пробы: метод пипетирования и метод отдельных навесок. Они отличаются точностью и трудоемкостью.
Метод пипетирования (рис. 4.5) заключается в отборе аликвотных частей (аликвот) титруемого раствора из мерной колбы с помощью пипеток Мора. Обычно отбирают и титруют аликвоты до получения не менее 3-хсходящихся результатов. Метод прост, экспрессен, но уступает в точности методу отдельных навесок.
Метод отдельных навесок состоит во взвешивании на аналитическихвесах рассчитанной массы навески вещества, необходимой для каждого титрования, которые не должны значительно отличаться. Навески количественно переносят в колбы для титрования, растворяют примерно равными объемами воды и титруют. Титрование выполняю до получения не менее 3-х сходящихся значений по содержанию вещества.
Рисунок 4.6 – установка для титрования: 1 – бюретка с раствором
титранта; 2 – колба с титруемым раствором; 3 – белая плитка или лист
Источник
Портал аналитической химии
Методики, рекомендации, справочники
Метод равного помутнения (Гей-Люссака). Если титровать раствор NaBr раствором AgNOe (или наоборот), то происходит реакция:
,Очевидно, что осадок AgBr выпадает только до тех пор, пока в растворе еще имеется избыток Br-. Поэтому, отбирая в .конце титрования небольшие порции титруемого раствора и прибавляя к ним одну каплю разбавленного в 10 раз раствора AgN03, можно
точно уловить момент прекращения образования осадка. В данном случае это сильно облегчается потому, что вблизи точки эквивалентности осадок AgBr, коагулируя, собирается на дне сосуда в виде крупных творожистых хлопьев. Раствор при этом быстро осветляется, чему способствует энергичное перемешивание или встряхивание его.
При осаждении AgCl у которого произведение растворимости (1,78•1O-10) не так мало, как у AgBr (5,6•1O-13), методику работы приходится несколько усложнять. Дело в том, что насыщенный раствор AgCl, получающийся в точке эквивалентности, дает отчетливое помутнение как с раствором AgNO3, так и с раствором NaCl (понижение растворимости AgCl от введения одноименных ионов).
-ионов, то помутнение при добавлении AgNO3 будет, очевидно, большим, чем при добавлении NaCl. Наоборот, если раствор немного перетитрован, то NaCl вызовет более сильное помутнение, чем AgNO3.
Следовательно, для фиксирования точки эквивалентности здесь приходится перед концом титрования отбирать по две одинаковые пробы раствора и действовать на одну из них каплей раствора AgNO3, на другую — каплей раствора NaCl такой же концентрации. Титрование заканчивают при получении одинаковой интенсивности помутнения обеих проб.
«Метод равного помутнения», несмотря на то что приходится отбирать для проб некоторую часть титруемого раствора, является одним из точнейших методов титриметрического анализа. Однако он требует навыка и довольно кропотлив. Поэтому на практике обычно пользуются аргентометрическими методами с применением индикаторов.
Титрование до точки просветления. Метод титрования до точки просветления может быть применен тогда, когда малорастворимое соединение в процессе титрования находится в коллоидном состоянии. Например, при титровании I- раствором соли серебра, частицы AgI, адсорбируя I-, получают отрицательные заряды (см. § 27). Наличие зарядов, как известно, препятствует объединению частиц в более крупные агрегаты и оседанию их на дно сосуда. Вследствие этого при титровании сначала образуется не осадок, а коллоидный раствор AgI.
* Как будет показано позже, при рассмотрении титрования с внешними индикаторами ошибку, связанную с отбором проб, можно сделать исчезающе малой. Метод равного помутнения, предложенный в 1832 г. Гей-Люссаком, t явился одним из первых методов титриметрического анализа. Впоследствии он был использован для весьма точного определения атомных весов галогенов и серебра.
По мере того как все больше и больше I- связывается Ag+, частицы AgI постепенно теряют адсорбированные ими 1_-ионы, и заряд их уменьшается. В конце концов заряд уменьшается настолько, что происходит коагуляция частиц и осаждение их в виде крупных творожистых хлопьев. Раствор при этом совершенно осветляется. Этот момент, называемый точкой просветления, в некоторой степени зависит от степени разбавления раствора иодида и от интенсивности перемешивания раствора при титровании.
При большом разбавлении раствора KI и сильном перемешивании точка просветления практически совпадает с точкой эквивалентности. Для количественного определения 1—ионов (или Ag+) раствор KI разбавляют приблизительно до концентрации 0,004 н. (например, к 20 мл
0,1 н. раствора прибавляют
500 мл воды) и титруют 0,1 н. раствором AgNO3 (прибавляя его небольшими порциями при энергичном перемешивании) до точки просветления.
Понятно, что в титруемом растворе не должно быть двух- или многозарядных катионов, так как они вызвали бы преждевременную коагуляцию золя AgI. Точно так же можно титровать до точки просветления раствор соли свинца молибдатом аммония (NH4)2Mo04 (при этом образуется осадок PbMoO4).
Методы с применением индикаторов
Наиболее часто при аргентометрическом титровании пользуются в качестве индикаторов растворами хромата калия K2CrO4 (в методе Мора) или железо-аммонийных квасцов NH4Fe(SO4J2 (в методе Фольга рда).
Применение K2CrO4 в качестве индикатора основано на способности CrO4- давать с Ag+ кирпично-красного цвета осадок Ag2CrO4, который в определенных условиях начинает выпадать лишь после того, как определяемые С1
-ионы будут практически полностью осаждены в виде AgCl.
Причина этого заключается в различии величин растворимости хлорида и хромата серебра.
Поэтому и осаждаться должен первым именно AgCl. Поскольку, однако, произведение [Ag+][Cl-] остается все время (приблизительно) постоянным, по мере осаждения Cl- в виде AgCl концентрация Ag+ в растворе должна постепенно повышаться *. При этом в конце концов окажется достигнутой и та концентрация Ag+-HOHOB, которая необходима для того, чтобы началось осаждение Ag2CrO4, 1,05- Ю-5 г-ион/л.
С этого момента наряду с AgCl начнет осаждаться также и Ag2CrO4, и взмученный в жидкости осадок приобретает красновато-бурую окраску, при получении которой заканчивают титрование.
Таким образом, в указанных условиях выпадение осадка Ag2CrO4 действительно начинается только после практически полного осаждения С1—ионов в виде AgCl.
Найденной выше концентрации остающихся в растворе С1—ионов отвечает величина рС1 =—Ig 1,05-10-6 « 5,03, лежащая внутри области скачка на кривой титрования (4—6). Это свидетельствует о. том, что данный индикатор при концентрации его
Ю-2 M дает возможность достаточно точно фиксировать точку эквивалентности при титровании.
Метод Мора применяют для определения серебра, хлоридов и бромидов (определять иодиды и роданиды этим методом нельзя, так как результаты сильно искажаются вследствие явлений адсорбции).
Что бы ни определялось по методу Мора — соли галогенов или соли серебра, порядок титрования должен быть всегда такой же, как при установлении титра раствора AgNO3. Другими словами, всегда нужно к измеренному объему раствора соли галогена приливать раствор соли серебра из бюретки, так как только в этом . случае получается резкое изменение окраски в конце титрования.
Нужно, далее, иметь в виду, что метод Мора применим только для титрования в нейтральной или слабощелочной среде (рН 6,5—10), так как Ag2CrO4 растворим в кислотах и в их присутствии не выпадает *.
Если анализируемый раствор имеет кислую реакцию, его нейтрализуют раствором тетрабората натрия Na2B4O7-IOH2O или бикарбоната натрия NaHCO3. Эти растворы не должны содержать примесей хлоридов, в чем необходимо убедиться, подействовав на небольшое количество раствора, подкисленного HNO3, AgNO3.
Другим условием применимости метода Мора является отсутствие в исследуемом растворе катионов, дающих с Сг04- осадки. Таковы, например, Ba2+, Pb2+, Bi3+ и др. Мешают также некоторые анионы, образующие осадки с Ag+ (например, PO4-, AsO4-, C2Q4-и т. п.). Все это сильно ограничивает применимость рассматриваемого метода. Более широкое применение имеет роданометрический метод (метод Фольгарда, роданометрия).
Это дает возможность титровать растворы солей серебра стандартным раствором NH4SCN (или KSCN) в присутствии индикатора— раствора соли железа (III), например железо-аммонийных квасцов NH4Fe(SO4)Z-12H2O.
* В сильнощелочной среде (рН > 10) образуется осадок Ag2O. В присутствии солей аммония диапазон рН должен быть сужен до 6,5—7,2, иначе выделяющийся аммиак будет связывать ионы серебра в комплекс [Ag(NH3)2]+. Понятно, что метод Мора неприменим также в присутствии солей, имеющих вследствие гидролиза кислую реакцию.
Пока не достигнута точка эквивалентности, концентрация остающихся в растворе SCN
hohob настолько мала, что образования комплексов железа, в частности Fe(SCN)2+, не происходит. Но первая же избыточная капля раствора NH4SCN повысит эту концентрацию настолько, что указанная реакция произойдет и раствор приобретет более или менее интенсивную оранжево-красную окраску.
Применяя способ обратного титрования (титрование по остатку), этот метод можно использовать также и для определения бромидов и хлоридов. Например, роданометрическое определение бромидов проводится по схеме:
Br- + Ag+ (избыток) —>•AgBr + Ag+ (остаток)
Ag+ (остаток) + SCN- —► AgSCN (титрование)
Так же определяются и хлориды.
Конец титрования можно сделать более отчетливым, прибавляя к титруемому раствору 1—2 мл нитробензола C6H5NO2, четыреххлористого углерода CCl4 или хлороформа CHCl3. Эти вещества, адсорбируясь на поверхности осадка AgCl, сильно замедляют реакцию между ним и роданидными комплексами железа.
Еще лучше к исследуемому раствору хлорида в мерной колбе прилить измеренный избыток стандартного раствора AgNO3 и разбавить водой до метки. После этого часть раствора фильтруют через сухой фильтр и измеренный пипеткой объем фильтрата титруют раствором роданида. В этом случае осадок AgCl оказывается отделенным от раствора и помешать титрованию не может.
На практике в качестве индикатора применяют насыщенный раствор железо-аммонийных квасцов NH4Fe(SO4J2• 12H2O с небольшим количеством концентрированной HNO3 для подавления гидролиза, вследствие которого раствор приобретает бурую окраску.
В отличие от метода Мора в этом методе присутствие кислоты не только не вредит титрованию, но, наоборот, способствует получению более точных результатов.
Источник