Титриметрический анализ. Химический эквивалент вещества. Молярная концентрация эквивалента вещества. Закон эквивалентов. Точка эквивалентности и способы её фиксирования.
Титриметрический анализ — метод количественного анализа, основанный на измерении объёма раствора с точно известной концентрацией реактива, требующегося для реакции с данным количеством определяемого вещества (см. также Объёмный анализ).
Химический эквивалент— это некая реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
Фактор эквивалентности может быть равен или меньше единицы: fэкв.= 1/z, где z – основность кислоты или кислотность основания в данной кислотно-основной реакции, число отданных или принятых электронов в окислительно-восстановительных реакциях.
Молярная концентрация эквивалента C(l/z X) показывает количество вещества эквивалента (в молях), которое содержится в 1 л раствора. C(l/z X) равна отношению количества вещества эквивалента в растворе к объему этого раствора.
Закон эквивалентов —Вещества реагируют друг с другом в количествах, равных их эквивалентвм,
Точка эквивалентности (в титриметрическом анализе) — момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце.
В ряде случаев окислительно-восстановительного титрования точки эквивалентности фиксируют по изменению окраски титруемого раствора, вызываемой избытком окрашенного стандартного раствора (например, перманганата).
Теоретические основы кислотно-основного титрования (метод нейтрализации). Рабочие растворы, индикаторы. Кривые титрования, выбор индикатора. Расчет молярной концентрации эквивалента и титра растворов кислот и щелочей в методе нейтрализации.
Кислотно-основное титрование — это титриметрический метод анализа, основанный на взаимодействии кислот и оснований. В качестве титрантов могут применяться сильные кислоты (ацидиметрия) или сильные основания (алкалиметрия). Прямым титрованием определяют концентрацию кислот или оснований или содержание элементов, входящих в их состав.Обратным титрованием или косвенными методами находят содержание некоторых солей(например, солей аммония или кальция).
Индикаторами называются вещества, изменяющие свою окраску в зави-симости от pH среды. По своей химической природе индикаторы представ-ляют собой с л а б ы е кислоты HJnd или с л а б ы е основания JndOH, у которых молекулярная и ионная формы имеют различную окраску.
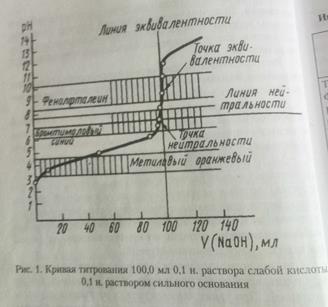
Для построения кривой титрования рассчитывают рН в различные моменты титрования по формулам, приведенным выше. Кривая титрования характеризуется резким изменением рН в близи точки эквивалентности, которую называют скачком титрования. Чем больше скачок, тем точнее можно оттитровать определяемое вещество. По величине скачка выбирают индикатор. Основное правило выбора индикатора. Для каждого данного титрования можно применять только такие индикаторы, показатель титрования которых (рТ индикатора) лежит в пределах скачка рН на кривой титрования.
При кислотно-основном титровании наиболее точные результаты получаются при работе с 0, 1 н. растворами кислот и щелочей. При таких концентрациях на кривой титрования наблюдается 

Скачок титрования-резкое изменение рН раствора вблизи точки эквивалентности. Скачок титрования вызван добавлением в титруемому раствору слабой кислоты при титровании последней капли щелочи. Величиной скачка титрования считают изменение рН раствора между состояниями, когда раствор недотитрован и перетитрован на 0,1%. Точка эквивалентности лежит в середине скачка титрования.
Для установления точки эквивалентности в титрометрическом анализе применяют индикаторы. Индикаторы метода нейтрализации – сложные органические вещества со слабыми кислотами или основными свойствами, имеющие различную окраску молекулярной и ионизированной форм. Индикаторы меняют окраску в зависимости от рН раствора. Интервал значений рН, в которым индикатор меняет свою окраску, называют интервалом перехода окраски индикатора.
При выборе индикатора руководствуются основными правилом: интервал перехода окраски индикатора должен укладываться в интервал значений рН скачка титрования в данном случае.
Согласно этому, для определения эквивалентной точки в условиях задачи надо использовать индикаторы, интервал перехода окраски которых лежит в пределах рН от 8,0 до 10,0; например, фенолфталеин, тимолфталеин.
При этом следует учитывать особенности зрительного аппарата человека, который более четко воспринимает переход окраски раствора от более светлой к более темной, чем наоборот.
Поэтому в данной задаче использовать в качестве индикаторы фенолфталеин, в присутствии которого осуществляется переход окраски растворы от бесцветной к малиновой.
Оксидиметрия. Перманганатометрия. Рабочие растворы, индикаторы. Химические реакции, лежащие в основе метода. Расчет молярной концентрации эквивалента и титра растворов окислителей и восстановителей в методе оксидиметрии.
Оксидиметрия( от нем. oxydiren — окислять и . метрия) — титриметрические методы в аналитической химии, основанные на реакциях окисления-восстановления. В процессе титрования изменяется окислительно-восстановительный потенциал системы, вблизи точки эквивалентности наблюдается резкое изменение потенциала.
Перманганатометрией называется метод объемного анализа, в котором в качестве рабочего раствора применяют перманганат калия КМп04. Перманганат калия является сильным окислителем, особенно в кислой среде.

Оксидиметрия. Йодометрия. Рабочие растворы, индикаторы. Химические реакции, лежащие в основе метода. Расчет молярной концентрации эквивалента и титра растворов окислителей и восстановителей в методе йодометрии.
Оксидиметрия ( от нем. oxydiren — окислять и . метрия) — титриметрические методы в аналитической химии, основанные на реакциях окисления-восстановления. В процессе титрования изменяется окислительно-восстановительный потенциал системы, вблизи точки эквивалентности наблюдается резкое изменение потенциала. Оксидиметрию классифицируют в зависимости от применяемого в данной реакции раствора вещества — окислителя или восстановителя. К оксидиметрии относятся перманганатометрия, цериметрия, хроматометрия иодометрия и др.
1. Определение окислителей. Методом йодометрии можно определять те окислители, которые количественно окисляют 1
в свободный 12. Чаще всего определяют перманганаты, бихроматы, соли меди (II), соли железа (III), свободные галогены и др.
Окислитель реагирует с избытком йодида калия КД в кислой среде. При этом выделяется количество йода, эквивалентное количеству окислителя. Выделившийся йод титруют раствором тиосульфата натрия точно известной нормальности. Таким образом, можно рассчитать количество определяемого окислителя, которое будет эквивалентно количеству тиосульфата, пошедшего на титрование йода. Следовательно, рабочим раствором в этом методе будет раствор тиосульфата натрия
Индикатором в методе йодометрии служит раствор крахмала. Это чувствительный и специфический индикатор, образующий с йодом адсорбционное соединение синего цвета. Однако употребление этого индикатора имеет некоторые особенности. Во-первых, раствор крахмала необходимо прибавлять в самом конце титрования, когда йода останется очень мало и титруемый раствор будет иметь светло-желтую окраску. Если прибавить крахмал раньше, когда йода в растворе еще много, то образующееся соединение йода с крахмалом очень медленно реагирует с тиосульфатом и раствор легко перетитровать. Вторая особенность обусловлена тем, что в данном случае мы титруем не до появления окраски (как это обычно бывает), а до исчезновения окраски. Поэтому вблизи точки конца титрования необходимо прибавлять раствор не более чем по одной капле, после каждой капли тщательно перемешивать раствор и ждать 3—5 с. Если не соблюдать это условие, раствор очень легко перетитровать.
2. Определение восстановителей. Из числа восстановителей этим методом чаще всего определяют сульфиты, сульфиды, хлорид олова (II) и др. Рабочим раствором является раствор йода 12. В качестве исходного вещества для установки титра раствора йода применяют мышьяковистый ангидрид As203, который растворяют в щелочи п получают арсенит (ион As02). Титрование проводят в очень слабощелочной среде (рН
Дата добавления: 2016-02-02 ; просмотров: 6499 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Портал аналитической химии
Методики, рекомендации, справочники
Метод равного помутнения (Гей-Люссака). Если титровать раствор NaBr раствором AgNOe (или наоборот), то происходит реакция:
,Очевидно, что осадок AgBr выпадает только до тех пор, пока в растворе еще имеется избыток Br-. Поэтому, отбирая в .конце титрования небольшие порции титруемого раствора и прибавляя к ним одну каплю разбавленного в 10 раз раствора AgN03, можно
точно уловить момент прекращения образования осадка. В данном случае это сильно облегчается потому, что вблизи точки эквивалентности осадок AgBr, коагулируя, собирается на дне сосуда в виде крупных творожистых хлопьев. Раствор при этом быстро осветляется, чему способствует энергичное перемешивание или встряхивание его.
При осаждении AgCl у которого произведение растворимости (1,78•1O-10) не так мало, как у AgBr (5,6•1O-13), методику работы приходится несколько усложнять. Дело в том, что насыщенный раствор AgCl, получающийся в точке эквивалентности, дает отчетливое помутнение как с раствором AgNO3, так и с раствором NaCl (понижение растворимости AgCl от введения одноименных ионов).
-ионов, то помутнение при добавлении AgNO3 будет, очевидно, большим, чем при добавлении NaCl. Наоборот, если раствор немного перетитрован, то NaCl вызовет более сильное помутнение, чем AgNO3.
Следовательно, для фиксирования точки эквивалентности здесь приходится перед концом титрования отбирать по две одинаковые пробы раствора и действовать на одну из них каплей раствора AgNO3, на другую — каплей раствора NaCl такой же концентрации. Титрование заканчивают при получении одинаковой интенсивности помутнения обеих проб.
«Метод равного помутнения», несмотря на то что приходится отбирать для проб некоторую часть титруемого раствора, является одним из точнейших методов титриметрического анализа. Однако он требует навыка и довольно кропотлив. Поэтому на практике обычно пользуются аргентометрическими методами с применением индикаторов.
Титрование до точки просветления. Метод титрования до точки просветления может быть применен тогда, когда малорастворимое соединение в процессе титрования находится в коллоидном состоянии. Например, при титровании I- раствором соли серебра, частицы AgI, адсорбируя I-, получают отрицательные заряды (см. § 27). Наличие зарядов, как известно, препятствует объединению частиц в более крупные агрегаты и оседанию их на дно сосуда. Вследствие этого при титровании сначала образуется не осадок, а коллоидный раствор AgI.
* Как будет показано позже, при рассмотрении титрования с внешними индикаторами ошибку, связанную с отбором проб, можно сделать исчезающе малой. Метод равного помутнения, предложенный в 1832 г. Гей-Люссаком, t явился одним из первых методов титриметрического анализа. Впоследствии он был использован для весьма точного определения атомных весов галогенов и серебра.
По мере того как все больше и больше I- связывается Ag+, частицы AgI постепенно теряют адсорбированные ими 1_-ионы, и заряд их уменьшается. В конце концов заряд уменьшается настолько, что происходит коагуляция частиц и осаждение их в виде крупных творожистых хлопьев. Раствор при этом совершенно осветляется. Этот момент, называемый точкой просветления, в некоторой степени зависит от степени разбавления раствора иодида и от интенсивности перемешивания раствора при титровании.
При большом разбавлении раствора KI и сильном перемешивании точка просветления практически совпадает с точкой эквивалентности. Для количественного определения 1—ионов (или Ag+) раствор KI разбавляют приблизительно до концентрации 0,004 н. (например, к 20 мл
0,1 н. раствора прибавляют
500 мл воды) и титруют 0,1 н. раствором AgNO3 (прибавляя его небольшими порциями при энергичном перемешивании) до точки просветления.
Понятно, что в титруемом растворе не должно быть двух- или многозарядных катионов, так как они вызвали бы преждевременную коагуляцию золя AgI. Точно так же можно титровать до точки просветления раствор соли свинца молибдатом аммония (NH4)2Mo04 (при этом образуется осадок PbMoO4).
Методы с применением индикаторов
Наиболее часто при аргентометрическом титровании пользуются в качестве индикаторов растворами хромата калия K2CrO4 (в методе Мора) или железо-аммонийных квасцов NH4Fe(SO4J2 (в методе Фольга рда).
Применение K2CrO4 в качестве индикатора основано на способности CrO4- давать с Ag+ кирпично-красного цвета осадок Ag2CrO4, который в определенных условиях начинает выпадать лишь после того, как определяемые С1
-ионы будут практически полностью осаждены в виде AgCl.
Причина этого заключается в различии величин растворимости хлорида и хромата серебра.
Поэтому и осаждаться должен первым именно AgCl. Поскольку, однако, произведение [Ag+][Cl-] остается все время (приблизительно) постоянным, по мере осаждения Cl- в виде AgCl концентрация Ag+ в растворе должна постепенно повышаться *. При этом в конце концов окажется достигнутой и та концентрация Ag+-HOHOB, которая необходима для того, чтобы началось осаждение Ag2CrO4, 1,05- Ю-5 г-ион/л.
С этого момента наряду с AgCl начнет осаждаться также и Ag2CrO4, и взмученный в жидкости осадок приобретает красновато-бурую окраску, при получении которой заканчивают титрование.
Таким образом, в указанных условиях выпадение осадка Ag2CrO4 действительно начинается только после практически полного осаждения С1—ионов в виде AgCl.
Найденной выше концентрации остающихся в растворе С1—ионов отвечает величина рС1 =—Ig 1,05-10-6 « 5,03, лежащая внутри области скачка на кривой титрования (4—6). Это свидетельствует о. том, что данный индикатор при концентрации его
Ю-2 M дает возможность достаточно точно фиксировать точку эквивалентности при титровании.
Метод Мора применяют для определения серебра, хлоридов и бромидов (определять иодиды и роданиды этим методом нельзя, так как результаты сильно искажаются вследствие явлений адсорбции).
Что бы ни определялось по методу Мора — соли галогенов или соли серебра, порядок титрования должен быть всегда такой же, как при установлении титра раствора AgNO3. Другими словами, всегда нужно к измеренному объему раствора соли галогена приливать раствор соли серебра из бюретки, так как только в этом . случае получается резкое изменение окраски в конце титрования.
Нужно, далее, иметь в виду, что метод Мора применим только для титрования в нейтральной или слабощелочной среде (рН 6,5—10), так как Ag2CrO4 растворим в кислотах и в их присутствии не выпадает *.
Если анализируемый раствор имеет кислую реакцию, его нейтрализуют раствором тетрабората натрия Na2B4O7-IOH2O или бикарбоната натрия NaHCO3. Эти растворы не должны содержать примесей хлоридов, в чем необходимо убедиться, подействовав на небольшое количество раствора, подкисленного HNO3, AgNO3.
Другим условием применимости метода Мора является отсутствие в исследуемом растворе катионов, дающих с Сг04- осадки. Таковы, например, Ba2+, Pb2+, Bi3+ и др. Мешают также некоторые анионы, образующие осадки с Ag+ (например, PO4-, AsO4-, C2Q4-и т. п.). Все это сильно ограничивает применимость рассматриваемого метода. Более широкое применение имеет роданометрический метод (метод Фольгарда, роданометрия).
Это дает возможность титровать растворы солей серебра стандартным раствором NH4SCN (или KSCN) в присутствии индикатора— раствора соли железа (III), например железо-аммонийных квасцов NH4Fe(SO4)Z-12H2O.
* В сильнощелочной среде (рН > 10) образуется осадок Ag2O. В присутствии солей аммония диапазон рН должен быть сужен до 6,5—7,2, иначе выделяющийся аммиак будет связывать ионы серебра в комплекс [Ag(NH3)2]+. Понятно, что метод Мора неприменим также в присутствии солей, имеющих вследствие гидролиза кислую реакцию.
Пока не достигнута точка эквивалентности, концентрация остающихся в растворе SCN
hohob настолько мала, что образования комплексов железа, в частности Fe(SCN)2+, не происходит. Но первая же избыточная капля раствора NH4SCN повысит эту концентрацию настолько, что указанная реакция произойдет и раствор приобретет более или менее интенсивную оранжево-красную окраску.
Применяя способ обратного титрования (титрование по остатку), этот метод можно использовать также и для определения бромидов и хлоридов. Например, роданометрическое определение бромидов проводится по схеме:
Br- + Ag+ (избыток) —>•AgBr + Ag+ (остаток)
Ag+ (остаток) + SCN- —► AgSCN (титрование)
Так же определяются и хлориды.
Конец титрования можно сделать более отчетливым, прибавляя к титруемому раствору 1—2 мл нитробензола C6H5NO2, четыреххлористого углерода CCl4 или хлороформа CHCl3. Эти вещества, адсорбируясь на поверхности осадка AgCl, сильно замедляют реакцию между ним и роданидными комплексами железа.
Еще лучше к исследуемому раствору хлорида в мерной колбе прилить измеренный избыток стандартного раствора AgNO3 и разбавить водой до метки. После этого часть раствора фильтруют через сухой фильтр и измеренный пипеткой объем фильтрата титруют раствором роданида. В этом случае осадок AgCl оказывается отделенным от раствора и помешать титрованию не может.
На практике в качестве индикатора применяют насыщенный раствор железо-аммонийных квасцов NH4Fe(SO4J2• 12H2O с небольшим количеством концентрированной HNO3 для подавления гидролиза, вследствие которого раствор приобретает бурую окраску.
В отличие от метода Мора в этом методе присутствие кислоты не только не вредит титрованию, но, наоборот, способствует получению более точных результатов.
Источник