Термические способы получения магния
Термические способы получения магния основаны на восстановлении его из оксидов или других соединений более активным металлом, обладающим большим сродством к кислороду, чем магний.
Магний имеет высокое сродство к кислороду, и его оксид относится к числу очень прочных оксидов (см. рис. 34, 36). По этой причине выбор восстановителя и условий восстановления при получении магния термическим способом — задача очень трудная, несмотря на кажущуюся простоту технологии.
В качестве восстановителя для оксида магния можно использовать кремний, алюминий, силикоалюминий и карбиды кальция, алюминия и других металлов, а также углерод. При этом восстановление возможно только при температурах, когда магний будет находиться в парообразном состоянии, т.е. выше точки его кипения (1107°С). Снижению температуры восстановления способствует пониженное давление (вакуум).
Восстановление оксида магния с помощью металлов или сплавов в общем виде выражается уравнением
В металлургии магния возможны два способа металлотермического восстановления:
1. силикотермический и
Кремний по экономическим соображениям лучше использовать в форме ферросилиция. Использование алюминия ввиду его высокой стоимости нецелесообразно. Реакция восстановления карбидами выражается уравнением:
Характерной особенностью металлотермического и карбидотермического восстановления является то, что из продуктов реакций только магний находится в парообразном состоянии. Это позволяет легко отделить его от твердых фаз путем удаления из зоны реакции паров магния и конденсации их в охлаждаемой зоне печи.
В настоящее время из перечисленных разновидностей термических способов получения магния только силикотермический используется в промышленности. Производство магния углетермическим и карбидотермическим способами прекращено и представляет исторический интерес. Поэтому остановимся на рассмотрении только силикотермического процесса.
Источник
Термическое получение магния
Во время второй мировой войны в ряде стран применяли два термических способа получения магния — углетермический и силикотермический.
Углетермический способ получения магния
Восстановление окиси магния углеродом можно представить уравнением
причем равновесие в этой реакции определяется равенством давлений диссоциации
и давлением паров магния.
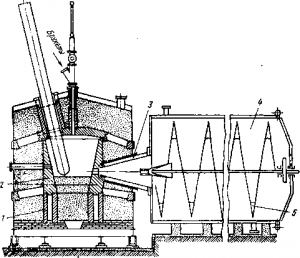
Рис. Дуговая печь для восстановления магния
Смещение реакции вправо, т. е. восстановление, станет возможным, если давление диссоциации окиси магния будет больше, чем давление диссоциации окиси углерода, в противном случае будет происходить окисление магния. Как следует из предыдущих глав, аналогичным путем получают никель, свинец, олово и т. д. Эти металлы обладают срав нительно небольшим сродством к кислороду и поэтому их окислы восстанавливаются углеродом при температурах, лежащих ниже точки их кипения.
Окиси легких, металлов (алюминия, магния и т. д.) имеют большое сродство к кислороду и поэтому они могут восстанавливаться углеродом только при очень высоких температурах, обычно превышающих точку кипения металла, и поэтому легкие металлы в момент восстановления находятся в парообразном состоянии.
Если металлы в процессе восстановления получаются в расплавленном или твердом виде, они быстро и легко отделяются от газообразных продуктов реакции, и обратное окисление при охлаждении вследствие небольшой поверхности и малого сродства к кислороду происходит в малой степени.
Если же металл в процессе восстановления получается в парообразном состоянии, его необходимо охладить ниже точки росы, чтобы отделить от окислов углерода.
При восстановлении окиси магния углеродом равновесная температура, ниже которой начинается реакция окисления паров магния, равна примерно 1900° С, а точка росы магния лежит значительно ниже 1000° С Таким образом, до того, как представится возможность разделить продукты реакции восстановления окиси магния углеродом, необходимо эти продукты, находящиеся в неравновесном состоянии, охладить более чем на 1000° С. Однако при температуре ниже 1900° С продукты начинают быстро взаимодействовать между собой и пары магния вновь окисляются окисью углерода.
Есть ряд приемов предотвращения обратного взаимодействия продуктов реакции, например разбавление их нейтральным газом, резкое охлаждение до температуры, при которой скорость взаимодействия продуктов реакции невелика, поглощение паров восстановленного металла каким-либо другим расплавленным металлом.
В практике углетермического способа получения магния применяют резкое охлаждение продуктов реакции.
Исследования показали, что магний и окись углерода заметно взаимодействуют лишь при температурах выше 300° С. Поэтому, если резко охладить продукты реакции до температуры ниже 250° С, то можно получить магниевый порошок, причем выход металлического магния при этом зависит от скорости охлаждения, которая исчисляется долями секунды.
Рассмотрим кратко технологию этого способа. Окись магния и нефтяной кокс дозируют и совместно размалывают. Молотую шихту брикетируют и подают в трехфазную дуговую печь мощностью 800 кВт (рис.). Восстановление протекает в атмосфере водорода, поэтому печь имеет герметичный стальной кожух с крышкой. Внутри кожуха нa угольных подставках 1 установлены угольные блоки 2, образующие рабочее пространство печи объемом около 4 м 3 . Через свод в печь вводят три графитовых электрода. Брикеты загружают через свод печи с помощью питателей и трубки из жаропрочной стали.
Ответственной деталью печи является конус охлаждения 3. Головка конуса должна находиться как можно ближе к рабочему пространству печи и поэтому ее изготовляют из жаропрочной стали. В головку конуса подают охлаждающую газовую смесь. В качестве газа-охладителя рекомендуется использовать тщательно очищенный водород либо природные горючие газы. Из конуса охлаждения газы, содержащие около 30 г/м 3 пыли, поступают в холодильник 4 (диаметр 4,6 м, длина 10 м), снабженный водяной рубашкой. В нем оседает около 20% магниевой пыли и охлаждаются до 120° С газы. Удаление осевшей пыли из холодильников осуществляется с помощью шнека 5. Основная масса магниевой пыли уносится газами в теплообменник и затем после их охлаждения до 80° С улавливается в мешочных фильтрах. Пыль содержит приблизительно 50% Mg (металлического), 20% С и 30% MgO. Пыль брикетируют и путем сублимации из нее отгоняют металлический магний. Кристаллы сублимата магния затем переплавляют.
Чистота магния после переплавки составляет 99,97%. Общий расход энергии равен около 21 кВт•ч на 1 кг Mg.
Статья на тему Термическое получение магния
Источник
Производство магния
В современном машиностроении магний находит широкое применение главным образом как основа легких сплавов. Для получения металлического магния применяют два способа — электролитический и термический. В качестве исходных материалов используют магнезит, доломит, карналлит и бишофит. Магнезит является карбонатом магния (MgCO3), содержащий 28,8% Mg. В природном магнезите, кроме MgCO3, обычно содержатся окислы кремния, железа, алюминия и кальция. В нашей стране имеются большие залежи магнезита на Урале (Саткинское и Халиловское месторождения).
Доломит представляет собой двойной карбонат магния и кальция (MgCO3*CaCO3), содержащий 13,2% Mg. Доломит содержит примеси в виде кварца, кальцита, гипса и др. Наиболее крупные промышленные месторождения доломита находятся в Московской области, на Урале и на Украине.
Карналлит является природным хлоридом магния и калия (MgCl2*KCl*6Н2O), в зависимости от содержания тех или иных примесей имеет розовый, желтый или серый цвет. Карналлит является гигроскопическим материалом, активно поглощающим влагу. В карналлите содержится 8,8% Mg. Крупнейшие залежи карналлита находятся на Урале (Соликамское месторождение).
Бишофит представляет собой хлорид магния (MgCl2*6Н2О), в природе содержится в морской воде, около 0,3% в воде соляных озер. В некоторых озерах нашей страны, например озера Перекопской группы, к концу лета содержание MgCl2 достигает 15%. Бишофит также получают при переработке природного карналлита.
Электролитическим способом получают магний из хлоридов магния.
Для этой цели магнезит или доломит подвергают обжигу при температурах 700—800° С. Во время обжига магнезит диссоциирует
Хлорирование окиси магния осуществляют в шахтных электрических печах, футерованных шамотным кирпичом. Во время хлорирования в печь, кроме окиси магния, загружают угольные цилиндрики, а через фурмы, расположенные внизу печи, подают хлор. Электроды в печи располагают друг к другу под углом 120°. При работе печи развивается максимальная температура до 1000° C. В печи образовавшийся хлористый магний расплавляется и периодически, через 3—4 часа, выпускается в ковш с плотно закрывающейся крышкой и в последнем транспортируется в цех электролиза.
Карналлит подвергают обезвоживанию и расплавлению. Обезвоживание обычно производят в трубчатых вращающихся печах при температуре газов на входе до 450° С и на выходе до 220° С. Плавление ведут в трехфазных электропечах при температуре 750—800° С. Во время выдержки из расплава оседает на дно печи MgO, а в расплаве остается до 50% MgCl2, 0,5—0,7% MgO, остальное KCl и NaCl. Полученный расплав направляют на электролиз. Бишофит также подвергают обезвоживанию и расплавлению.
Получение магния из хлоридов магния ведут в электролизных ваннах. Схема электролизера приведена на рис. 22. В ван не анодами являются графитовые электроды, катодами — стальные пластины. Электролитом служит расплав солей MgCl2, KCl, NaCl, CaCl2. Во время электролиза электрический ток, проходя через электролит, нагревает его до температуры 700—750° С. При этих температурах MgCl2 разлагается и в катодном пространстве выделяется магний, а в анодном хлор. Плотность электролита больше плотности магния, поэтому магний всплывает на поверхность ванны. Отсюда магний при помощи вакуума перекачивается в ковш. Выделяющийся хлор отсасывают через хлоропровод. В процессе электролиза образующаяся окись магния и восстановленное железо осаждаются на дно ванны. Их периодически удаляют.
При электролизе расходуется 20—25 кг электродов и 15000—17000 квт*ч электроэнергии на 1 т магния.
Полученный процессом электролиза магний обычно содержит примеси: Fe, Na, К, CaCl2, MgCl2, NaCl, KCl, MgO. Примеси отрицательно влияют на механические свойства и коррозионную стойкость магния. Поэтому электролитический магний рафинируют.
Рафинирование магния производят или переплавкой с флюсами или возгонкой магния.
Рафинирование магния переплавкой с флюсами производят в электропечах сопротивления или при пламенном обогреве со стационарным или выемным тиглем. Печь футеруют шамотным кирпичом, а тигли изготовляют из чугуна или стали. В качестве флюса используют хлористые и фтористые соли (MgCl2; KCl; BaCl; NaCl; CaCl; CaF). После расплавления и нагрева металла до 700— 750° С его перемешивают с флюсом. Затем металл охлаждают до 690—710° С и из-под слоя шлака разливают в чушки. Этот способ рафинирования дает возможность очищать магний только от неметаллических примесей. После рафинирования получают металл с содержанием 99,85—99,9% Mg.
Рафинирование магния возгонкой основано на значительной упругости паров его. Упругость паров примесей, к которым относятся железо, кремний, медь и алюминий, меньше упругости паров магния.
Рафинирование возгонкой ведут в герметически закрытых ретортах со ступенчатым вакуумом (рис. 23). При температуре 600° С и остаточном давлении 0,1—0,2 мм рт. ст. магний испаряется. В зоне конденсации при температуре 450—500° С магний оседает на стенках реторты в виде друз — чистых блестящих кристаллов.
Друзы магния отделяются, затем переплавляются, после чего магний разливается на чушки. Металл содержит 99,99% Mg.
Электролитический способ получения магния является трудоемким и вредным производством. Поэтому в последние годы находят применение термические способы получения магния. Термические способы подразделяются на силикотермический, карбидно-термический и углетермический. В основу этих способов положены процессы восстановления магния из обожженного магнезита или доломита. При силикотермическом способе восстановителем служит кремний. Восстановление магния происходит по следующей реакции:
В качестве исходного материала используют доломит, ферросилиций или сплавы кремния с алюминием. Восстановление ведут в ретортах из нержавеющей стали под вакуумом до 0,1 ат, соединенных с кристаллизаторами. Реторты нагревают в электропечах или пламенем за счет сжигания топлива. При нагреве материала до 1100—1200° С в вакууме магний восстанавливается, испаряется и конденсируется (кристаллизуется) на стенках в кристаллизаторах. В реторту загружают 3,5—4,0 г шихты и получают 500—600 кг магния. На восстановление магния из 5 г доломита расходуют 1 г 75%-ного ферросилиция.
При карбидно-термическом способе в качестве исходных материалов используют магнезит и карбид кальция. В процессе нагрева такой смеси в ретортах под вакуумом до 1100—1200°С протекает реакция
Магний, испаряясь в кристаллизаторе, конденсируется, окись углерода отводится, а окись кальция остается в реторте в виде твердой фазы.
Восстановление магния углетермическим способом ведут в специальных дуговых печах при температуре выше 2000° С. При этих температурах протекает реакция
Источник
Магний: способы получения и химические свойства
Магний Mg — это щелочной металл. Серебристо-белый, относительно мягкий, пластичный, ковкий металл. На воздухе покрыт оксидной пленкой. Сильный восстановитель.
Относительная молекулярная масса Mr = 24,305; относительная плотность для твердого и жидкого состояния d = 1,737; tпл = 648º C; tкип = 1095º C.
Способ получения
1. В результате электролиза расплава хлорида магния образуются магний и хлор :
2. Нитрид магния разлагается при 700 — 1500º С образуя магний и азот:
3. Оксид магния легко восстанавливается углеродом при температуре выше 2000º С, образуя магний и угарный газ:
MgO + C = Mg + CO
4. Оксид магния также легко восстанавливается кальцием при 1300º С с образованием магния и оксида кальция:
MgO + Ca = CaO + Mg
Качественная реакция
Качественной реакцией для магния является взаимодействие соли магния с любой сильной щелочью, в результате которой происходит выпадение студенистого осадка:
1. Хлорид магния взаимодействует с гидроксидом калия и образует гидроксид магния и хлорид калия:
MgCl2 + 2KOH = Mg(OH)2 + 2KCI
Химические свойства
1. Магний — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Магний взаимодействует с азотом при 780 — 800º С образуя нитрид магния:
1.2. Магний сгорает в кислороде (воздухе) при 600 — 650º С с образованием оксида магния:
2Mg + O2 = 2MgO
1.3. Магний активно реагирует при комнатной температуре с влажным хлором . При этом образуется хлорид магния :
1.4. С водородом магний реагирует при температуре 175º C, избыточном давлении и в присутствии катализатора MgI2 с образованием гидрида магния:
2. Магний активно взаимодействует со сложными веществами:
2.1. Магний реагирует с горячей водой . Взаимодействие магния с водой приводит к образованию гидроксида магния и газа водорода:
2.2. Магний взаимодействует с кислотами:
2.2.1. Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния и водород :
Mg + 2HCl = MgCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду:
2.2.3. В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород:
Mg + H2S = MgS + H2
2.3. Магний вступает в реакцию с газом аммиаком при 600 — 850º С. В результате данной реакции образуется нитрид магния и водород:
2.4. Магний может вступать в реакцию с оксидами :
2.4.1. В результате взаимодействия магния и оксида азота (IV) при температуре 150º С в вакууме, в этилацетилене образуется нитрат магния и оксид азота (II):
2.4.2. Магний взаимодействует с оксидом кремния при температуре ниже 800º С в атмосфере водорода образуя силицид магния и оксид магния:
4Mg + SiO2 = Mg2Si + MgO,
а если температуру поднять до 1000º С, то в результате реакции образуется кремний и оксид магния:
2Mg + SiO2 = Si + 2MgO
Источник










