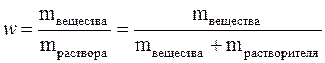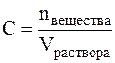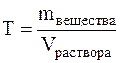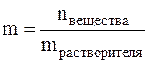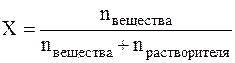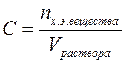Способы выражения состава растворов



Состав любого раствора может быть выражен как качественно, так и количественно. Обычно, при качественной оценке раствора применяют такие понятия как, насыщенный, ненасыщенный, пересыщенный (или перенасыщенный), концентрированный и разбавленный раствор.
Насыщенным называется раствор, в котором содержится максимально возможное при данных условиях (t, р) количество растворённого вещества. Насыщенный раствор часто находится в состоянии динамического равновесия с избытком растворённого вещества, при котором процесс растворения и процесс кристаллизации (выпадения вещества из раствора) протекают с одинаковой скоростью.
Для приготовления насыщенного раствора растворение вещества необходимо вести до образования осадка, не исчезающего при длительном хранении.
Ненасыщенным называется раствор, который содержит вещества меньше, чем его может раствориться при данных условиях.
Перенасыщенные растворы содержат в себе по массе больше растворённого вещества, чем его может раствориться в данных условиях. Образуются перенасыщенные растворы при быстром охлаждении насыщенных растворов. Они неустойчивы и могут существовать ограниченное время. Очень быстро лишнее растворённое вещество выпадает в осадок, а раствор превращается в насыщенный.
Следует отметить, что при изменении температуры насыщенный и ненасыщенный растворы могут легко обратимо превращаться друг в друга. Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Кристаллизация и растворение играют огромную роль в природе: приводят к образованию минералов, имеют большое значение в атмосферных и почвенных явлениях. На основе кристаллизации в химии распространён метод очистки веществ, который называется перекристаллизацией.
Для приблизительного количественного выражения состава раствора используют понятия концентрированный и разбавленный растворы.
Концентрированным называется раствор, в котором масса растворённого вещества соизмерима с массой растворителя, т.е. не отличается от него более чем в 10 раз.
Если же масса растворённого вещества более чем в десять раз меньше массы растворителя, то такие растворы называются разбавленными.
Однако следует помнить, что деление растворов на концентрированные и разбавленные условно, и чёткой границы между ними нет.
Точный количественный состав растворов выражают при помощи массовой доли растворённого вещества, его молярной концентрации, а также некоторыми другими способами.
Массовая доля растворённого вещества (w) – это безразмерная физическая величина, равная отношению массы растворённого вещества к общей массе раствора,т.е.
Обычно выражается в долях единицы или в процентах. Массовая доля, выраженная в %, называется процентной концентрацией. Она показывает, какая масса вещества растворена в 100 г раствора.
Молярная концентрация (С) или молярность – это величина, равная отношению количества растворённого вещества к объему раствора (в литрах), т.е.
Молярность измеряется в моль/л и показывает сколько моль вещества растворено в одном литре раствора. Молярность обозначается обычно буквой М. Если в одном литре раствора содержится 1 моль вещества, то такой раствор называется одномолярным (1М), если 0,1 моль вещества – децимолярным (0,1М), если 0,01 моль вещества – сантимолярным (0,01М), если 0,001 моль вещества – миллимолярным (0,001М).
Титром (Т) называется отношение массы вещества в граммах к объёму раствора в мл, т.е.
Титр имеет размерность г/мл, он показывает, сколько грамм вещества растворено в 1 мл раствора.
Моляльная концентрация или моляльность (m) – это величина, равная отношению количества растворённого вещества к массе растворителя, выраженной в кг, т.е.
Моляльность имеет размерность моль/кг и показывает, какое количество вещества растворено в 1 кг растворителя.
Мольная доля (Х) – это величина, равная отношению количества растворённого вещества к общему количеству вещества в растворе:
Мольная доля – это безразмерная величина и измеряется в долях единицы или в %.
Молярная концентрация химического эквивалента вещества (С) или нормальная концентрация – это величина, равная отношению количества химического эквивалента растворённого вещества к объему раствора (в литрах), т.е.

Молярная концентрация химического эквивалента вещества измеряется в моль/л и показывает сколько моль эквивалента вещества растворено в одном литре раствора. Она обозначается обычно буквой н. Если в одном литре раствора содержится 1 моль химического эквивалентавещества, то такой раствор называется однонормальным (1н), если 0,1 моль вещества – децинормальным (0,1н), если 0,01 моль вещества – сантинормальным (0,01н), если 0,001 моль вещества – миллинормальным (0,001н).
Источник
Конспект урока по химии на тему «Способы выражения состава растворов»
Тема: Способы выражения состава растворов (Расчеты концентраций растворов).
Мотивация изучения темы: Растворы играли и играют важнейшую роль в возникновении и развитии живой природы. В растворах формировались простейшие белковые структуры — коацерваты, в дальнейшем водоросли, что обусловило возникновение фотосинтеза. Живые организмы получают пищу в растворенном виде, в присутствии воды осуществляется биосинтез, в виде растворов из организма выносятся продукты метаболизма.
Растворами являются плазма крови, спинномозговая жидкость, лимфа, моча, слюна, пот. Растворы — среда, в которой протекают все жизненно-важные процессы в организме (синтез белка, гидролиз белков, жиров, углеводов, АТФ, усвоение питательных веществ). Биожидкости участвуют в транспорте питательных веществ (жиров, аминокислот, кислорода), лекарственных препаратов к органам и тканям. В жидких средах организма поддерживается постоянство кислотности, концентрации солей, органических веществ (концентрационный гомеостаз).
Важнейшая характеристика раствора — концентрация растворенного вещества. Знание различных способов выражения концентрации раствора необходимо для изучения последующих тем курса химии (методы количественного анализа, осмотическое давление, буферные растворы, буферная емкость и др.), фармакологии, для практической деятельности врача (приготовление лекарственных препаратов, проведение клинических и биохимических исследований).
Цель: Изучить различные способы выражения концентрации растворов.
1. Изучить способы выражения концентрации раствора: молярную концентрацию эквивалента, объемную долю, титр.
2. Приобрести навыки расчета молярной концентрации эквивалента (молярной массы эквивалента кислоты, основания, соли).
3. приобрести навыки расчета титра.
4. приобрести навыки пересчета одного способа выражения концентрации в другой (научиться пользоваться таблицей формул пересчета концентраций).
Продолжительность занятия — 130 минут.
Место проведения занятия — учебный практикум (кафедра общей химии)
Задания для самостоятельной работы студента во внеучебное время (самоподготовка).
А. Контрольные вопросы
1. Химический эквивалент. Фактор эквивалентности.
2. Молярная масса эквивалента кислоты, основания, соли.
3. Молярная концентрация эквивалента (определение, обозначение, формулы расчета, единицы измерения).
4. Объемная доля (определение, обозначение, формула расчета, единицы измерения).
5. Титр (определение, обозначение, формулы расчета, единицы измерения).
Б. Список рекомендуемой литературы:
В. Обучающий материал.
ФОРМУЛЫ ДЛЯ ПЕРЕСЧЕТА КОНЦЕНТРАЦИЙ РАСТВОРОВ
С( f эквХ), моль/л, н
Молярная концентрация эквивалента
Г. Обучающие задачи
Задача 1. Рассчитать молярные массы эквивалента:
г ) Cu(OH) 2 в реакции Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O
а) М( f экв Na 2 CO 3) = 1/ z М( Na 2 CO 3)=1/2 ∙ 106г/моль = 53г/моль.
б) М( f экв AlCl 3) = 1/ z М( AlCl 3) = 1/3 ∙ 133,5г/моль = 44,5г/моль.
в) М( f экв H 2 SO 4) = 1/ z М( H 2 SO 4) = 1/1 ∙ 98г/моль = 98г/моль
г) М( f экв Cu ( OH )2) = 1/ z М( Cu ( OH )2) = ½ ∙ 98г/моль = 49г/моль.
Задача 2. В 500мл раствора содержится 0,25г сульфата алюминия. Определить молярную концентрацию и молярную концентрацию эквивалента раствора.
1.
3.
Ответ : C(Al 2 (SO 4 ) 3 ) = 0,0015 моль / л , C(f экв Al 2 (SO 4 ) 3 ) = 0,0088 моль / л
Задача 3. Рассчитать титр 0,15н раствора гидроксида натрия.
M ( f экв NaOH )= M ( NaOH ) = 40г/моль
Ответ: T ( NaOH ) = 0,006г/мл
Д. Задачи для самостоятельного решения.
Задача 1. Рассчитать молярные массы эквивалента:
г ) Al(OH) 3 в реакции : Al(OH) 3 + 3HCl = AlCl 3 + 3H 2 O
Задача 2. Какой объем 2н раствора H 2 SO 4 нужно взять для приготовления 500мл 0,5М раствора H 2 SO 4? (Ответ: V(H 2 SO 4 ) = 0,25л)
Задача 3. Сульфат железа ( III ) массой 10мг содержится в растворе объемом 1,5мл. Рассчитать молярную концентрацию эквивалента и титр этого раствора. (Ответ: С(1/6 Fe 2( SO 4)3)=0,1н, Т( Fe 2( SO 4)3)=0,0067г/мл ).
Источник