ЭЛЕКТРОЛИТИЧЕСКОЕ ПОЛУЧЕНИЕ АЛЮМИНИЯ
Алюминий получают путем электролиза глинозема, растворенного в расплавленном электролите, основным компонентом
которого является криолит. В чистом криолите Na3AlF6(3NaF • A1F3) отношение NaF: AlF3 равно 3, для экономии электроэнергии необходимо при электролизе иметь это отношение в пределах 2,6-2,8, поэтому к криолиту добавляют фтористый алюминий A1F3. Кроме того, для снижения температуры плавления в электролит добавляют немного CaF2, MgF2 и иногда NaCl. Содержание основных компонентов в промышленном электролите находится в следующих пределах, %: Na3AlF6 75-90; AlF3 5-12; MgF2 2-5; CaF2 2-4; Al203 2-10. При повышении содержания А12Оэ более 10% резко повышается тугоплавкость электролита, при содержании менее 1,3% нарушается нормальный режим электролиза.
Электролизная ванна или электролизер, где проводят электролиз, имеет в плане прямоугольную форму. Схема поперечного разреза ванны показана на рис. 247. Кожух 1 из стальных листов охватывает стены ванны, а у больших ванн выполнен с днищем. Внутри имеется слой шамота 2 и далее стены выложены угольными плитами 4, а под образован подовыми угольными блоками 3. Ванна глубиной 0,5—0,6 м заполнена электролитом и находящимся под ним слоем жидкого алюминия.
Угольный анод 6 (иногда их несколько) подвешен на стальных стержнях 8 так, что его нижний конец погружен в электролит, через стержни 8 к аноду подается ток от шин 7
| 8 Электролит 9 |

Рис. 247. Схема электролизной
ванны для получения алюминия:
/ — кожух; 2 — шамот; 3 — уголь
ный блок; 4 — угольная плита; 5 —
глинозем; 6 — анод; 7 — токопод-
водящая шина; 8 — подвеска (токо-
подвод); 9 — корка затвердевшего
электролита; 10 — гарнисаж
(затвердевший электролит); 11 — токоподвод

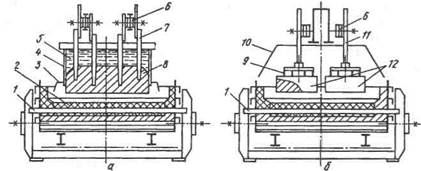
Существующие ванны различаются мощностью и устройством анода: ванны с одним самообжигающимся анодом и верхним токоподводом, с таким же анодом и боковым токоподводом и ванны с анодом из обожженных блоков. Ванна с самообжигающимся анодом и верхним подводом тока показана на рис. 248, а. Анод прямоугольного сечения является непре-рывнонаращиваемым. Его кожух сделан из стального листа, в кожух сверху загружают брикеты из углеродистой электродной массы (нефтяной кокс с каменноугольным пеком). Вверху масса плавится, а в нижней части кожуха, где высокие температуры, она спекается, коксуется и превращается в твердый блок. В него запекаются погруженные в электродную массу на разную глубину стальные штыри 7, расположенные в два—четыре ряда вдоль ванны. Эти стержни служат для подвода тока к аноду и для его удержания над ванной, кожух анода крепится над ванной отдельно. В процессе сгорания анода наиболее глубоко расположенные штыри поочередно выдергивают из затвердевшей массы и закрепляют на более высоком уровне, через некоторое время они спекаются с твердеющей массой.
По мере сгорания нижней части анода его с помощью специального механизма опускают, при этом анод скользит
Рис. 248. Алюминиевые электролизеры (а — q самообжигающимся анодом и верхним токоподводом; б — с обожженным анодом):
/ — токоподводящий стержень; 2 — подовые блоки; 3 — газоулавливающий колокол; 4 — кожух анода; 5 — жидкая анодная масса; 6 — шины; 7 — штырь; 8 — спеченный анод; 9 — ниппель; 10 — газосборник; 11 — штанга; 12 — анодный блок
внутри кожуха вниз. К нижней части кожуха анода крепится газосборный колокол, предназначенный для улавливания выделяющихся вокруг анода газов.
Электролизные ванны с предварительно обожженными анодами (рис. 248, б) имеют анодный узел, составленный из нескольких (до 20 и более) угольных или графитированных блоков, расположенных в два ряда. В каждом блоке закреплены четыре стальных ниппеля 9, соединенных со штангой 11; это устройство служит для подвода тока и для подвески блока. Сгоревшие блоки заменяют новыми. Над ванной установлен газоулавливающий короб.
Использование обожженных анодов позволило увеличить единичную мощность ванн и сильно сократить выделение вредных канцерогенных веществ, которые образуются при коксовании пека самообжигающихся электродов.
Электролизные ванны размещают в цехе в ряд— по несколько десятков ванн в ряду.
Электролиз ведут при напряжении 4—4,3 В и, как отмечалось, при удельной плотности тока, проходящего через анод, равной 0,65—1,0 А/см 2 . Толщина слоя электролита в ванне составляет 150—250 мм. Температуру ванны поддерживают в пределах 950—970 °С за счет тепла, выделяющегося при прохождении постоянного хока через электролит. Такие температуры имеют место под анодом, а на границе с воздухом образуется корка затвердевшего электролита рис. 247, 9, а у стен ванны — затвердевший слой электролита 10 (гарнисаж).
Необходимая температура ванны, т.е. выделение в слое электролита необходимого количества тепла, обеспечивается при определенном электросопротивлении слоя электролита. Такого электросопротивления достигают, поддерживая в заданных пределах состав электролита и толщину его токо-проводящего слоя, т.е. расстояния между анодом и слоем жидкого алюминия в пределах 40—60 мм (увеличение, например, этого расстояния, т.е. электросопротивления слоя электролита, вызывает увеличение выделения тепла при прохождении тока и, соответственно, перегрев электролита).
При приложении напряжения к катоду и аноду составляющие жидкого электролита подвергаются электролитической диссоциации, и расплав состоит из многочисленных катионов и анионов. Состав электролита подобран так, что в соот-
ветствии со значениями потенциалов разряда на электродах могут разряжаться только катионы А1 3+ и анионы О 2- , образующиеся при диссоциации Al203 в электролите. Соответственно электрохимический процесс на электродах описывается следующими уравнениями:
на катоде 2А1 3+ + бе
на аноде ЗО 2- — бе
Разряжающийся на катоде алюминий накапливается на подине ванны под слоем электролита. Выделяющийся на аноде кислород взаимодействует с углеродом анода с образованием газов СО и С02, т.е. при этом окисляется низ анода, в связи с чем анод периодически опускают. Газы СО и С02 выходят из-под анодов вдоль их боковых поверхностей, они содержат выделяющиеся из электролита токсичные фтористые соединения и глиноземную пыль (из самообжигающихся анодов в них также попадают вредные смолистые возгоны); эти газы улавливают и очищают от пыли и фтористых соединений.
По ходу процесса в ванны периодически загружают глинозем; контролируют состав электролита, вводя корректирующие добавки; с помощью регуляторов поддерживают оптимальное расстояние между анодами и жидким алюминием (в пределах 40—50 мм). Глинозем загружают в ванны сверху, пробивая для этого корку спекшегося электролита (рис. 247, 9) с помощью передвигающихся вдоль ванн машин.

Рис. 249. Вакуум-ковш для извлечения алюминия:
| tggggggz |
1 — кожух; 2 — сливной носок; 3 — патрубок для подсоединения вакуумного насоса; 4 — люк; 5 — крышка; 6 — заборный патрубок; 7 — футеровка
футерованную шамотом емкость, в которой создается разряжение
70 кПа. Соединенную с патрубком 6 ковша заборную трубку погружают сверху в слой жидкого алюминия в ванне и за счет разрежения алюминий засасывается в ковш.
Выделяющиеся анодные газы вначале направляют в горелки, где сжигают СО и возгоны смолы, а затем в газоочистку, где улавливают пыль и фтористые соединения.
Производительность современных электролизных ванн составляет 500—1200 кг алюминия в сутки. Для получения 1 т алюминия расходуется
1,95 т глинозема,
25 кг криолита, 25 кг фтористого алюминия, 0,5—0,6 т анодной массы, 14—16 МВт • ч электроэнергии.
РАФИНИРОВАНИЕ АЛЮМИНИЯ
Алюминий, извлекаемый из электролизных ванн, называют алюминием-сырцом. Он содержит металлические (Fe, Si, Cu, Zn и др.) и неметаллические примеси, а также газы (водород, кислород, азот, оксиды углерода, сернистый газ). Неметаллические примеси— это механически увлеченные частицы глинозема, электролит, частицы футеровки и др.
Для очистки от механически захваченных примесей, растворенных газов, а также от Na, Ca и Mg алюминий подвергают хлорированию. Для этого в вакуум-ковш вводят трубку, через которую в течение 10—15 мин подают газообразный хлор, причем для увеличения поверхности соприкосновения газа с металлом на конце трубки крепят пористые керамические пробки, обеспечивающие дробление струи газа на мелкие пузырьки. Хлор энергично реагирует с алюминием, образуя хлористый алюминий А1С13. Пары хлористого алюминия поднимаются через слой металла и вместе с ними всплывают взвешенные неметаллические примеси, часть газов и образующиеся хлориды Na, Ca, Mg и Н2.
Далее алюминий заливают в электрические печи-миксеры или в отражательные печи, где в течение 30—45 мин происходит его остаивание. Цель этой операции — дополнительное очищение от неметаллических и газовых включений и усреднение состава путем смешения алюминия из разных ванн. Затем алюминий разливают либо в чушки на конвейерных разливочных машинах, либо на установках непрерывного литья в слитки для прокатки или волочения. Таким образом получают алюминий чистотой не менее 99,8% А1.

Для того, чтобы рафинируемый алюминий находился внизу, его утяжеляют, формируя в анодном слое сплав алюминия с медью (в слое растворяют 30—40% Си). В процессе электролиза ионы А1 3+ перемещаются из анодного слоя через слой электролита в катодный слой и здесь разряжаются. Накапливающийся на поверхности ванны чистый катодный металл вычерпывают и разливают в слитки. Этим способом получают алюминий чистотой 99,95-99,99%. Расход электроэнергии равен
18000 кВт — ч на 1т алюминия. Более чистый алюминий получают методом зонной плавки или дистилляцией через субгалогениды.
Глава5. ПОЛУЧЕНИЕ ДРУГИХ ЦВЕТНЫХ МЕТАЛЛОВ
Для производства других цветных металлов— свинца, олова, цинка, вольфрама и молибдена пользуются некоторыми технологическими приемами, рассмотренными выше, но естественно, что схемы производства этих металлов и агрегаты для их получения имеют свои особенности.
Следует коротко остановиться на довольно распространенном хлоридном способе получения металлов, что можно сделать на примере производства таких металлов, как магний и титан, имеющих большое значение в промышленности.
Источник
ЭЛЕКТРОЛИТИЧЕСКОЕ ПОЛУЧЕНИЕ АЛЮМИНИЯ
5. ЭЛЕКТРОЛИТИЧЕСКОЕ ПОЛУЧЕНИЕ АЛЮМИНИЯ
Алюминий получают путем электролиза глинозема, растворенного в расплавленном электролизе, основным компонентом которого является криолит. В чистом криолите Na3AlF6(3NaF . AlF3) отношение NaF: AlF3 равно 3, для экономии электроэнергии необходимо при электролизе иметь это отношение в пределах 2,6-2,8, поэтому к криолиту добавляют фтористый алюминий AlF3. Кроме того, для снижения температуры плавления в электролит добавляют немного CaF2, MgF2 и иногда NaCl. Содержание основных компонентов в промышленном электролите находится в следующих пределах, %: Na3AlF6 75-90; AlF3 5-12; MgF2 2-5; CaF2 2-4; Al2O3 2-10.
Электролизная ванна или электролизер, где проводят электролиз, имеет в плане прямоугольную форму. Кожух из стальных листов охватывает стены ванны, а у больших ванн выполнен с днищем. Внутри имеется слой шамота и далее стены выложены угольными плитами, а под образован подовыми угольными блоками. Ванна глубиной 0,5-0,6 м заполнен электролитом и находящимся под ним слоем жидкого алюминия.
Угольный анод подвешен на стальных стержнях так, что его нижний конец погружен в электролит, через стержни к аноду подается ток от шин.
Мощность электролизера, определяемая силой подводимого к ней тока, изменяется от 30 кА у ванн малой мощности до 250 кА у ванн большой мощности.
Электролизные ванны с предварительно оббоженными анодами имеют анодный узел, составленный из нескольких угольных или графитированных блоков, расположенных в два ряда. В каждом блоке закреплены четыре стальных ниппеля, соединенных со штангой; это устройство служит для подвода тока и для подвески блока. Сгоревшие блоки заменяют новыми. Над ванной установлен газоулавливаающий короб.
Использование обожженных анодов позволило увеличить единичную мощность ванн и сильно сократить выделение вредных канцерогенных веществ, которые образуются при коксований пека самообжигающихся электронов.
Электронные ванны размещают в цехе в ряд — по несколько десятков ванн в ряду.
Электролиз ведут при напряжении 4-4,3 В и ,как отмечалось, при удельной плотности тока, походящего через анод, равной 0,65-1,0 А /см 2 .Толщина слоя электролита в ванне составляет 150-250 мм. Температуру ванны поддерживают в пределах 950-970 0 С за счет тепла, выделяющегося при прохождений постоянного тока через электролит. Такие температуры имеют место под анодом, а на границе с воздухом образуется корка затвердевшего электролита, а у стен ванны — затвердевший слой электролита (гарнисаж).
Необходимая температура ванны, т. е выделение в слое электролита необходимого количества тепла, обеспечивается при определенном электросопротивлении слоя электролита. Такого электросопротивления достигают, поддерживая в заданных пределах состав электролита и толщину его токопроводящего слоя, т. е. расстояния между анодом и слоем жидкого алюминия в пределах 40-60 мм.
При приложении напряжения к катоду и аноду составляющие жидкого электролита подвергаются электролитической диссоциации, и расплав состоит из многочисленных катионов и анионов. Состав электролита подобран так, что в соответствии со значениями потенциалов разряда на электродах могут разряжаться только катионы Al 3+ и анионы O 2- , образующиеся при диссоциации Al2O3 в электролите.
Разряжающийся на катоде алюминий накапливается на подине ванны под слоем электролита. Выделяющийся на аноде с образованием газов CO и CO2, т. е. при этом окисляется низ анода, в связи с чем анод периодически опускают. Газы CO и CO2 выходят из-под анодов вдоль их боковых поверхностей, они содержат выделяющиеся из электролита токсичные фтористые соединения и глиноземную пыль; эти газы улавливают и очищают от пыли и фтористых соединений.
По ходу процесса в ванны периодически загружают глинозем; контролируют состав электролита, вводя корректирующие добавки; с помощью регуляторов поддерживают оптимальное расстояние между анодами и жидким алюминием. Глинозем загружают в ванны сверху, пробирая для этого корку спекшегося электролита с помощью передвигающихся вдоль ванн машин.
Жидкий алюминий извлекают из ванн один раз в сутки или через 2-3 сут с помощью вакуум-ковшей. Вакуум-ковш представляет собой вмещающую 1,5-5 т алюминия футерованную шамотом емкость, в которой создается разряжение
70 кПа. Соединенную с патрубком ковша заборную трубку погружают сверху в слой жидкого алюминия засасывается в ковш.
Выделяющиеся анодные газы вначале направляют в горелки, где сжигают CO и возгоны смолы, а затем в газоочистку, где улавливают пыль и фтористые соединения.
Производительность современных электролизных ванн составляет 500-1200 кг алюминия в сутки. Для получения 1 т алюминия расходуется
1,95 т глинозема,
25 кг криолита, 25 кг фтористого алюминия, 0,5-0,6 т анодной массы, 14-16 МВт , ч электроэнергии. [2], [1]
6. РАФИНИРОВАНИЕ АЛЮМИНИЯ
Алюминий, извлекаемый из электролизных ванн, называют алюминием-сырцом. Он содержит металлические и неметаллические примеси, а также газы (водород, кислород, азот, оксиды углерода, сернистый газ). Неметаллические примеси – это механически увлеченные частицы глинозема, электролит, частицы футеровки и др.
Для отчистки от механически захваченных примесей, растворенных газов, а также от Na, Ca и Mg алюминий подвергают хлорированию. Для этого в вакуум-ковш вводят трубку, через которую в течение 10-15 мин подают газообразный хлор, причем для увеличения поверхности соприкосновения газа с металлом на конце трубки крепят пористые керамические пробки, обеспечивающие дробление струи газа на мелкие пузырьки. Хлор энергично реагирует с алюминием, образуя хлористый алюминий AlCl3. Пары хлористого алюминия поднимаются через слой металла и вместе с ними всплывают взвешенные неметаллические примеси, часть газов и образующиеся хлориды Na, Ca, Mg и H2.
Далее алюминий заливают в электрические печи-миксеры или в отражательные печи, где в течение 30-45 мин происходит его остаивание. Цель этой операции — дополнительное очищение от неметаллических и газовых включений и усреднение состава путем смешения алюминия из разных ванн. Затем алюминий разливают либо в чушки на конвейерных разливочных машинах, либо на установках непрерывно литья в слитки для прокатки или волочения. Таким образом получают алюминий чистотой не менее 99,8% Al.
Алюминий более высокой степени чистоты в промышленном масштабе получают путем последующего электролитического рафинирования жидкого алюминия по так называемому трехслойному методу. Электролизная ванна имеет стенки из магнезита, угольную подину и подвешенные сверху графитированные катоды. На подину через боковое отверстие порциями заливают исходный алюминий, поддерживая здесь анодный слой определенной толщины; выше него располагается слой электролита из фтористых и хлористых солей, а над электролитом – слой очищенного алюминия, который легче электролита; в этот слой погружены концы катодов.
Для того чтобы рафинируемый алюминий находился внизу, его утяжеляют, формируя в анодном слое сплав алюминия с медью. В процессе электролиза ионы Al 3+ перемещаются из анодного слоя через слой электролита в катодный слой и здесь разряжаются. Накапливающийся на поверхности ванны чистый катодный металл вычерпывают и разливают в слитки. Этим способом получают алюминий чистотой 99,95%. Расход электроэнергии равен
18000 кВт , ч на 1 т алюминия. Более чистый алюминий получают методом зонной плавки или дистилляцией через субгалогениды. [2]
Из рассмотренного материала следует, что алюминий является одним из необходимых металлов в промышленности. Металлургия алюминия играет большую роль в развитии современных технологий.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Габриелян О.С. Химия.- М.: Дрофа, 2004 г.
2. Воскобойников В.Г., Кудрин В.А., Якушев А.М. Общая металлургия.- М.: ИКЦ «Академкнига», 2004 г.
3. Кульман А.Г. Общая химия.- М.:» Колос», 1968.
Источник