- Свойства вещества зависят от способа получения вещества
- Чистые вещества и смеси
- Способ разделения смесей
- Конспект по химии для 8 класса «Основные понятия химии»
- Предварительный просмотр:
- Основные законы химии
- Закон сохранения массы веществ
- Закон постоянства состава
- Периодический закон
- Закон сохранения массы
- Закон эквивалентов
- Закон кратных отношений
- Закон объемных отношений (закон Гей-Люссака)
- Закон Авогадро
- Объединенный газовый закон
- Уравнение Клайперона—Менделеева (для идеального газа)
Свойства вещества зависят от способа получения вещества
Ключевые слова конспекта: предмет химии, вещества и их свойства, чистые вещества и смеси, способо разделения смесей.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Химия является одной из наук, изучающих природу. Вместе с биологией и физикой химия принадлежит к числу естественных наук.
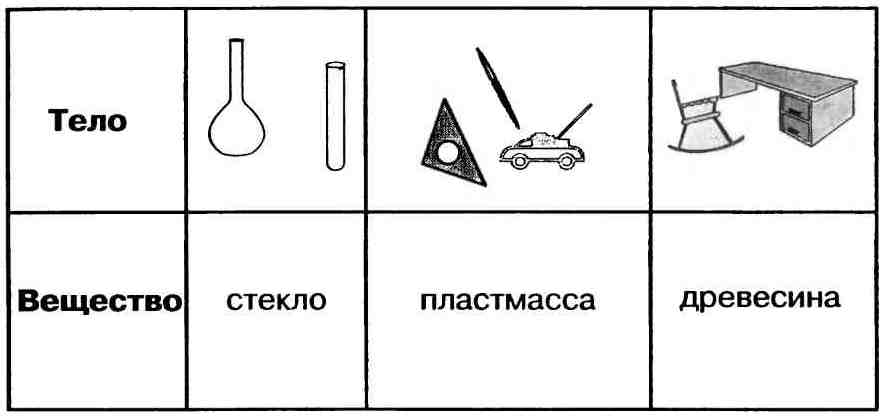
Вещество — это то, из чего состоит физическое тело. Вещество характеризуется определенными физическими свойствами.
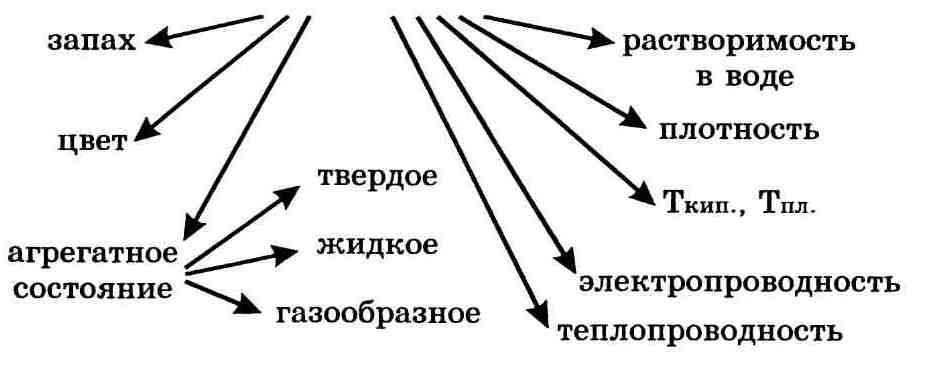
Свойства веществ — это признаки, по которым вещества отличаются друг от друга или сходны между собой, например:
Важнейшие физические свойства вещества следующие: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло-и электропроводность, температуры плавления и кипения.
Например, всем известное вещество алюминий можно охарактеризовать так: Алюминий — металл серебристо-белого цвета, сравнительно лёгкий (р = 2,7 г/см3), плавится при температуре 600°С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используют в самолёто- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
Чистые вещества и смеси
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
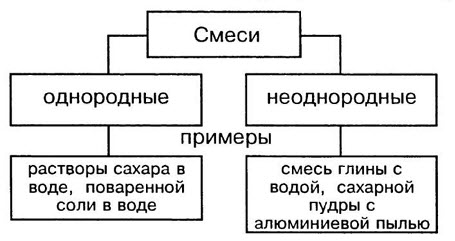
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.
Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
Способ разделения смесей
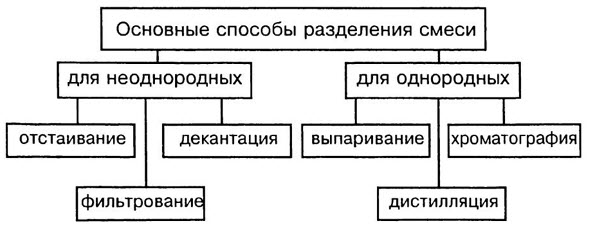
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.
Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
- а) При выдерживании воды, содержащей частички глины, в емкостях глина медленно осаждается на дно, отстаивается. Применяется при очистке питьевой воды.
- б) Чтобы разделить смесь поваренной соли и речного песка, надо поместить ее в колбу и добавить воды. Соль растворится, а песок опустится на дно. Затем осторожно слить раствор, чтобы песок остался в колбе. Соль из раствора получают выпариванием воды.
- в) Для разделения смеси малорастворимых друг в друге жидкостей с различной плотностью используют делительную воронку. Это цилиндрический сосуд с краником внизу. Помещенная в эту воронку смесь бензина с водой или растительного масла с водой быстро расслаивается, причем водный слой оказывается внизу. Открывая кран, сливаем воду, а когда вода заканчивается, закрываем кран. В воронке — бензин или масло.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Хроматография. Метод разделения смесей, основанный на различиях относительной растворимости веществ в используемом растворителе (жидкая фаза) и прочности связывания этих веществ поверхностью сорбента (твердая фаза).
Бумажная хроматография. Нанесем каплю раствора смеси двух веществ на расстоянии 2 см от края длинной полоски фильтровальной бумаги. Подвесим полоску в стеклянном цилиндре, на дне которого находится растворитель. Нижнюю часть полоски погрузим в растворитель, при этом пятно со смесью находится чуть выше. Верхняя часть полоски удерживается проволокой у отверстия цилиндра. Сверху цилиндр закроем стеклом, чтобы не испарялся растворитель. Боковые стороны полоски не касаются стенок цилиндра. Растворитель смачивает полоску, и жидкий фронт движется вверх за счет капиллярных сил. Вместе с растворителем по бумаге движутся и растворенные вещества. Если они цветные, то за движением можно наблюдать визуально. Вещество, которое лучше растворимо и менее прочно удерживается сорбентом (бумагой), поднимется выше. Когда фронт поднимется достаточно высоко и пятна разделятся, полоску вынимают и разрезают.
Колоночная хроматография — процесс, родственный рассмотренному. В качестве твердой фазы служит силикагель, помещенный в колонку. Только в этом случае смесь наносят равномерно вверху колонки, а потом добавляют растворитель. Разделенные вещества собирают внизу в разные стаканчики.
Конспект урока «Вещества и их свойства. Чистые вещества и смеси».
Источник
Конспект по химии для 8 класса «Основные понятия химии»
Предварительный просмотр:
8 класс Первоначальные химические понятия
Химия – наука о веществах, составе и свойствах веществ, а также превращениях между ними.
Вещество — материя, из которой состоит физическое тело.
Химический элемент –определенный вид атомов, имеющих одинаковый размер, массу и свойства.
Атом- наименьшая частица вещества, являющаяся носителем его свойств.
Молекула – частица, образованная из двух или большего числа атомов и способная к самостоятельному существованию.
Простое вещество — вещество, состоящее из атомов одного химического элемента.
Сложное вещество — вещество, состоящее из атомов разных химических элементов.
Относительная атомная масса (Ar) — величина, которая показывает, во сколько раз масса атома химического элемента больше атомной единицы массы (1/12 массы атома углерода).
Относительная молекулярная масса(Mr) – величина, которая показывает, во сколько раз масса молекулы больше атомной единицы массы (1/12 массы атома углерода).
Ион — это положительно или отрицательно заряженная частица, образованная из атома химического элемента в результате отдачи или присоединения электронов. Положительно заряженный ион- катион , отрицательно заряженный ион – анион.
Химическая связь — такое взаимодействие между атомами, которое связывает их в молекулы, ионы, кристаллы.
- Ионная связь — связь, возникающая между ионами. (за счет перехода электронов от атома металла к атому неметалла):NaCl, CaBr 2 , K 2 O и др.
- Ковалентная неполярная связь — связь, возникающая между атомами одного и того же химического элемента – неметалла (О 2 , N 2 , Cl 2, Br 2 , O 3 и т.п.)
- Ковалентная полярная связь — связь, возникающая между атомами разных неметаллов (СО 2 , H 2 O, NH 3 ).
- Металлическая связь — связь, возникающая между атомами и ионами металлов за счет обобществленных электронов (Сu, Al, Na, K и др.).
Электроотрицательность — способность атома химического элемента притягивать к себе общие электронные пары от атомов других химических элементов.
Степень окисления – условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что соединения состоят только из ионов.
— простые (металлы и неметаллы)
— сложные (оксиды, основания, кислоты, соли).
- Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород со степенью окисления -2. ( Э х О у -2 )
- Основания — сложные вещества, состоящие из катионов металла и гидроксид-ионов ОН. (Me +x (OH) x )
- Кислоты — сложные вещества, состоящие из катионов водорода Н + и анионов кислотных остатков.
- Соли — сложные вещества, состоящие из катионов металла и анионов кислотных остатков.
Моль — такое количество вещества, в котором содержится 6∙10 23 частиц этого вещества (атомов, молекул или ионов)
Молярная масса(M)- масса 1 моль вещества, численно равна относительной молекулярной массе, но в отличие от нее имеет единицы измерения. [M]=[г/моль].
Молярный объем (Vm)- объем газа количеством вещества 1 моль, измеренный при нормальных условиях ( t= 0 o C или 273К, р=101,3 кПа, 1 атм или 760мм рт. ст.). Vm= 22,4 л/моль
Химическая реакция — явление, в результате которого из одних веществ образуются другие вещества, при этом изменяется состав и свойства веществ.
- Реакции разложения — реакции, в результате которых из одного сложного вещества образуются нескольно простых или сложных веществ( АВ= А+В)
- Реакции соединения — реакции, в результате которых из нескольких простых или сложных веществ образуется одно сложное. (А+В=АВ).
- Реакции замещения – реакции, в результате которых атомы простого вещества замещают один или несколько атомов в сложного вещества ( А +ВС= А С +В)
- Реакции обмена — реакции, в результате которых атомы сложных веществ обмениваются своими составными частями ( А В+ C D= A D + C B)
Физические явления — явления, при которых могут изменяться размеры, форма тел и агрегатное состояние веществ, при этом состав их остается постоянным.
Химическое уравнение – условная запись химической реакции с помощью химических формул и математических знаков.
Закон сохранения массы веществ (1748г М.В. Ломоносов, 1789г А.Лавуазье): масса веществ , вступивших в химическую реакцию, равна массе образовавшихся веществ.
Закон постоянства состава (1808г Ж. Пруст)- вещества молекулярного строения имеют постоянный количественный и качественный состав, не зависящий от способа их получения.
Периодический закон (1861 г Д.И.Менделеев ) –свойства химических элементов и их соединений находятся в периодической зависимости от зарядов ядер их атомов.
Основные законы химии
Закон сохранения массы веществ
Закон постоянства состава
Периодический закон
Закон сохранения массы
Состояние 3 — это состояние перед самой остановкой. Тело как бы только-только дотронулось до земли, при этом скорость максимальная. Тело обладает максимальной кинетической энергией. Потенциальная энергия равна нулю (тело находится на земле).
Полные механические энергии равны между собой , если пренебрегать силой сопротивления воздуха. Например, максимальная потенциальная энергия в состоянии 1 равна максимальной кинетической энергии в состоянии 3.
А куда потом исчезает кинетическая энергия? Исчезает бесследно? Опыт показывает, что механическое движение никогда не исчезает бесследно и никогда оно не возникает само собой. Во время торможения тела произошло нагревание поверхностей. В результате действия сил трения кинетическая энергия не исчезла, а превратилась во внутреннюю энергию теплового движения молекул.
При любых физических взаимодействиях энергия не возникает и не исчезает, а только превращается из одной формы в другую.
Общая форма закона сохранения и превращения энергии имеет вид:


При исследовании тепловых процессов не рассматривается изменение механической энергии, то есть
Закон эквивалентов
Эквивалент (Э) – реальная или условная частица вещества, которая может присоединить, заместить в кислотно-основных реакциях один ион водорода (или другого одновалентного элемента), а в окислительно-восстановительных реакциях – присоединить или высвободить один электрон.
Под условной частицей вещества подразумевается реально существующие частицы (молекулы, ионы, электроны и т.д.), доли этих частиц (например, 1 /2 иона) или их группы.
Фактор эквивалентности fэ (х) – число, обозначающее, какая доля реальной частицы вещества X эквивалентна одному иону водорода в кислотно-основной реакции или одному электрону в реакции окисления-восстановления.
Фактор эквивалентности – величина безразмерная. Принимает значения 1 или меньше единицы.
Для простых веществ и элементов в соединении fэ(х) = 1/В, где В – валентность элемента.
Например, для водорода или натрия fэ= 1/1 = 1. Для магния или кислорода fэ = 1/2.
Молярная масса эквивалента вещества Мэ(х) – масса одного моля эквивалента этого вещества, равная произведению фактора эквивалентности fэ(х) на молярную массу вещества Мх.
Например, молярные массы эквивалентов простых веществ:
Мэ(Na) = 1· 23 = 23 г/моль;
Мэ(Mg) = ½ · 24 = 12 г/моль;
Если одно из реагирующих веществ – газ, то для него вводится понятие объема эквивалента вещества – Vэ(х), который рассчитывается на основании следствия из закона Авогадро:
1 моль газа массой М занимает объем 22,4 л, при нормальных условиях (н.у.):
Р o = 1 атм.; Т о = 273 К
1 эквивалент газа массой Мэ занимает объем Vэ при н.у.
Например, при нормальных условиях 1 моль эквивалентов водорода занимает объем, равный:
Для кислорода эта величина составляет
Закон эквивалентов: массы (или объемы) реагирующих веществ пропорциональны молярным массам эквивалентов (или эквивалентным объемам) этих веществ.
Если одно из этих веществ представляет собой газ, то закон эквивалентов записывается в виде
Закон кратных отношений
Относительные атомные и молекулярные массы являются мерой масс атомов и молекул, поэтому они позволяют сделать вывод о соотношении масс атомов различных элементов в молекуле сложного вещества.
Пример: Относительная атомная масса водорода и кислорода соответственно равна 1,00794 и 15,9994, откуда следует, что соотношение масс атомов водорода и кислорода составляет 1 : 16. В молекуле воды H2O содержится два атома водорода и один атом кислорода, следовательно, массовое отношение водорода и кислорода в воде равно 2 : 16 или 1 : 8. Соотношение атомных масс элементов в соединениях устанавливает закон постоянства состава, вывел его в начале XIX в. французский химик Жозеф Луи Пруст (1754-1826) на основании анализа химических соединений.
Его современная формулировка такова:
Каким бы способом ни было получено вещество, его химический состав остается постоянным
В каждом сложном веществе (независимо от способа его получения) сохраняются неизменными соотношения чисел атомов и масс атомов входящих в его состав элементов. При этом, отношение чисел атомов различных элементов выражается небольшими целыми числами. Так, для воды H2O они составляют 2 : 1, для диоксида углерода CO2 — 1 : 2, для оксида азота (III) N2O3 — 2 : 3. Эти числа и определяют состав указанных сложных веществ.
Отсюда следует, что если два или несколько простых веществ соединяются с образованием некоторого сложного вещества, то и массовое отношение реагирующих веществ постоянно для данного продукта. Так, при взаимодействии водорода и кислорода могут быть получены вода H2O и пероксид водорода H2O2; очевидно, что не только в самих продуктах массовое отношение водорода и кислорода равно соответственно 1 : 8 и 1 : 16, но и массовые отношения реагентов будут такими же.
На основании закона постоянства состава и закона кратных отношений английский исследователь Джон Дальтон (John Dalton, 1766-1844) в 1807 г. высказал атомную гипотезу (основу атомно-молекулярного учения о строении вещества):
Любое вещество составлено из мельчайших химических частиц — атомов; простое вещество состоит из атомов одного элемента, сложное вещество — из атомов различных элементов.
Из атомной гипотезы вытекает, что закон постоянства состава отражает именно атомный состав вещества: в молекулу вещества объединяется определенное число именно атомов одного или различных элементов. Закон кратных отношений, открытый Дальтоном, гласит:
Если два элемента образуют между собой несколько соединений, то массы атомов одного элемента, приходящиеся на одну и ту же массу атомов другого элемента, соотносятся между собой как небольшие целые числа.
Пример: Сера образует два оксида — диоксид SO2 и триоксид SO3. Относительная атомная масса серы и кислорода равна 32 и 16 (округлено). Массовое отношение серы и кислорода в SO2 равно 32 : (2·16) = 32 : 32, в SO3 32 : (3·16) = 32 : 48. Отсюда следует, что на каждые 32 массовые части серы в этих соединениях приходится 32 и 48 массовых частей кислорода соответственно, т.е. а после сокращения в соответствии с математическими законами, соотношение массовых частей кислорода 32 : 48 = 2 : 3, что и является отношением небольших кратных чисел.
Закон объемных отношений (закон Гей-Люссака)
Закон Авогадро
Из закона Авогадро вытекает важное следствие: моль любого газа при нормальных условиях (0
Из закона Авогадро также следует, что массы равных объемов различных газов при одинаковых температуре и давлении относятся друг к другу как молярные массы этих газов:
М1 и М2 – молекулярные массы первого и второго газов.
Поскольку масса вещества определяется по формуле
где ρ – плотность г аза,
то плотности различных газов при одинаковых условиях пропорциональны их молярным массам. На этом следствии из закона Авогадро основан простейший метод определения молярной массы веществ, находящихся в газообразном состоянии.
Закон Авогадро позволяет рассчитать плотность газа при нормальных условиях, на основании отношения молярной массы М к объему моля:

Из этого уравнения можно определить молярную массу газа:

Объединенный газовый закон
Идеальный газ — это такой гипотетический газ, молекулы которого не взаимодействуют друг с другом и занимают нулевой объем. Соотношения между давлением, объемом и температурой газов устанавливают законы идеальных газов: объединенный газовый закон, законы для изобарического, изохорического и изотермического процессов.
Реальные газы обычно хорошо подчиняются законам идеальных газов при давлениях, менее или несущественно превышающих атмосферное, и при температурах близких к температуре окружающей среды или более высоких. Поэтому законы идеальных газов находят широкое применение в природопользовании, в частности при расчетах количества, состава газов, выделяющихся при горении, и в других технологических процессах, сопровождаемых их образованием.
Объединенный газовый закон можно также записать в другой форме:
Точное значение постоянной в правой части этого уравнения зависит от количества газа. Если количество газа равно одному молю (см. гл. 4), то соответствующая постоянная обозначается буквой R и называется молярная газовая постоянная, или просто газовая постоянная. Если давление выражено в атмосферах, постоянная R имеет значение
R = 8,314 Дж*К* моль-1
Объединенный газовый закон для одного моля газа приобретает вид:
где Vm- объем одного моля газа. Для п молей газа получается уравнение:
В такой форме объединенный газовый закон называется уравнением состояния идеального газа. Уравнение состояния это уравнение, связывающее между собой параметры состояния газа-давление, объем и температуру.
Газ, который полностью подчиняется уравнению состояния идеального газа, называется идеальный газ. Такой газ не существует в действительности. Реальные газы хорошо подчиняются уравнению состояния идеального газа при низких давлениях и высоких температурах. Отклонения в поведении реальных газов от предписываемш уравнением состояния идеального газа подробно обсуждаются ниже.
Вычисление относительной молекулярной массы с помощью уравнения состояние идеального газа. Уравнение состояния идеального газа позволяет проводить прямые вычисления относительной молекулярной массы газа M1. Введем понятие относительной молекулярной массы, основываясь на уже знакомом нам (из гл. 1) определении относительной атомной массы A1. Для газа, состоящего из простых молекул, относительная молекулярная масса представляет собой сумму относительных атомных масс всех атомов, входящих в молекулу. Например, для диоксида углерода.
Относительная молекулярная масса, выраженная в граммах на моль, называется молярной массой (см. гл. 4). Следовательно, молярная масса CO2 равна 44 г/моль. Два моля CO2 имеют массу 88 г, а и молей-массу п -44 г. В общем случае можно записать:
где n-количество вещества в молях (т.е. число молей данного вещества), т-масса вещества в граммах, a M-его молярная масса.
Подстановка полученного выражения для п в уравнение состояния идеального газа (4) дает:
Это уравнение позволяет, зная массу и объем газа при определенных температуре и давлении, вычислить его молярную массу М. А поскольку
M = M (г/моль), то полученный результат непосредственно дает относительную молекулярную массу М.
Уравнение Клайперона—Менделеева (для идеального газа)
n – число молей газа;
P – давление газа, Па;
V – объем газа, м 3 ;
T – абсолютная температура газа, К;
R – универсальная газовая постоянная 8,314 Дж/моль×K.
Если объём газа выражен в литрах, то уравнение Клапейрона-Менделеева записывается в виде:
Источник