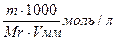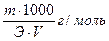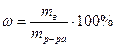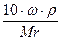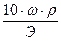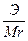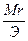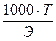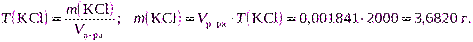Способы приготовления титрованных растворов.
Существуют три способа приготовления титрованных или стандартизированных растворов.
1. Растворением точно взвешенного количества вещества и разбавлением его до известного объёма. Для этого на аналитических весах берут точную навеску вещества, растворяют ее в мерной колбе и доводят объем раствора водой до метки. Зная массу растворенного вещества (Т) и объем полученного раствора (V), нетрудно вычислить его титр:
Титрованные растворы, полученные таким образом, называются растворами с приготовленным титром или первичными стандартами.
Первичные стандарты применяют в титриметрии для количественного определения тех или иных веществ и для установления концентрации стандартного (рабочего) раствора.
Однако такой метод приготовления растворов пригоден лишь тогда, когда вещество отвечает ряду требований.
Требования к первичным стандартам:
1) вещество должно быть химически чистым;
2) состав вещества должен точно соответствовать формуле;
3) вещество должно быть хорошо растворимым в воде;
4) вещество должно быть устойчивым при хранении и в твердом виде или растворе;
5) оно не должно содержать гидратную воду: гигроскопическое или склонное к выветриванию вещество трудно высушить и взвесить;
6) желательна возможно большая величина грамм-эквивалента вещества, что позволяет увеличить точность установления нормальности раствора. Поскольку при увеличении массы относительная ошибка взвешивания уменьшается, высокая эквивалентная масса способствует уменьшению ошибок взвешивания;
7) вещество должно быстро и до конца реагировать с другими веществами. Пользуясь первичными стандартными растворами, устанавливают титр остальных веществ. К первичным стандартам
относятся, например, NaСl, Nа2СОз, Na2B407•10Н2О, K2Cr207, Н2С2О4•2Н2О, КВгОз и другие.
2. Титрованием раствора, содержащего взвешенное количество соединения, раствором реагента точной концентрации. Если
вещество не удовлетворяет перечисленным выше требованиям, то сначала готовят раствор его приблизительно нужной нормальности. Параллельно с этим готовят раствор первичного стандарта.
Далее один из растворов оттитровывают другим и, зная концентрацию стандарта, вычисляют точную концентрацию приготовленного раствора. Титрованные растворы, концентрацию которых находят в результате титрования, называются вторичными стандартными растворами или
растворами с установленным титром; иногда их называют «рабочими» растворами. Процесс определения концентрации стандартного раствора титрованием первичным стандартом называется стандартизацией.
3. Для получения титрованных р-ров на практике часто пользуются «фиксаналами» или стандарт-титрами.
Методы приготовления титрованных растворов:
1) растворы с приготовленным титрантом: навеска на аналитических весах в мерной колбе,
2) с установленным титром: готовят раствор с приблизительной концентрацией, а точно устанавливают титрованием,
3) из фиксаналов: титр рабочего раствора устанавливают через каждые 1-3 недели.
Титр рабочих растворов нужно устанавливать в таких же условиях, как и проводить титрование.
5. Расчёты в титриметрическом анализе.
Методы расчёта в количественном анализе основаны на законе эквивалентов:
Все вещества реагируют между собой в эквивалентных соотношениях.
Молярная концентрация(молярность раствора) — это содержание моль вещества в одном литре раствора.
См=
См= 
0,1 м 0,1 — децимолярная
См=0,1 М 0,001 — сантимолярная
Сн (нормальность) — N =
Эсоли= 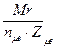
Титр — Т — количество грамм вещества в одном мл раствора:
Т = 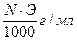
Тх/у= 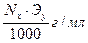
ТНСl=
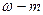
См=
N=
Cм= N
N=Cм
Т= 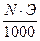
Источник
Способы приготовления растворов
Существует несколько способов приготовления растворов. По способу приготовления различают первичные и вторичные стандартные растворы.
1.
По точной навескеготовят первичные стандартные растворы, растворы стандартных установочных веществ, которые должны удовлетворять следующим требованиям:
а) состав их должен строго соответствовать химической формуле;
б) вещества должны быть устойчивыми при хранении в растворе и в сухом виде (не окисляться, не поглощать диоксид углерода, воду, не терять кристаллизационную воду);
в) величина молярной массы эквивалента должна быть по возможности наибольшей для уменьшения погрешности взвешивания и титрования.
При приготовлении растворов по точной навеске задаются концентрацией раствора и его объемом. Основные этапы работы:
- рассчитывают необходимую навеску для взвешивания с точностью до 0,0001 г по одной из формул:
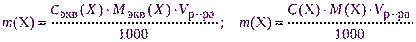
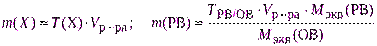
где Vр-ра – объем раствора, см 3 ;
- взвешивают точную навеску на аналитических весах;
- взвешенную навеску количественно переносят в мерную колбу вместимостью, равной Vр-ра, растворяют вещество, доводят до метки дистиллированной водой и перемешивают;
- если взятая навеска отличается от теоретически рассчитанной, то концентрацию раствора пересчитывают, используя указанные выше формулы, например:
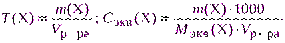
где Vр-ра – объем раствора, см 3 ; m(Х) – практическая навеска, г.
2.
По приблизительной навескеготовят растворы нестандартных веществ или растворы приблизительной концентрации. Этапы работы такие же, как и при приготовлении растворов по точной навеске, но навеску рассчитывают с точностью не более, чем до 0,01 г и берут ее на технических весах. Точную концентрацию такого раствора устанавливают титрованием (часто растворами первичных стандартов) и рассчитывают по закону эквивалентов:
Сэкв 1·V1 = Cэкв 2·V2 (2.16)
Приготовленные таким образом растворы с точно установленной концентрацией называются вторичными стандартами или титрованными.
3.
Из фиксанала (норма-дозы, стандарт-титра)готовят первичные стандартные растворы точной концентрации. Фиксанал – стеклянная ампула, в которой содержится точно известное количество nэкв вещества в кристаллическом виде или в виде раствора. Содержимое фиксанала количественно переносят в мерную колбу, доводят уровень раствора до метки, раствор перемешивают. Концентрация раствора должна быть задана, а вместимость мерной колбы рассчитывают, используя формулу (2.6).
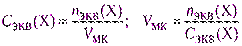
4.
Разбавлением концентрированных растворовготовят растворы многих веществ. В этом случае должны быть заданы объем разбавленного раствора, его концентрация и концентрация концентрированного раствора. Рассчитывают необходимый для разбавления объем концентрированного раствора, затем измеряют рассчитанный объем, переносят в мерную колбу или в мерный стакан, доводят уровень жидкости до метки дистиллированной водой и перемешивают. Если исходный раствор имел точную концентрацию и при его разбавлении использовали точную мерную посуду, то получают раствор точной концентрации. В противном случае получают раствор приблизительной концентрации, все расчеты ведут с точностью не более чем до 0,01, точную концентрацию устанавливают титрованием и рассчитывают по формуле (2.16).
Пример.Сколько грамм хлорида калия KCl потребуется для приготовления 2 дм 3 раствора:
а) с массовой долей, равной 30% и плотностью 1,110 г/см 3 ;
б) с титром, равным 0,001841 г/см 3 ;
в) с молярной концентрацией эквивалента, равной 0,2000 моль/дм 3 .
Решение.
| Дано: ω(KCl) = 30% | а) Массу хлорида калия рассчитаем, используя формулу (2.11): |
| Vр-ра= 2 дм 3 = 2000 см 3 ρ р-ра = 1,110 г/см 3 | 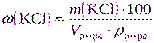 |
| Сэкв(KCl) = 0,2000 моль/дм 3 T(KCl) = 0,001841 г/см 3 |  |
| m(KCl) = ? |
б) Для расчета используем формулу (2.12):
в) Для расчета можно использовать формулу (2.7):
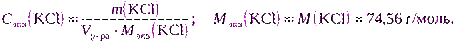
m(KCl) = Cэкв(KCl) · Vр-ра · Mэкв(KCl) = 0,2000·2·74,56 = 29,8240 г.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Способы приготовления растворов



Способы приготовления стандартных растворов.
Растворы с известной концентрацией, которые служат для определения концентрации других растворов, называются стандартнымиилирабочими. Это некоторые растворы кислот, щелочей, солей.
1. Метод точной навески. Предполагает работу с растворами, которые не меняют свою молекулярную массу и объем при взаимодействии с воздухом. К таким веществам относятся щавелевая кислота, сода, бура (Na2B4O7·10H2O), бихромат калия и ряд других веществ. На аналитических (погрешность таких весов составляет 0,0002г) весах точно взвешивают вещество и переносят в мерную колбу для растворения, доводят до метки растворителем (водой) и тщательно перемешивают.
Растворы точной навески можно приготовить лишь для немногих веществ. Эти вещества должны отвечать следующим требованиям:
— вещество должно быть чистым (без примесей)
— иметь постоянный состав (соответствовать определённой химической формуле)
— быть устойчивым как на воздухе, так и в растворе
— иметь достаточно высокую молекулярную массу.
Такие соединения называются установочными. К ним относятся: щавелевая кислота (Н2С2О4 · 2Н2О), тетраборат натрия (бура) (Na2B4O7·10H2O), дихромат калия (K2Cr2O7). Для веществ, неудовлетворяющих требованиям, растворы готовят методом неточной навески или разбавлением.
2. Метод неточной или приблизительной навески. Предполагает работу с растворами, которые не соответствуют этим требованиям, например, меняют свою массу на воздухе, например, перманганат калия. Перед применением их в качестве стандартных растворов, необходимо оттитровать другим раствором с точно известной концентрацией.
3. Метод разбавления. Из раствора с точно известной концентрацией готовят разбавлением раствор другой концентрации. Концентрация полученного раствора зависит от концентрации исходного.
4. Фиксанальный метод. Предполагает приготовление растворов из фиксаналов. Фиксанал — ампула с сухим веществом или раствором с точно известным количеством эквивалентов. концентрацией. Фиксанал разбивают и переносят в колбу для растворения. Этот метод считается наиболее точным.
Источник
Способы приготовления рабочих растворов



Рабочие растворы, с помощью которых в титриметрии определяют концентрации растворённых веществ, исследователь перед анализом должен приготовить сам. Они могут быть получены тремя способами.
1. Путём растворения точно рассчитанной (исходя из заданной концентрации) и взвешенной на специальных аналитических весах массы вещества в заданном объёме раствора. Соединения, которые используются для приготовления таких растворов, должны:
а)быть химически чистыми и не содержать посторонних примесей;
б)иметь постоянный состав,строго соответствующий их химической формуле;
в)быть устойчивыми при хранении как в чистом виде, так и в растворе, т.е. самопроизвольно не разлагаться и не взаимодействовать с окружающей средой (кислородом, углекислым газом, водяными парами и другими веществами, содержащимися в воздухе);
г)легко растворяться в Н2О;
д)иметь большую молярную массу эквивалентов (чем она больше, тем меньше ошибка при взвешивании).
Лишь немногие соединения удовлетворяют или почти удовлетворяют этим требованиям, поэтому число веществ, пригодных выступать в качестве первичных стандартов, ограничено.
Титранты, полученные данным способом, называются рабочими растворами с приготовленным титром или стандартными растворами.
2. При втором способе получения рабочих растворов рассчитанную навеску вещества взвешивают на технических весах, растворяют в известном объёме раствора, а затем его точную концентрацию путём титрования определяют или устанавливают с помощью стандартного раствора.
Такие титранты называются рабочими растворами с установленным титром, или стандартизированными растворами.
Вещества, которые используются для получения данных растворов, могут медленно разлагаться при хранении, взаимодействовать с окружающей средой, поэтому точно рассчитанную навеску взвесить практически не представляется возможным.
Например, многие кислоты (H2SO4, HNO3, HCl) активно поглощают водяные пары из воздуха, а щёлочи взаимодействуют с содержащимся в нём углекислым газом.
Концентрацию рабочих растворов с установленным титром определяют непосредственно перед анализом.
При их хранении необходимо принимать все возможные меры, чтобы титр раствора не изменился. Однако даже при соблюдении самых тщательных мер предосторожности концентрацию такого рабочего раствора нужно проверять каждые 2-3 недели.
3. Рабочие растворы можно приготовить также из фиксаналов. Фиксанал (нормадоза или стандарт-титр) представляет собой запаянную стеклянную ампулу, содержащую строго определённое химическое количество эквивалентов вещества в сухом виде или в растворе. Чаще всего такая ампула содержит 0,1 и 0,01 моль эквивалентов вещества и используется для приготовления 1 литра раствора. Для чего содержимое ампулы количественно переносится в соответствующую мерную колбу и разбавляется Н2О до метки (рис. 43).
При этом сразу получается стандартный раствор.
Правила работы с мерной посудой при проведении
аналитических измерений
При проведении объёмно-аналитических измерений в титриметрии применяется специальная мерная посуда: мерные колбы, пипетки, бюретки, мерные цилиндры и пробирки. Работа с ней требует определённых навыков и умений. Для получения правильных результатов в объемном анализе все операции необходимо выполнять очень тщательно, используемая посуда должна быть чистой и соответствовать целям и задачам проводимых измерений.
Источник