- Получение соляной кислоты сульфатным методом
- Методы производства соляной кислоты
- Физические, химические и термические свойства соляной кислоты, ее применение в сфере производства или потребления. Характеристика исходного сырья; сульфатный и синтетический методы получения, получение из абгазов, особенности хранения и транспортировки.
- Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Получение соляной кислоты сульфатным методом
Сульфатный метод – это самый старый метод получения соляной кислоты. Его используют, когда есть потребность в 
Сульфатный метод протекает по следующим реакциям:
Сырьем для получения хлористого водорода и сульфата натрия служат поваренная соль (обычно измельченная каменная соль – бузун) и купоросное масло – 92 % – 93 % – я серная кислота. Менее концентрированную серную кислоту не применяют, так как в этом случае хлористый водород был бы чрезмерно разбавлен парами воды, что затруднило бы получение концентрированной соляной кислоты. Применение крупнозернистой выварочной соли предпочтительнее вследствие ее пористости – она легко пропитывается кислотой с образованием однородной массы. Однако выварочная соль содержит переменное количество влаги, что затрудняет дозировку сырья и регулирование температурного режима печей. Каменная соль характеризуется постоянной влажностью, но она более загрязнена примесями.
Реакция между хлористым натрием и серной кислотой – эндотермическая.
Взаимодействие хлористого натрия с серной кислотой начинается даже при 0 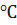
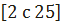
Реакция между поваренной солью и серной кислотой осуществляется в механических или во вращающихся печах.
На рисунке 1 показана механическая сульфатная печь. Она предназначена для получения хлороводорода, представляет собой муфель, под (чаша) 12 и свод 11 которого сложены из фасонных огнеупорных и кислотостойких шамотных плит. Под муфелем и над ним расположены дымоходы. Толщина плит пода 120 мм; свод муфеля для облегчения передачи тепла к реакционной массе делают более тонким – 30 мм. Внутреннюю кладку печи и топки выполняют из шамотного, а наружную – из простого кирпича. Под печью расположен привод мешалки. Поваренная соль через загрузочную воронку непрерывно поступает в центр муфеля с помощью шнекового питателя 8. Туда же по трубе подается купоросное масло. Оно поступает в укрепленный на головке вала и вращающийся вместе с ним распределитель 13 кислоты, имеющий форму чайника, через носик которого сливается в муфель.
1 – шахтная топка; 2 – загрузочная коробка для топлива; 3 – колосниковая решетка; 4 – зольник; 5 – топочный порог; 6 – канал для вторичного воздуха; 7 – загрузочная воронка для соли; 8 – загрузочный шнек для соли; 9 – солевая труба; 10 – кислотная труба; 11 – свод муфеля; 12 – под муфеля; 13 – питатель – распределитель кислоты; 14 – головка мешалки; 15 – вал мешалки; 16 – коронная шестерня привода мешалки; 17 – люк для выхода сульфата натрия; 18 – холодильно – размольный барабан для сульфата; 19 – труба для отвода хлористого водорода.
Рисунок 1 – Механическая сульфатная печь (вертикальный разрез)
Перемешивание поваренной соли и кислоты и передвижение реакционной массы по поду муфеля от центра к периферии производится укрепленной на чугунном валу 15 мешалкой с четырьмя плечами, расположенными крестообразно, на каждом из которых имеется по два (всего восемь) термосилидовых или чугунных гребков с керамическими или корборундовыми наконечниками. Вращение вала (0,75 – 1,25 об/мин) производится через зубчатую передачу электромотором мощностью 4,5 квт при диаметре муфеля 4,25 м и 6,8 квт при диаметре муфеля 5,5 м.
Обогрев муфеля, температуру в котором поддерживают в пределах 500 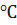
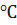
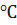
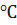

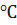
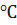
Полученный хлористый водород отправляется на абсорбцию. В соответствии с этим абсорбционные установки сооружены таким образом, чтобы обеспечить наиболее полный отвод тепла гидратации HCl. Обычно газ вначале охлаждают в длинных газопроводах и керамических холодильниках. Охлаждение совмещают с осушкой газа, что дает возможность получать более концентрированную соляную кислоту до 37 % 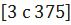
Источник
Методы производства соляной кислоты
Физические, химические и термические свойства соляной кислоты, ее применение в сфере производства или потребления. Характеристика исходного сырья; сульфатный и синтетический методы получения, получение из абгазов, особенности хранения и транспортировки.
| Рубрика | Производство и технологии |
| Вид | курсовая работа |
| Язык | русский |
| Дата добавления | 21.02.2013 |
| Размер файла | 73,9 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
1. Свойства соляной кислоты
1.1 Физические свойства
1.2 Химические свойства
1.3 Термические свойства
2. Характеристика исходного сырья
2.3 Хлористый водород
3. Применение соляной кислоты в сфере производства или потребления
4. Методы получения соляной кислоты
4.1 Сульфатный метод
4.2 Синтетический метод
4.3 Получение из абгазов
5. Хранение и транспортировка соляной кислоты
6. Основное оборудование в производстве соляной кислоты
7. Охрана труда и техника безопасности
8. Расчет материального и теплового балансов
8.1 Расчет материального баланса
8.2 Расчет теплового баланса
Соляная кислота — очень активное едкое вещество, растворяющее многие металлы. Сегодня соляная кислота широко используется в промышленности при извлечении металлов из руд, травлении металлов и т. д. Также она используется при изготовлении паяльной жидкости, при осаждении серебра и как составная часть царской водки.
Соляную кислоту получали разложением поваренной соли серной кислотой, при этом основным продуктом считался образующийся сульфат натрия, который использовался для производства соды по методу Леблана, а также стекла. Соляная кислота рассматривалась как побочный продукт.
В период первой мировой войны производство соляной кислоты для использования в текстильной промышленности почти наполовину уменьшилось. Все же и во время войны были построены три завода изготовлявших соляную кислоту для переработки ее в хлор
Сначала соляная кислота получалась в пламенных печах, а затем в так называемых муфельных печах, имеющих муфель и чугунную чашу обогреваемые снаружи топочными газами. В печь загружалось не более 240 кг поваренной соли. За сутки перерабатывали от 1,4 до 1,9 т.
Целью курсовой работы является изучение различных методов производства соляной кислоты, ее свойств и применение, какие меры предосторожности надо предусматривать при работе с соляной кислотой.
Соляная кислота (хлористоводоромдная кислота) — HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, так как выделяющийся HCl образует с водяным паром мельчайшие капельки. Сильно едкая жидкость (техническая соляная кислота желтоватая из — за примесей Fe, Cl2 и др.)
Часто применяют разбавленную кислоту, содержащую 10% и меньше хлористого водорода. Разбавленные растворы не выделяют газообразного HCl и не дымят ни в сухом, ни во влажном воздухе
Соляная кислота представляет собой летучее соединение, так как при нагревании она улетучивается. Она является сильной кислотой и энергично взаимодействует с большинством металлов. Соляная кислоты содержится в желудочном соке (около 0,3%); способствует пищеварению и убивает болезнетворные бактерии.
Бесцветный газ с резким запахом, ядовитый, тяжелее воздуха, хорошо растворим в воде. В отсутствие влаги он при обычных температурах не действует на большинство металлов и их оксиды. Газообразный кислород окисляет его только при нагревании.
Состояние — газ. Плотность 1,477г / л, газ (25 0 С) г / см 3 . Молярная масса — 36,4606 г / моль.
Растворимость в воде — 72,47 (20 0 С) г / 100 мл
Соляная кислота представляет собой типичную одноосновную кислоту. Соляная кислота реагирует со следующими веществами:
— с металлами стоящими в электрохимическом металлов до водорода;
— с оксидами всех металлов;
— с гидроксидами металлов;
— с солями металлов образованных более слабыми кислотами.
Газообразный HCl токсичен. Длительная работа в атмосфере HCl вызывает катары дыхательных путей, разрушение зубов, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства. Допустимое содержание HCl в воздухе рабочих помещений не более 0,005 мг / л. Защита: противогаз, очки, резиновые перчатки, обувь, фартук.
Температура плавления — 144,22 0 С
Температура кипения — 85 0 С
Температура разложения — 1500 0 С
Критическая точка — 51,4 0 С
Энтальпия образования — 92, 31 кДж / моль
Простое вещество хлор — при нормальных условиях — газ желтовато — зеленого цвета, с резким запахом. Молекула хлора двухатомная (формула Cl2).
Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCl; сильвина KCl; сильвинита KCl·NaCl; и др.
В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
Газообразный хлор относительно легко сжижается. Начиная с давления в 0,8 МПа (8 атмосфер), хлор будет жидким уже при комнатной температуре. При охлаждении до температуры 34 0 C хлор тоже становится жидким при нормальном атмосферном давлении.
Жидкий хлор — жёлто-зелёная жидкость, обладающая очень высоким коррозионным действием (за счёт высокой концентрации молекул). Повышая давление, можно добиться существования жидкого хлора вплоть до температуры +144 0 C (критической температуры) при критическом давлении в 7,6 МПа.
Водород — первый элемент периодической системы элементов. Атом водорода наименьший по размерам и самый легкий среди атомов всех элементов.
Водород самый распространенный элемент во Вселенной. На его долю приходится около 92% всех атомов. Таким образом, водород — основная составная часть звезд и межзвездного газа.
Водород — самый легкий газ, он легче воздуха 14,5 раз. Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г / л (н.у.)
Применяется для получения хлоридов металлов, органических продуктов — хлоропрена, органических красителей, гидролизного спирта, глюкозы, сахара, желатины и клея; для дубления и окраски кож, омыления жиров; при производстве активного угля, крашении тканей, травлении металлов; в гидрометаллургических процессах; в гальванопластике, нефтедобыче.
Хлористый водород получается взаимодействием Н2 и Сl2 при
2400 0 С или NaCl с H2SO4 при 500-550 0 С; как побочный продукт в процессах хлорирования органических соединений; в некоторых процессах неорганической технологии.
Хлористый водород — бесцветный газ с резким запахом. Т плавления -114,2 0 С; Т кипения — 85,1 0 С; плотность — 1,639 г / л; давление паров 25,46 кгс / см 2 (0 0 С), 45,58 кгс / см 2 (20 0 С); коэффициент растворимости в воде 485,6 (20 0 С), 477,2 (30 0 С). В воздухе образует белый туман. Образует ряд жидких гидратов. Сухой хлористый водород на металлы почти не действует.
Соляная кислота — это прозрачная бесцветная или желтоватая жидкость без взвешенных или эмульгированных частиц
Соляная кислота применяется в химической, медицинской, пищевой промышленности, цветной и черной металлургии.
Отгрузка производится железнодорожными цистернами, в полиэтиленовых бочках емкостью 20-45 3, в полиэтиленовых канистрах емкостью 20, 40 и 50 дм 3 .
Кстати, известный факт, что соляная кислота содержится в желудочном соке (около 0,3%) и играет важную роль, так как способствует перевариванию пищи и убивает различные болезнетворные бактерии (холеры, тифа и др.). Если последние попадают в желудок вместе с большим количеством воды, то вследствие разбавления раствора НСl они выживают и вызывают заболевание организма. Поэтому во время эпидемий особенно опасна сырая вода. При повышении концентрации НСl в желудке ощущается «изжога», которую устраняют, принимая внутрь небольшое количество NаНСО3 или МgО. Наоборот, при недостаточной кислотности желудочного сока соляная кислота прописывается для приема внутрь (по 5-15 капель 8,3%-ной НСl на 1 / 2 стакана воды до или во время еды).
Производство кислоты соляной синтетической освоено в 1962 году. За период эксплуатации производился ремонт, усовершенствовалось технологическое оборудование. Высокое качество сырья позволяет получать кислоту высокого качества. Кислота соляная также применяется в производстве пластмасс, ядохимикатов, полупродуктов и красителей для очистки поверхности металлов от окислов, карбонатов, в электротехнической, текстильной промышленности.
Кислота соляная ингибированная Марка А — применяется для кислотной обработки скважин в нефтяной промышленности с целью улучшения сообщаемоести скважин с пластом (для расширения и очистки пор и трещин, снятия фильтрационного сопротивления коллектора, сложенного карбонатными породами-доломитами и известняками, или загрязненного карбонатными отложениями).
Кислота соляная Марки Б — применяется для травления черных и некоторых цветных металлов и изделий из них, для химической очистки котлов и аппаратов от неорганических отложений.
Соляную кислоту применяют для получения хлоридов Zn, Ba, Mg, Са, Fe, AI и т. д., для травления при пайке и лужении, и цветной металлургии (извлечение Pt, An), при гидролизе древесины, в производстве красителей, для гидрохлорировании органических соединении и т. д.
Водный раствор хлористого водорода назвали соляной кислотой потому, что издавна его получали из поваренной соли, действуя на него серной кислотой. Этот, так называемый сульфатный, способ был долгое время единственным. Затем стали получать синтетический хлористый водород из хлора и водорода.
Кроме того, значительные количества хлористого водорода получают в качестве побочного продукта при хлорировании органических веществ и других продуктов.
Таким образом, в промышленности соляную кислоту получают следующими способами:
— сульфатным — получение хлороводорода действием концентрированной серной кислоты на хлорид натрия;
— синтетическим — получение хлороводорода сжиганием водорода в хлоре;
— из абгазов (побочный газов) ряда процессов.
Стоит отметить, что первые два метода теряют свое промышленное значение.
Более старинный сульфатный метод получения соляной кислоты.
Сульфатный способ получения хлористого водорода основан на взаимодействии твердой поваренной соли с серной кислотой:
Процесс синтеза проводят в муфельных печах при температуре 500-550 0 С, обогрева-емых через стенку топочными газами. Концентрация хлористого водорода в газе от 30 до 50% НСl. Способ находит применение, но новых производств не организуют.
При синтетическом способе синтез хлорис-того водорода проводится по реакции:
Cyxoй хлор и водород при нормальных условиях и в темноте не реагируют между собой, но на свету или при нагревании в присут-ствии паров воды реакция взаимодействия их сопровождается взрывом.
Синтез проводят при избытке 5-10% водорода и высокой температуре в печи, корпус которой изготовляют из углеродистой или легированной стали, а крышку из асбеста. Нижняя часть печи выложена огнеупорным материалом. В ней помещена горелка, состоящая из двух концентрически расположенных стальных трубок. По наружной трубке в печь подается водород, а по внутренней — хлор. Которые на выходе из горелки смешиваются и спокойно реагируют образуя факел горения с температурой 2000-2400 0 С.
Абсорбция хлористого водорода в воде идет с выделением большо-го количества тепла (образование гидратов), которого достаточно для нагревания кислоты до кипения. Для получения более концентриро-ванной соляной кислоты необходим отвод тепла, так как растворимость хлористого водорода в воде с повышением температуры уменьшается.
Поглощение НСl проводят в абсорберах с отводом тепла. Через стенку (изотермическая абсорбция) или с отводом тепла в результате испарения части воды (адиабатическая абсорбция).
Более 90% соляной кислоты в настоящее время получают из абгазного хлороводорода HCl, образующегося при хлорировании и дегидрохлорировании органических соединений, пиролизе хлороорганических отходов, хлоридов металлов, получении калийных не хлорированных удобрений и др.
Абгазные газы содержат различные количества хлороводорода, инертные примеси (N2, H2, CH4). При содержании инертных примесей менее 40%, является целесообразным применение изотермической абсорбции. Наиболее перспективными являются абсорберы, позволяющие извлекать из исходного абгаза от 65 — 85% HCl.
В промышленности для получения соляной кислоты наиболее широко применяют адиабатическую абсорбцию. Соляная кислота нагревается до температуры кипения благодаря температуре растворения HCl.
Для перевозки соляной кислоты используется железнодорожный транспорт или специально оборудованные цистерны для перевозки кислот (химические цистерны).
Все цистерны для перевозки соляной кислоты используют устойчивые к ее воздействию.
Соляную кислоту наливают в специальные гуммированные цистерны отправителя или получателя, гуммированные контейнеры, полиэтиленовые бочки вместимостью 50 дм 3 и стеклянные бутыли вместимостью 20 дм 3 , согласно действующей нормативной документации. Допускается заливать продукт в цистерны и контейнеры с остатком соляной кислоты, если анализ остатка подтверждает соответствие его качества требованиям настоящего стандарта. В противном случае остаток соляной кислоты удаляют, а цистерну или контейнер промывают.
Наливные люки цистерн, контейнеры и пробки бочек должны быть герметизированы резиновыми или полиэтиленовыми прокладками, как при отправки потребителям (заполненных кислотой), так и при возврате поставщику порожней тары.
Уровень (степень) заполнения цистерн, контейнеров, бочек и бутылей вычисляют с учетом максимального использования грузоподъемности (вместимости) и объемного расширения продукта при возможном перепаде температуры в пути следования.
Соляную кислоту о соответствии с правилами перевозки опасных грузов транспортируют:
— наливом в железнодорожных цистернах;
— упакованную в контейнеры, бочки и бутыли в ящиках — железнодорожным транспортом в крытых вагонах по вагонными отправками;
— упакованную в контейнеры, бочки., бутыли — автомобильным и водным транспортом.
Соляную кислоту хранят в герметичных резервуарах изготовителя и потребителя, изготовленных из материалов, стойких к соляной кислоте. Срок хранения продукта неограничен.
Основным оборудованием является адиабатический абсорбер.
Движение газа и жидкости в насадочных абсорберах обычно осуществляется противотоком, но созданы абсорберы и с нисходящим прямотоком. Эти колонны работают со скоростями газа до 10м / с, что позволяет интенсифицировать процесс при уменьшенных габаритах аппарата и более низком, чем при противотоке, гидравлическом сопротивлении.
Контрольно — измерительная аппаратура адиабатической системы точна, проста и надежна. Регулятор температуры, контролирующий температуру кипения кислоты нужной концентрации регулирует поток исходной жидкости. С помощью регулятора уровня жидкости постоянно поддерживается уровень кислоты на всасывающем насосе или холодильнике.
В адиабатических системах концентрация кислоты достигает 32%. При получении кислоты с концентрацией более 32% уменьшается эффективность абсорбции.
На переработку можно направлять газ с любой концентрацией HCl.
Схема адиабатического абсорбера представлена в (приложении В)
Общие требования по охране труда
К самостоятельной работе допускаются лица мужского или женского пола не моложе 18 лет, имеющие квалификационную подготовку и прошедшие медицинский осмотр, вводный и первичный на рабочем месте инструктаж по охране труда, обучение, стажировку и проверку знаний по вопросам охраны труда.
Работник при приеме на работу проходит вводный инструктаж. Перед допуском к самостоятельной работе он должен пройти:
— обучение по программам подготовки по профессии;
— первичный инструктаж на рабочем месте;
— по охране труда;
— по оказанию первой помощи пострадавшим при несчастных случаях на производстве;
— по применению средств защиты, необходимых для безопасного выполнения работ;
— по пожарной безопасности.
Допуск к самостоятельной работе оформляется соответствующим распоряжением по структурному подразделению предприятия.
Вновь принятому работнику выдается квалификационное удостоверение, в котором должна быть сделана соответствующая запись о проверке знаний инструкций и правили о праве на выполнение специальных работ. Квалификационное удостоверение для дежурного персонала во время исполнения служебных обязанностей может храниться у начальника смены цеха или при себе в соответствии с местными условиями.
Работники, не прошедшие проверку знаний в установленные сроки, к самостоятельной работе не допускаются.
Работники, получившие неудовлетворительную оценку при квалификационной проверке, к самостоятельной работе не допускаются и не позднее одного месяца должны пройти повторную проверку. При нарушении правил охраны труда в зависимости от характера нарушений проводится внеплановый инструктаж или внеочередная проверка знаний.
О каждом несчастном случае или аварии пострадавший или очевидец обязан немедленно известить своего непосредственного руководителя.
Каждый работник должен знать местоположение аптечки и уметь ею пользоваться.
При обнаружении неисправных приспособлений, инструмента и средств защиты работник должен сообщить об этом своему непосредственному руководителю. Не допускается работа с неисправными приспособлениями, инструментом и средствами защиты.
Хлористый водород является токсичным веществом. Отравления вызывает обычно туман соляной кислоты, образующийся при взаимодействии газа с влажным воздухом. При попадании внутрь концентрированного раствора соляной кислоты происходит сильный ожог слизистой оболочки носа, пищевода, желудка. Вдыхание концентрированных паров вызывает сильное раздражение верхних дыхательных путей, в результате чего появляется кашель, удушье и ожог гортани, в отдельных случаях эмфизема легких. Пары безводного НСl или растворы кислоты при попадании на кожу вызывают сильные ожоги, при повторном попадании возникают дерматиты. При длительной работе в атмосфере НСl наблюдаются катары дыхательных путей, разрушение зубов, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства. Стойкие хронические отравления отсутствуют.
Водный и безводный НСl не огнеопасен, однако он быстро растворяется в воде с образованием соляной кислоты, которая взаимодействует со многими металлами с выделением взрывоопасного водорода. Предельно допустимая концентрация НСl в воздухе рабочей зоны производственных помещений 5 мг / м.
При отравлении нужно немедленно вынести пострадавшего на свежий воздух, освободить от стесняющей дыхание одежды и дать кислород. Затем промыть глаза, нос и полость рта 2%-ным раствором бикарбоната натрия. При затруднении дыхания ввести эфедрин, атропин. В более тяжелых случаях для профилактики и печения следует делать ингаляции антибиотиков; при поражении глаз — промыть их водой и ввести 2%-ный раствор новокаина или 0,5%-ный раствор дикаина с адреналином. При попадании концентрированной кислоты на кожу ее следует немедленно смыть водой — струей в течение 5-10 мин.
При работе с соляной кислотой и хлористым водородом необходимо носить шерстяную защитную одежду, прошитую нейлоновыми или шелковыми нитками, или одежду из импрегнированной резины, резиновую обувь, резиновые перчатки, резиновый передник, шляпу или защитный головной убор, защитные очки с обрамлением из резины с пластмассовыми линзами. Работающие должны быть обеспечены фильтрующим промышленным противогазом марки В. При большой утечке газа в производственные помещения применяют шланговые противогазы, маски с автономной подачей воздуха или кислородные аппараты.
Помещения, в которых проводятся работы с НСl, должны быть оборудованы общей приточно-вытяжной вентиляцией. Оборудование должно быть герметизированным. Аппараты снабжаются необходимыми контрольно-измерительными приборами.
Если вам все это удастся проделать, то считайте, что вам повезло, и концентрация кислоты была не большая, потому что сильно концентрированная кислота превратит содержимое вашего живота в кровавую кашу.
При попадании 10% и более концентрированной кислоты на кожу рук, кислоту надо быстро смыть, потом обмыть руки теплой водой и промокнуть туалетной бумагой. Вафельное или махровое полотенце очень грубый материал и при вытирании ими поврежденной кожи, истонченная кислотой кожа может порваться или сняться вообще. Если кислота успела разъесть кожу и появилась рана, рану необходимо намазать антисептиком или заживляющим составом, для этого могут подойти, например, левомеколь, синтомецин, актовегин гель и т.д., не в коем случае не следует мазать поврежденные места йодом или зеленкой. Есть строгое правило, по которому следует разбавлять концентрированную соляную кислоту. Концентрированную кислоту наливают тонкой струйкой в воду при постоянном помешивании. Если сделать наоборот, кислота может вскипеть и произойти резкие выбросы пара и капель, которые могут попасть вам на кожу рук, лица и глаза.
Расчет материального баланса производства синтетической соляной кислоты. Данные для расчета:
Расчет провести на 10т 35% соляной кислоты считать, что хлороводород полностью поглощается сорбентом (водой).
Считать, что 5% воды для растворения хлороводорода испаряется.
Считать, что степень превращения по хлору равна 100%
Учесть, что водород подается с избытком в 5%
Считать, что водород подаётся в печь с чистотой 100%
Считать, что хлор подаётся в печь с чистотой 95%
Расчет массы чистого хлороводорода, содержащегося в потоке соляной кислоты из абсорбера:
Расчет массы воды, необходимой для абсорбции хлороводорода, поступающего из печи:
Расчет массы воды с учетом избытка (испаряемая вода)
производство соляный кислота
Расчет массы хлора, поступающего в печь.
Расчет теоретической массы хлора (без учета процентного содержания хлора в исходном потоке)
Расчет практической массы хлора (с учетом процентного содержания хлора в исходном потоке)
Расчет массы примесей в потоке хлора
Расчет объёма Cl2 в потоке хлора
Расчет массы водорода, поступающего в печь. Расчет теоретической массы водорода (без учета подаваемого избытка)
Расчет практической массы водорода (с учетом подаваемого избытка)
Расчет массы избытка водорода
Таблица 1 — Материальный баланс для потоков входящих и выходящих из печи
Источник









