Получение соляной кислоты сульфатным методом
Сульфатный метод – это самый старый метод получения соляной кислоты. Его используют, когда есть потребность в 
Сульфатный метод протекает по следующим реакциям:
Сырьем для получения хлористого водорода и сульфата натрия служат поваренная соль (обычно измельченная каменная соль – бузун) и купоросное масло – 92 % – 93 % – я серная кислота. Менее концентрированную серную кислоту не применяют, так как в этом случае хлористый водород был бы чрезмерно разбавлен парами воды, что затруднило бы получение концентрированной соляной кислоты. Применение крупнозернистой выварочной соли предпочтительнее вследствие ее пористости – она легко пропитывается кислотой с образованием однородной массы. Однако выварочная соль содержит переменное количество влаги, что затрудняет дозировку сырья и регулирование температурного режима печей. Каменная соль характеризуется постоянной влажностью, но она более загрязнена примесями.
Реакция между хлористым натрием и серной кислотой – эндотермическая.
Взаимодействие хлористого натрия с серной кислотой начинается даже при 0 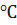
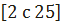
Реакция между поваренной солью и серной кислотой осуществляется в механических или во вращающихся печах.
На рисунке 1 показана механическая сульфатная печь. Она предназначена для получения хлороводорода, представляет собой муфель, под (чаша) 12 и свод 11 которого сложены из фасонных огнеупорных и кислотостойких шамотных плит. Под муфелем и над ним расположены дымоходы. Толщина плит пода 120 мм; свод муфеля для облегчения передачи тепла к реакционной массе делают более тонким – 30 мм. Внутреннюю кладку печи и топки выполняют из шамотного, а наружную – из простого кирпича. Под печью расположен привод мешалки. Поваренная соль через загрузочную воронку непрерывно поступает в центр муфеля с помощью шнекового питателя 8. Туда же по трубе подается купоросное масло. Оно поступает в укрепленный на головке вала и вращающийся вместе с ним распределитель 13 кислоты, имеющий форму чайника, через носик которого сливается в муфель.
1 – шахтная топка; 2 – загрузочная коробка для топлива; 3 – колосниковая решетка; 4 – зольник; 5 – топочный порог; 6 – канал для вторичного воздуха; 7 – загрузочная воронка для соли; 8 – загрузочный шнек для соли; 9 – солевая труба; 10 – кислотная труба; 11 – свод муфеля; 12 – под муфеля; 13 – питатель – распределитель кислоты; 14 – головка мешалки; 15 – вал мешалки; 16 – коронная шестерня привода мешалки; 17 – люк для выхода сульфата натрия; 18 – холодильно – размольный барабан для сульфата; 19 – труба для отвода хлористого водорода.
Рисунок 1 – Механическая сульфатная печь (вертикальный разрез)
Перемешивание поваренной соли и кислоты и передвижение реакционной массы по поду муфеля от центра к периферии производится укрепленной на чугунном валу 15 мешалкой с четырьмя плечами, расположенными крестообразно, на каждом из которых имеется по два (всего восемь) термосилидовых или чугунных гребков с керамическими или корборундовыми наконечниками. Вращение вала (0,75 – 1,25 об/мин) производится через зубчатую передачу электромотором мощностью 4,5 квт при диаметре муфеля 4,25 м и 6,8 квт при диаметре муфеля 5,5 м.
Обогрев муфеля, температуру в котором поддерживают в пределах 500 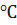
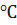
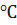
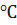

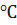
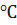
Полученный хлористый водород отправляется на абсорбцию. В соответствии с этим абсорбционные установки сооружены таким образом, чтобы обеспечить наиболее полный отвод тепла гидратации HCl. Обычно газ вначале охлаждают в длинных газопроводах и керамических холодильниках. Охлаждение совмещают с осушкой газа, что дает возможность получать более концентрированную соляную кислоту до 37 % 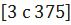
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Источник
ПОЛУЧЕНИЕ ХЛОРИСТОГО ВОДОРОДА
Сырьем для получения хлористого водорода и сульфата натрия служат поваренная соль (обычно измельченная каменная соль — бузун) и купоросное масло — 92—93%-ная серная кислота. Менее концентрированную серную кислоту не применяют, так как в этом случае хлористый водород был бы чрезмерно разбавлен парами воды, что затруднило бы получение концентрированной соляной кислоты. Применение крупнозернистой выварочной соли предпочтительнее вследствие ее пористости — она легко пропитывается кислотой с образованием однородной массы. Однако выварочная соль содержит переменное количество влаги, что затрудняет дозировку сырья и регулирование температурного режима печей. Каменная соль характеризуется постоянной влажностью, но она более загрязнена примесями CaS04, Fe203 и другими (см. гл. III), переходящими в сульфат натрия. Помимо этого, применение каменной соли связано с необходимостью ее измельчения и более интенсивного перемешивания с серной кислотой34.
Физико-химические основы взаимодействия хлористого натрия с серной кислотой
Реакция между хлористым натрием и серной кислотой 2NaCl + H2S04 = Na2SO., + 2НС1
— эндотермическая. При применении серной кислоты концентрацией меньше 100% расход тепла на реакцию увеличивается за счет дегидратации серной кислоты. В табл. 31 приведены значения теплового эффекта АН и изменения изоба^ ого потенциала AZ для Некоторых реакций взаимодействия NaCl С серной кислотой и кислыми сульфатами натрия при различных температурах85.
Значения ДИ и SZ Реакций взаимодействия хлористого натрия с серной кислотой и кислыми сульфатами натрия
2NaCI + H2S04 (ж., 100%) «= Na8S04 + 2НС] (г.)
2NaCl + H2S04 (ж., 03%) =
NaCl + H2S04 (ж., 100%) =
NaCl + H2S04 (ж., 93%) = NaHS04 +
NaCl+2NaHS04 = Na3H(S04)2 + HCl (г.)
NaCl + Na3H(S04)s = 2Na2S04 + HCl (г.)
Взаимодействие хлористого натрия с серной кислотой начинается даже при 0° с выделением в газовую фазу почти безводного НС1, но быстро прекращается; жидкая фаза представляет собой раствор образовавшегося сульфата натрия в серной кислоте. При нагревании реакция возобновляется — одновременно с хлористым водородом удаляется водяной пар вследствие дегидратации серной кислоты. Обезвоживание жидкой фазы облегчается тем, что растворение образующегося сульфата натрия в серной кислоте повышает равновесное давление водяного пара.
В системе Na2S04—H2S04—Н20 при 25° существуют следующие твердые фазы: Na2S04 • 10Н20, Na2S04 • 4,5Н20, Na2S04, NasH(S04)2, NaHS04-H20, NaHS04 и NaH3(S04)2 • H20. При 0й существуют эти же фазы и H2S04-H20; NaH3(S04)2 • Н20 находится в метастабильном состоянии, имеется метастабильная фаза Na2S04 • 5,5Н20 36. Однако поскольку реакцию с хлористым натрием ведут при высокой температуре и используют концентрированную серную кислоту, содержащую очень мало воды, вскоре удаляющейся в газовую фазу, практически процессы идут в без
водной системе. В зависимости от температуры реакционной массы образующийся сульфат натрия может полностью оставаться в жидкой фазе или частично кристаллизоваться из нее в виде кислых солей: 2Na2S04-9H2S04, Na2S04 • 2H2S04, Na2S04-H2S04 (бисульфат или гидросульфат натрия NaHS04) и 3Na2S04 • H2S04 [тринатрийгидросульфат Na3H(S04)2]. Нейтральный сульфат кристаллизуется только в заключительной стадии процесса37.
На рис. 114 дана диаграмма растворимости в двойной системе H2S04—Na2S0437. Молярные проценты Na2S04 (верхняя шкала) численно равны степени превращения NaCl в Na2S04. Растворимость сульфата натрия в серной кислоте сильно возрастает, начиная от 4% (вес.) при 0° до 59% при 186°. При повышении температуры до 270° растворимость увеличивается до 67%.
Во избежание преждевременного затвердевания реакционной массы необходимо, чтобы температура на каждой стадии процесса была не ниже той, при которой исчезает жидкая фаза. Реакция в сульфатных печах протекает с высокой интенсивностью, если температурные условия не допускают значительной кристаллизации промежуточных кислых сульфатов натрия. Так, если успела прореагировать третья часть хлористого натрия, а температура при этом еще не достигла 109°, вся масса затвердевает в смесь кристаллов NaCl и Na2S04-2H2S04. Когда в некоторой зоне печи, где температура ниже 186°, NaCl прореагировал на 50%, там будут находиться в твердом состоянии хлористый натрий и бисульфат натрия— жидкая фаза будет отсутствовать. Если NaCl прореагировал на 75% и температура будет ниже 270°, реакционная масса полностью затвердевает, образуя конгломерат, состоящий из остатка NaCl и Na3H(S04)2. Последний особенно часто образуется в сульфатных печах. Выше 270° тринатрийгидросульфат инконгруэнтно плавится, и освобождающаяся серная кислота реагирует с оставшимся хлористым натрием — появляется кристаллический нейтральный сульфат натрия.
Примерное содержание NaCl И Na2S04 В реакционной массе при различной степени разложения NaCl
NaCl, вес. К Na2S04, вас. К разложения NaCl,
Источник
Свойства хлороводорода, способы получения
Хлороводород — что это такое, формула
Хлороводород — это бесцветный газ с резким неприятным запахом.
Формула: HCl
Строение его молекулы определяет название соединения. Атомы хлора и водорода соединены ковалентной полярной связью.
Физические и химические свойства
- Тяжелее воздуха.
- Соединение хорошо растворяется в воде. Раствор хлороводорода в воде называют соляной кислотой.
- Хлороводород может менять агрегатное состояние под воздействием температуры. При -85,1°C образуется бесцветная жидкость, а при -114,22°C он переходит в твердое (кристаллическое) состояние.
- Имеет способность поглощать пары воды из воздуха, поэтому при высокой влажности дымится.
- Молярная масса 36,4606 г/моль.
- Плотность равна 1,477 г/л, в газообразном состоянии при 25 °C.
- Температура плавления −114,22 °C.
- Температура кипения −85,1 °C.
- Температура разложения 1500 °C.
Раствор хлороводорода в воде называют соляной кислотой. Процесс растворения можно описать с помощью следующего уравнения реакции:
H C l + H 2 O → H 3 O + + C l —
При растворении хлороводорода выделяется большое количество теплоты.
Соляную кислоту относят к сильным одноосновным кислотам. Соединение активно вступает в химические реакции со следующими веществами:
- металлы, расположенные в ряду напряжений с левой стороны от водорода;
- основные и амфотерные оксиды;
- основания;
- соли.
В результате такого взаимодействия формируются соли соляной кислоты — хлориды:
M g + 2 H C l → M g C l 2 + H 2 ↑
F e O + 2 H C l → F e C l 2 + H 2 O
Хлориды можно часто встретить в природном мире. Вещества широко применяются в современной промышленности. В качестве примеров можно привести галит N a C l и сильвин K C l . В распространенных случаях хлориды обладают высокой степенью растворимости в воде и способны полностью диссоциировать на ионы в водных растворах (являются сильными электролитами). Слабой растворимостью отличаются следующие соединения:
- хлорид свинца ( I I ) P b C l 2 ;
- хлорид серебра A g C l ;
- хлорид ртути ( I ) H g 2 C l 2 ;
- хлорид меди ( I ) C u C l .
Свойства
В присутствии сильных окислителей или в процессе электролиза хлороводород способен проявлять свойства восстановителя, при этом окисляясь с выделением газообразного хлора:
M n O 2 + 4 H C l → M n C l 2 + C l 2 ↑ + 2 H 2 O
В условиях повышенной температуры происходит окисление хлороводорода кислородом в присутствии катализатора, роль которого играет хлорид меди ( I I ) C u C l 2 :
4 H C l + O 2 → 2 H 2 O + 2 C l 2 ↑
Концентрированная соляная кислота взаимодействует с медью, что сопровождается образованием комплекса одновалентной меди:
2 C u + 4 H C l → 2 H [ C u C l 2 ] + H 2 ↑
Смесь, в состав которой входят три объемные части концентрированной соляной кислоты и одна объемная часть концентрированной азотной кислоты, носит название «царская водка». Данная смесь способна растворять золото и платину.
«Царская водка» характеризуется высокой окислительной способностью, что объясняется наличием в составе смеси хлористого нитрозила N O C l и хлора, находящихся в равновесии с исходными веществами:
4 H + + 3 C l — + N O 3 — → N O C l + C l 2 + 2 H 2 O
За счет большого содержания хлорид-ионов в растворе происходит связывание металла. В результате образуется хлоридный комплекс, что является причиной его растворения:
3 P t + 4 H N O 3 + 18 H C l → 3 H 2 [ P t C l 6 ] + 4 N O + 8 H 2 O
В процессе присоединения хлороводорода к серному ангидриду происходит образование хлорсульфоновой кислоты H S O 3 C l :
S O 3 + H C l → H S O 3 C l
Хлороводород вступает в реакции присоединения по кратным связям в органических соединениях (электрофильное присоединение):
R — C H = C H 2 + H C l → R — C H C l — C H 3
R — C ≡ C H + 2 H C l → R — C C l 2 — C H 3
Взаимодействие с основаниями
Соляная кислота взаимодействует практически со всеми основаниями. При этом протекают реакции ионного обмена, в результате которых получают соль и воду:
- с гидроксидом натрия: H C l + N a O H → N a C l + H 2 O ;
- с гидроксидом меди: 2 H C l + C u ( O H ) 2 → C u C l 2 + 2 H 2 O ;
При смешении соляной кислоты с аммиаком протекает реакция присоединения. В результате взаимодействия образуется соль в виде хлорида аммония. Уравнение реакции будет выглядеть так:
H C l + N H 3 → N H 4 C l
Соляная кислота также вступает в реакцию с амфотерными гидроксидами, которые в данном случае проявляют основные свойства. Взаимодействие с гидроксидом цинка:
2 H C l + Z n ( O H ) 2 → Z n C l 2 + 2 H 2 O
Способы получения, область применения
Лабораторный способ получения хлористого водорода заключается в реакции концентрированной серной кислоты с твердым хлоридом натрия (поваренной солью) в условиях повышенной температуры:
N a C l + H 2 S O 4 → N a H S O 4 + H C l ↑
Хлороводород синтезируют с помощью гидролиза ковалентных галогенидов, к примеру, хлорида фосфора(V), тионилхлорида S O C l 2 , и гидролиза хлорангидридов карбоновых кислот:
P C l 5 + H 2 O → P O C l 3 + 2 H C l
R C O C l + H 2 O → R C O O H + H C l
Устаревший промышленный способ получения хлористого водорода заключался в методике Леблана. В процессе реакции твердый хлорид натрия взаимодействует с концентрированной серной кислотой.
В современной промышленности хлороводород производят с помощью прямого синтеза из простых веществ:
H 2 + C l 2 ⇄ 2 H C l + 184 , 7 к Д ж
В промышленных масштабах хлористый водород производят на специальных установках путем сжигания водорода в хлоре. Причем водород попадает в пламя в небольшом избытке. Тогда весь объем подаваемого хлора реагирует, и на выходе получается продукт более высокого качества.
Газообразный хлороводород практически не используется из-за его физических и химических характеристик. Широкое применение находит соляная кислота:
- Металлургия. Вещество используют, как средство для очистки руд. Может также применяться для удаления ржавчины и производства паяльной кислоты, необходимой в области точного машиностроения.
- Производство бытовой химии.
- Медицина. Кислота применяется в смеси с пепсином в качестве лекарства от пониженной кислотности желудка.
- Пищевая промышленность. Регулятор кислотности (пищевая добавка Е 507 ) .
Техника безопасности
При попадании хлороводорода в дыхательные пути может наступить сильное удушье. А его водный раствор высокой концентрации вызывает химические ожоги. Поэтому работать с хлористым водородом и соляной кислотой следует только в маске (респираторе), защитных перчатках и очках.
При вдыхании газа необходимо немедленно вывести пострадавшего на воздух и при необходимости сделать искусственное дыхание. В случае проглатывания соляной кислоты требуется промывание желудка.
Если кислота попала на кожу, пораженный участок следует промыть водой и обработать слабым раствором соды, который нейтрализуют кислоту. В случае попадания на слизистые оболочки после промывания нужно закапать глаза, нос или горло раствором новокаина и дикаина с адреналином.
Источник









