- Научная электронная библиотека
- Глава 1. ПРЕПАРАТЫ, ПРИМЕНЯЕМЫЕ ПРОТИВ КОККОВЫХ ИНФЕКЦИЙ
- Пожиратели бактерий: убийцы в роли спасителей
- Пожиратели бактерий: убийцы в роли спасителей
- «Био/мол/текст»-2016
- Открытие
- Происхождение
- Строение и классификация
- Взаимодействие с бактериями
- Бактериальный иммунитет
- Получение бактериофагов
- Биологическое значение бактериофагов
- Лабораторное и промышленное применение бактериофагов
- Применение бактериофагов в медицине
- Заключение
Научная электронная библиотека
Перетрухина А. Т., Блинова Е. И.,
Глава 1. ПРЕПАРАТЫ, ПРИМЕНЯЕМЫЕ ПРОТИВ КОККОВЫХ ИНФЕКЦИЙ
Стафилококковая инфекция
Стафилококки относятся к 17 группе (Грамположительные кокки) по определителю Берджи.
Стафилококки входят в состав нормальной микрофлоры кожи и слизистых оболочек, сообщающихся с внешней средой. Поэтому стафилококковая инфекция может возникнуть как эндогенная (аутоинфекция) при снижении уровня иммунологической защиты или нарушении целостности кожно-слизистых барьеров. Также может развиваться и как экзогенная при инфицировании циркулирующими в окружающей среде штаммами, в том числе и больничными.
Клинические проявления стафилококковой инфекции определяются как биологическими особенностями штамма, так и локализацией процесса и уровнем специфических и неспецифических механизмов защиты.
Стафилококки имеют сложное антигенное строение (свыше 50 антигенов, отличающихся по строению и локализации).
Стафилококки — условно-патогенные микроорганизмы. Способность отдельных штаммов вызвать те или иные формы стафилококковой инфекции во многом определяется их способностью продуцировать тот или иной набор токсинов и ферментов агрессии и защиты.
Стафилококки продуцируют комплекс секретируемых экзотоксинов. Это мембраноповреждающие токсины — α-, β-, δ- и γ-гемотоксины. Повреждая мембраны, каждый из них разрушает эритроциты, лейкоциты, макрофаги и другие клетки. Кроме того, стафилококки могут образовывать энтеротоксины, эксфолиативный токсин, токсин, вызывающий развитие синдрома токсического шока.
К ферментам агрессии и защиты относится многочисленная группа секретируемых белков-ферментов: плазмокоагулаза, гиалуронидаза, фибринолизин, лецитиназа, протеаза, ДНК-азы и др. Они обеспечивают распространение стафилококков по тканям и органам и защищают их от действия антимикробных механизмов организма.
Противостафилококковый иммунитет складывается из антитоксического и антимикробного компонентов. Для создания искусственного иммунитета применяются стафилококковый анатоксин и вакцина.
Для лечебных целей изготавливается стафилококковый антифагин, а для диагностических — типовые бактериофаги.
Стафилококковый анатоксин
1. Нативный стафилококковый анатоксин
Готовый препарат прозрачен, желтоватого цвета. Применяется он подкожно для терапевтических целей при различных заболеваниях стафилококковой этиологии (стафилодермия, хронический и рецидивирующий фурункулез, карбункулы, остеомиелиты, септицемия и др.). В этих случаях проводится серия инъекций с интервалами в 3-5 дней, в дозах, начиная от 0, 1 до 2 мл. Разница между предыдущими и последующими дозами равна 0,2-0,3 мл в каждом случае при назначении дозы препарата необходимо руководствоваться интенсивностью местной и общей реакции, наблюдавшейся после предыдущей инъекции.
С профилактической целью анатоксин вводят подкожно трехкратно в дозах 0,5-1,0-1,0 мл с интервалами в 20 дней между первой и второй и 10 дней между второй и третьей инъекциями. Через 3 и 12 месяцев, а также в тех случаях, когда можно думать о возможности массивного загрязнения стафилококками, производится ревакцинация дозой в 1 мл.
Срок годности нативного стафилококкового анатоксина 1 год со времени окончания биологического контроля.
2. Очищенный концентрированный сорбированный стафилококковый анатоксин
Анатоксин хранится в темном, сухом месте при температуре 4-10 °С. Замораживание и оттаивание, даже однократное, приводит препарат в негодность.
Показания к применению очищенного концентрированного сорбированного стафилококкового анатоксина те же, что и для нативного анатоксина. Вводится препарат подкожно, дважды с интервалом 30-45 дней в дозах 0,5 мл. Ревакцинация той же дозой через 3 месяца и 1 год, а также по специальным показаниям.
Срок годности очищенного концентрированного анатоксина 2 года со дня контроля его биологических свойств. По истечении этого срока препарат может быть переконтролирован в институте, изготовившем его.
Стафилококковая вакцина
Препарат представляет собой взвесь убитых нагреванием стафилококков, антигенный комплекс которых является его действующим началом.
Для приготовления вакцины применяют штаммы золотистых и белых стафилококков, выделенные от больных с различными гнойничковыми поражениями кожи. Они должны обладать всеми признаками, характерными для безусловно-патогенных стафилококков.
Препарат предназначен для специфической иммунотерапии при различных процессах стафилококковой этиологии. Вводится вакцина подкожно и внутримышечно в дозах от 0,1 до 1,0 мл с интервалами в 3-4 дня (всего 10-12 инъекций). Необходимо учитывать степень общей, местной и очаговой реакции. Если предполагается высокая сенсибилизация организма, вакцина разводится 1:10 и даже 1:100.
Срок годности препарата — 1 год.
Стафилококковый антифагин
В основе действия антифагина лежит его способность вызывать образование агглютининов и опсонинов в организме иммунизированных им людей и животных, что повышает устойчивость их к инфекции. Систематический курс лечения антифагином приводит также к десенсибилизации организма больных.
Препарат представляет собой фильтрат двухсуточных культур стафилококков, прогретых при 100 °С в течение часа.
Срок годности его 2 года с момента определения активности: по истечении срока годности допускается продление его на год при условии сохранения специфической активности.
Стафилококковые диагностические типовые бактериофаги
Стафилококковые типовые бактериофаги представляют собой высушенные лиофильным методом стерильные фильтраты фаголизатов эталонных штаммов стафилококка (4 группы — 22 типа).
Предназначены типовые бактериофаги для идентификации и типирования патогенных, коагулазоположительных штаммов стафилококка.
Срок годности препарата — 1,5 года.
Стрептококковая инфекция
Стрептококки относятся к 17 группе (Грамположительные кокки) по определителю Берджи.
Стрептококки — условно-патогенные микроорганизмы. Обитают на слизистых оболочках верхних дыхательных путей, пищеварительного и мочеполового трактов. Поэтому вызываемые ими заболевания имеют как эндогенное, так и экзогенное происхождение. Стрептококки способны поражать любые органы и ткани, вызывая различные заболевания: от ангины до сепсиса. К специфическим проявлениям стрептококковой инфекции относятся скарлатина и рожистое воспаление.
Стрептококки имеют сложное антигенное строение. По локализации их антигены делят на экстрацеллюлярные (антигены токсинов и ферментов агрессии и защиты, капсульные) и целлюлярные (поверхностные и глубокие).
Факторы вирулентности стрептококков весьма разнообразны. Прежде всего это белки клеточной стенки в комплексе с тейхоевыми кислотами, обеспечивающие адгезию стрептококков на клетках тканей и органов.
М-белок стрептококков является протективным антигеном. Он нарушает процессы фагоцитоза, из-за сходства в строении с антигенами сердечной и почечной ткани становится причиной аутоиммунных процессов.
Fc-белок стрептококков неспецифически связывается с Fc-фрагментом иммуноглобулинов классов G и A, также вызывая аутоиммунные конфликты.
Токсины стрептококков — стрептолизин О и стрептолизин S. Первый обладает гемолитическим, лейко- и кардиотоксическим действием, второй — гемолитическим и цитотоксическим. Некоторые виды продуцируют эритрогенный токсин, вызывающий паралич капилляров.
К факторам вирулентности относится и капсулообразование, что особенно четко выражено у пневмококков.
Стрептококки продуцируют широкий набор ферментов агрессии и защиты: стрептокиназа (фибролизин), стрептодорназа (ДНК-аза), гиалуронидаза, протеазы, пептидазы, липаза и др.
В настоящее время с диагностическими целями для выявления аллергии и степени выраженности аллергического состояния у больных хронической, рецидивирующей стрептококковой инфекцией применяются комплексные микробные аллергены для кожных проб, аллерген гемолитического стрептококка (фиброаллерген).
Для определения напряженности иммунитета к скарлатине применяется кожная проба (реакция Дика) с очищенным токсином скарлатинозного стрептококка.
Аллерген гемолитического стрептококка (фиброаллерген)
Препарат представляет собой очищенный фильтрат бульонных культур гемолитического стрептококка. Дозируется он в кожных дозах и вводится внутрикожно в объеме 0,1 мл для выявления аллергии и степени выраженности аллергического состояния у больных хронической, рецидивирующей стрептококковой инфекцией.
Положительная реакция проявляется в гиперемии, инфильтрации и болезненности в месте введения препарата.
Учет реакции производится через 2, 24 и 48 часов, интенсивность ее оценивается по четырехплюсовой системе (диаметр гиперемии 30 мм и болезненность — ++++; 21-29 мм — +++; 15-20 мм — ++; 10-15 мм — + сомнительная реакция). Если на введение одной и двух кожных доз реакция отсутствует, можно ввести 4 кожных дозы в объеме 0,1 мл через 48 часов после первых инъекций.
Высокоочищенный эритрогенный (скарлатинозный) токсин
для реакции Дика
Для определения напряженности иммунитета к скарлатине применяется кожная проба (реакция Дика) с очищенным токсином скарлатинозного стрептококка. Сырьем для изготовления препарата служит токсин, продуцируемый на жидкой питательной среде гемолитическим стрептококком группы А, типа 10 (штамм Доше №5).
Приготовленный сухой очищенный токсин разводят таким образом, чтобы в 0,1 мл содержалось по 1, 4, 10 и 20 кожных доз (1 кожная доза — минимальное количество токсина, дающее эритему 15-20 мм при интенсивности ++). Разведенный токсин разливают по 2 мл.
Реакцию Дика ставят путем внутрикожного введения токсина в объеме 0,1 мл в среднюю часть внутренней поверхности предплечья. У неиммунных лиц наблюдается положительная реакция в виде гиперемии в области введения препарата.
Срок годности токсина 6 месяцев со дня разведения.
Комплексные микробные аллергены для кожных проб
Препараты представляют собой инактивированную суспензию микробных тел стафилококков золотистого и белого, кандида, кишечной палочки, бета-гемолитического и зеленящего стрептококков.
При внутрикожном введении 0,1 мл аллергена он вызывает в сенсибилизированном организме аллергическую реакцию трех типов: замедленную, немедленную, а также комбинированную. Учет реакции осуществляется так же, как и при введении аллергена гемолитического стрептококка.
Аллергены гемолитического стрептококка, энтерококка и гемолитического стафилококка
Препараты представляют собой термостабильные фракции, выделенные из фильтратов 5-6 дневных бульонных культур путем осаждения трихлоруксусной кислотой и спиртом. Для приготовления аллергенов используются термостабильные фракции культур 2-3 штаммов каждого вида микроорганизмов. Дозируются аллергены в кожных дозах. Диагностическими считаются положительные реакции на 1, 2, 4 кожных дозы аллергена гемолитического стрептококка и на 1, 2, 4, 10 доз гемолитического стафилококка и энтерококка.
Препараты вводятся внутрикожно в объеме 0,1 мл. Учет реакции производится так же, как и при введении аллергена гемолитического стрептококка.
Срок годности препаратов — 1 год.
Гонококковая инфекция
Возбудитель гонококковой инфекции гонококк Neisseria относится к группе 4 (Грамотрицательные, аэробные/микроаэрофильные палочки и кокки) по классификатору Берджи.
К основным факторам вирулентности гонококков относят способность к адгезии и колонизации эпителиальных клеток слизистой оболочки мочеполового тракта и продукции эндотоксина.
У гонококков имеются белковые антигены наружной мембраны и липополисахаридные антигены клеточной стенки.
В настоящее время гонококковую инфекцию относят к наиболее распространенным инфекционным заболеваниям. Она часто проявляется воспалением верхних и нижних отделов мочеполового тракта, может вызывать воспаления прочих органов и тканей (проктит, фарингит, бленнорея, тазовый перитонит и перигепатит, фарингеальная гонорея). Диссеминирование возбудителя может приводить к пельвиоперитониту, менингитам, артритам, эндокардитам и септицемиям. Перенесенное заболевание не оставляет стойкого иммунитета.
Попадание гонококков в организм не всегда приводит к развитию заболевания, важное значение имеют вирулентность возбудителя, инфекционная доза, место проникновения, функциональное состояние факторов неспецифической резистентности и скорость развития иммунных реакций.
Этиотропная терапия проводится антибиотиками. При хронических формах гонореи в качестве специфического лечебного средства применяется гонококковая вакцина.
Гонококковая вакцина
Гонококковая вакцина представляет собой поливалентный препарат, приготовленный из штаммов, свежевыделенных от больных с разными формами гонореи. Обычно используется не менее двенадцати штаммов, типичных по всем признакам.
Действующим началом препарата является антигенный комплекс убитых гонококков.
Вакцина назначается с лечебной целью при разных формах гонореи, а также для провокации процесса при затрудненной диагностике. Применяется внутримышечно или внутрикожно. Длительность иммунизации определяется лечащим врачом в зависимости от клинических показаний.
Источник
Пожиратели бактерий: убийцы в роли спасителей
17 октября 2016
Пожиратели бактерий: убийцы в роли спасителей
«Враг моего врага — мой друг» — это утверждение как нельзя лучше выражает главную причину интереса человека к вирусам бактерий. Фото фагов: Claudius Schulze.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Сегодня в связи с нарастающей проблемой антибиотикорезистентности ученые всего мира ведут поиски новых антибиотиков и способов борьбы с инфекционными заболеваниями. И всё больше ученые оглядываются на естественный, но почти забытый метод — фаготерапию. Бактериофаги — природные враги бактерий, существовавшие задолго до появления человека. Почему же мы не используем их вместо антибиотиков, которые привели к такой глобальной проблеме, как резистентность бактерий, ну или хотя бы в дополнение к ним? Что это за диковинные создания и могут ли они быть полезны человеку? Безопасны ли они? В этом обзоре мы попытались собрать воедино имеющиеся данные о бактериофагах и показать вам, насколько красив и многообразен их невидимый мир.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2016.
Спонсор номинации — Future Biotech, проект, объединяющий профессионалов и энтузиастов в области биологии и биотехнологий.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Виктор Татарский.
ХХ столетие называют веком атома, нейлона и антибиотиков. С началом массового применения пенициллина в 1943 году медики всего мира получили мощнейший механизм для защиты организма от атак, казалось бы, всех болезнетворных бактерий. И ученые, подхватив знамя антибиотикотерапии, ринулись на поиски и разработку новых антибактериальных средств. Но если мирный атом и синтетические материалы с лихвой оправдали возложенные на них ожидания, то надежды на всемогущество антибиотиков, увы, постепенно тают: резистентность бактерий к ним становится всё шире. 16 сентября 2000 года на Всемирном дне резистентности в Торонто была принята Декларация по борьбе с бактериальной резистентностью [1], а годом позже ВОЗ опубликовала Глобальную стратегию по сдерживанию устойчивости к противомикробным препаратам, в тексте которой есть такие строки: «Без согласованных действий всех стран многие великие открытия, сделанные учеными-медиками за последние 50 лет, могут утратить свое значение из-за распространения антибиотикорезистентности» [2]. Означает ли это, что мы в скором времени вновь окажемся бессильны перед бактериями? Существуют ли альтернативные подходы к борьбе с инфекционными заболеваниями? К счастью, да. Один из них — применение бактериофагов, самых многочисленных, древних и распространенных на нашей планете вирусов [3], существующих на Земле свыше 3 млрд лет и неоправданно заброшенных исследователями в 1960–1970-е годы на фоне успехов антибиотикотерапии.
Открытие
Несомненно, многие бактериологи наблюдали и описывали проявления действия фага на бактериальные культуры. В 1896 году английский бактериолог Э. Ханкин, исследуя антибактериальное действие воды индийских рек, пришел к выводу о существовании агента, проходящего через бактериальные фильтры и вызывающего лизис холерных вибрионов. По некоторым данным, российский микробиолог Н.Ф. Гамалея в 1897 году наблюдал лизис бацилл сибирской язвы. Однако первая научная публикация о фагах — статья 1915 года английского микробиолога Ф. Туорта, в которой он описал инфекционное поражение стафилококков, значительно изменявшее морфологию колоний. Инфекционный агент свободно проходил через бактериальные фильтры, и его можно было переносить из одной колонии в другую. Туорт выдвинул несколько гипотез, объясняющих это явление, в частности — гипотезу о фильтрующемся вирусе, подобном вирусам растений и животных. Однако его работа не привлекла внимания ученых, а Туорт забросил ее из-за службы в армии: началась Первая мировая.
В 1917 году канадский бактериолог Ф. Д’Эрелль независимо от Туорта сообщил об открытии вируса, «пожирающего» бактерий, — бактериофага [4]. Микробиологи того времени считали, что чума свиней вызывается совместным действием микроба и вируса. Д’Эрелль предположил, что схожая этиология и у дизентерии. С помощью свечей Шамберлана он отфильтровал фекалии больных дизентерией и добавил их в пробирки с культурами шигелл, намереваясь ввести смесь бактерий и предполагаемого вируса экспериментальным животным. Однако на следующие сутки он обнаружил, что бульон, в котором росли шигеллы, стал прозрачным, что свидетельствовало о гибели бактерий. Профильтровав бульон из этих пробирок, он снова заразил полученными фильтратами культуры шигелл. И вновь на следующие сутки он обнаружил, что бульон стал прозрачным. Полученное «литическое начало» можно было бесконечно пассировать от одной культуры к другой, что привело Д’Эрелля к мысли о существовании вируса, разрушающего бактерии. В дальнейшем он обнаружил фаги стафилококка, холерного вибриона и сальмонеллы. Учитывая эффективность фагов против патогенных микроорганизмов и их широкое распространение в природе, Д’Эрелль предположил, что они играют определенную роль в развитии иммунитета к инфекционным заболеваниям и выздоровлении.
В 1920–1940-е годы было проведено множество исследований по клиническому применению бактериофагов, однако стабильных результатов получено не было, и на Западе бактериофаги стали в основном объектом изучения биологов. В 1931 году Совет фармации и химии Американской медицинской ассоциации опубликовал обзор 150 работ по фаготерапии, в котором M. Итон и С. Бэйн-Джонс [5] утверждали, что природа фага неживая; возможно, это фермент, и ошибочно связывать воздействие фага на бактерии или его терапевтический эффект с его жизнедеятельностью. Такие выводы способствовали существенному сокращению капиталовложений в исследования по медицинскому применению фагов на Западе.
В СССР в ранние годы бактериофагам уделяли достаточно внимания. В 1923 грузинский микробиолог Г.Г. Элиава, ученик Д’Эрелля, основал в Тбилиси Институт бактериофагов, ставший впоследствии Всесоюзным центром фаготерапии, коллекция которого на сегодняшний день составляет около 3000 фаговых штаммов. Однако успешное применение антибиотиков в 1960–1970-е годы практически похоронило идеи фаготерапии. Так, например, в Большой советской энциклопедии указано: «Антибиотики и другие химиотерапевтические средства оказались эффективнее фагов, в связи с чем их применение с лечебной целью сузилось».
Происхождение
Вопросом о природе бактериофага задавался еще Туорт в своей первой статье. Д’Эрелль в своем фундаментальном труде выдвинул несколько теорий (гипотез) происхождения фагов, из которых две сохранили значение до настоящего времени: «теория вируса» и «регрессивная теория».
В рамках вирусной теории бактериофаги, подобно вирусам растений и животных, рассматриваются как прямые потомки неких очень примитивных форм, существовавших еще до появления клеток, и представляют собой автономные агенты, являющиеся облигатными паразитами бактерий. Этой теории придерживался Д’Эрелль в самом начале своих исследований, и ее принимало как нечто само собой разумеющееся большинство вирусологов. Но эта концепция, по сути, мало что дает, так как в применении к вирусам такие термины, как автономность и паразитизм, трудно поддаются определению, а сама гипотеза сложно доказуема, поскольку нет ископаемых останков вирусов, а их родственные связи можно изучать только методами молекулярной филогенетики [6].
Согласно регрессивной теории, фаги постепенно развивались из более сложных форм жизни путем утраты всей протоплазмы, ненужной для присущего бактериофагу способа существования. Эта гипотеза лучше вписывается в современную биологию, так как промежуточные стадии процесса дегенерации довольно легко себе представить, а постепенную утрату бактериями способности к синтезу можно изучать экспериментально.
Вполне возможно, что бактериофаги произошли из примитивного полового аппарата бактерий, первоначально развившегося для передачи генетического материала от одной бактериальной клетки к другой. Это могло бы объяснить, почему некоторые фаги и в настоящее время способны выполнять эту функцию путем лизогенной конверсии. Теория предполагает, что генетический материал фагов — это редуцированный и модифицированный нуклеоид бактерий, сохранивший гомологию с «прародителем» и потому способный с ним рекомбинировать или даже частично замещать его. Это могло бы объяснить свойства умеренных фагов, способных встраиваться в определенные локусы ДНК клетки-хозяина, становясь частью бактериального наследственного аппарата. В процессе эволюции умеренные фаги могли путем дальнейших мутаций, влияющих на спектр литического действия [7], необратимо превращаться в вирулентные, поражающие хозяев, с которыми они не имели генетического родства. Согласно этой теории, различные штаммы фагов филогенетически не связаны друг с другом, и определенный фаг даже может быть филогенетически ближе клетке-хозяину, нежели другим фагам. Отсюда следует, что если данная теория верна, то между бактериофагами и вирусами животных и растений нет никакого родства, а фенотипическое сходство — чисто внешнее, обусловленное сходной экологией.
Тем не менее биоинформатические подходы — сравнения огромных массивов геномов и фолдингов белков, а особенно «архитектуры» фаговых частиц — всё же позволяют находить у бактериофагов, фагов архей и вирусов в целом филогенетически общие признаки [3], [8].
Строение и классификация
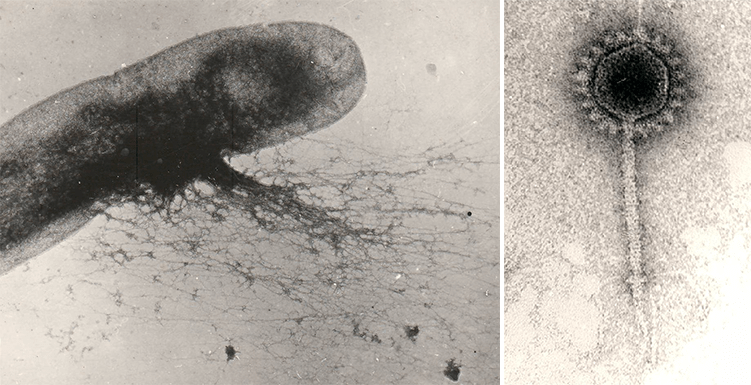
На протяжении почти 70 лет бактериофаги, как и другие вирусы, были для биологов такими же невидимыми, как атомы для физиков, в силу их субмикроскопических размеров. И только в 1942 году, с помощью недавно изобретенного (М. Кнолль, Э. Руска, 1931 г.) электронного микроскопа, будущий нобелевский лауреат С. Лурия (Колумбийский университет) и Т. Андерсон (RCA-лаборатория, Камден, Нью-Джерси) получили первые фотографии бактериофага Т2, или «анти-коли РС», как его называли Лурия и Андерсон (рис. 1).
Рисунок 1. Изображения бактериофага Т2, полученные С. Лурия и Т. Андерсоном с помощью просвечивающего электронного микроскопа: а — первая в мире фотография бактериофага (2 марта 1942 г.); б — бактериофаг Т2 в культуре Escherichia coli (2 марта 1942 г.); в — Т2 «крупным планом» (29 марта 1962 г.).
[42] (фото а и б)
Рисунок 2. Микрофотография фага Т2, полученная с помощью сканирующего электронного микроскопа.
Фаги весьма разнообразны по морфологии — в отличие от вирусов животных и растений. Все известные в настоящее время вирусы эукариот имеют либо форму многогранника (икосаэдра), либо спиралевидный тип симметрии. Что же касается фагов, то среди них тоже встречаются формы со спиралевидным или кубическим типами симметрии, но подавляющее число изученных к настоящему времени фагов сочетает в одной частице оба типа: кубический — у головки, а спиралевидный — у отростка (рис. 2). Столь своеобразное строение фагов, отличающее их от других вирусов, объясняется наличием у бактерий ригидной клеточной стенки, которая исключает возможность проникновения вирионов в клетку путем пиноцитоза или виропексиса. Такая структурная особенность бактерий способствовала формированию у фагов других способов инфицирования, что и нашло отражение в их облике.
Именно морфология легла в основу современной классификации бактериофагов. Казалось бы, целесообразнее разделять фаги по принципу их связи с определенным видом микроорганизма, который они поражают, — что и легло в основу первых классификаций. Но этот принцип не обеспечивает необходимой точности, так как один штамм фага может поражать разные микроорганизмы, то есть иметь широкий литический спектр. И наоборот, один вид бактерий может поражаться несколькими фагами, различающимися между собой по целому ряду свойств, в том числе морфологически, тогда как фаги, активные в отношении разных видов и даже родов микроорганизмов, могут быть морфологически тождественны.
Были попытки классифицировать фаги и по сумме признаков (антигенных, физиологических, биохимических, физико-химических, морфологии негативных колоний, спектру литического действия и т. п.).
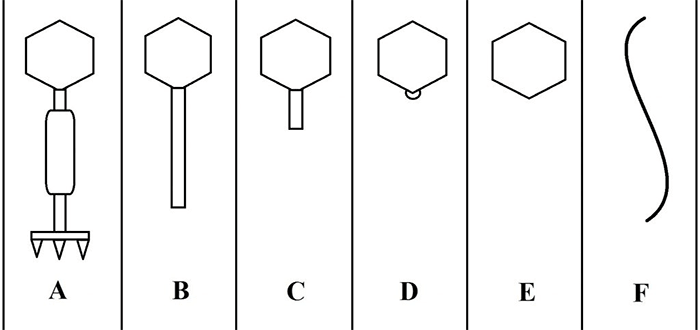
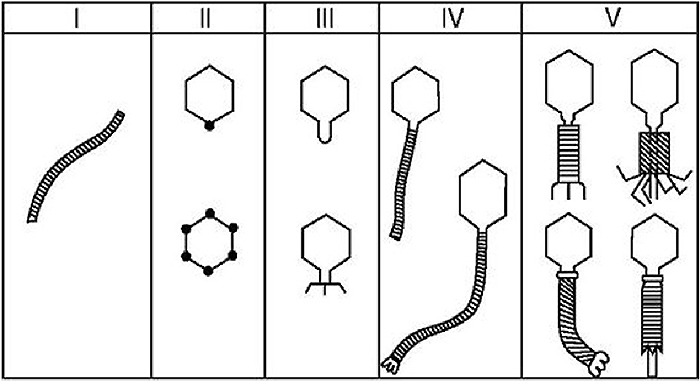
С развитием электронной микроскопии появилась возможность классифицировать фаги по морфологии. Дэвид Бредли в 1967 году предложил разделить фаги на шесть морфологических групп: с A по F (табл. 1, рис. 3). Вторая используемая классификация, предложенная А.С. Тихоненко в 1968, объединяет фаги групп D и E в одну (табл. 1, рис. 4). Микрофотографии фагов, относящихся к разным морфогруппам, представлены на рисунках 5 и 6.
| Группа по Бредли | Группа по Тихоненко | Морфология | Тип нуклеиновой кислоты |
|---|---|---|---|
| A | V | С сокращающимся отростком | Двухцепочечная ДНК |
| B | IV | С длинным несокращающимся отростком | Двухцепочечная ДНК |
| C | III | С коротким несокращающимся отростком | Двухцепочечная ДНК |
| D | II | Без отростка, с капсомерами | Одноцепочечная ДНК |
| E | II | Без отростка и капсомеров | Одноцепочечная РНК |
| F | I | Нитевидные | Одноцепочечная ДНК |
Рисунок 3. Схематическое изображение фаговых морфогрупп по Бредли (1967).
рисунок автора статьи
Рисунок 4. Схематическое изображение фаговых морфогрупп по Тихоненко (1968)
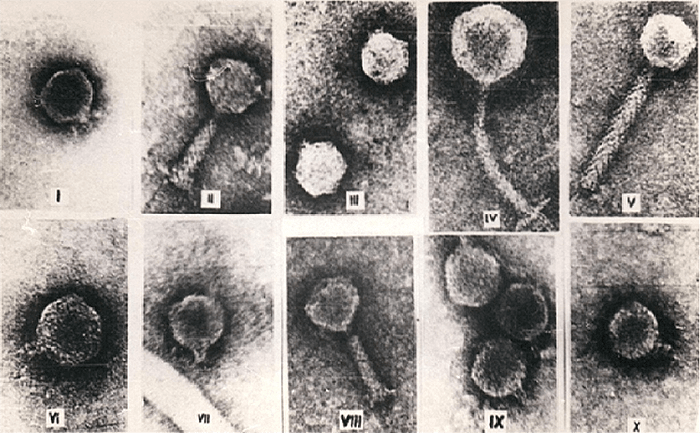
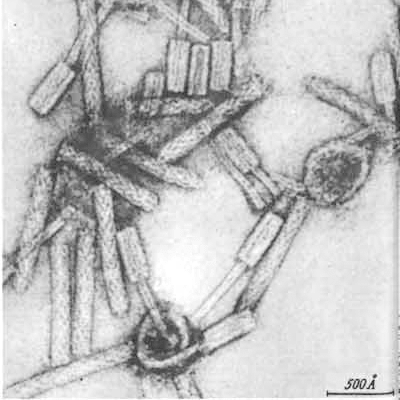
Рисунок 5. Различные морфоварианты бактериофагов.
микрофотографии автора статьи
Рисунок 6. Микрофотографии бактериофагов из разных морфогрупп: а — фаг 1997 Yersinia enterocolitica с длинным несокращающимся чехлом; б — фаг Т3 с коротким отростком; в — фаг МS2 без отростка; г — фаг Х174 без отростка, с капсомерами; д — нитчатый фаг Fd.
микрофотографии автора статьи
Рисунок 7. Схема строения вириона фага семейства Myoviridae
Большинство фагов состоит из головки диаметром 45–140 нм и отростка («хвоста») толщиной 10–40 нм и длиной 100–200 нм (рис. 7). Так выглядят представители порядка Caudovirales («хвостатых фагов»), и именно их образ обычно извлекается из памяти при упоминании термина «бактериофаг». Содержимое головки состоит преимущественно из плотно упакованной молекулы ДНК или (реже) РНК, длина которой во много раз превышает размеры головки и достигает 60–70 мкм (рис. 8), и иногда небольшого количества белка — например, ферментов, которые осуществляют первичную транскрипцию генетического материала фага или способствуют ей. Капсид представляет собой белковую или (не у Caudovirales) липопротеиновую оболочку, собранную из множества копий одного или двух белков. Капсид может быть икосаэдрическим, сферическим, лимоновидным или плеоморфным [9], и именно он, по сути, определяет размер фагового генома.
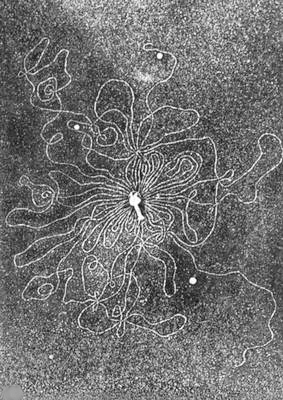
Рисунок 8. Микрофотография бактериофага с высвободившейся нитью ДНК.
Отросток представляет собой белковую трубку, окруженную у ряда бактериофагов (семейства Myoviridae, типовой представитель которого — фаг Т4) чехлом, состоящим из сократительных белков, подобных мышечным, благодаря чему он способен сокращаться, обнажая часть стержня. С головкой отросток стыкуется с помощью белкового кольца — «портала» («воротничка»). На противоположном конце, в основании, отросток содержит лизоцим (как домен белка, пронзающего клеточную стенку), служащий для точечного растворения пептидогликана. Возможно и нахождение в основании отростка АТФазы, обеспечивающей энергией инъекции нуклеиновой кислоты в бактерию [10]. Там же у фагов такого типа имеется гексагональная базальная пластинка с несколькими шиповидными выростами и тонкими длинными нитями, с помощью которых фаг распознает рецепторы «своих» бактерий и прикрепляется к ним.
Нитевидные фаги имеют размеры 8×800 нм и лишены выраженных «органов».
Бактериофаги довольно устойчивы к воздействию различных химических и физических факторов. Они выдерживают колебания рН в пределах 5,0–8,0; большинство резистентно к действию холодных водных растворов глицерина и этанола, а также цианидов, фторидов, динитрофенола, хлороформа, тимола и фенола. Бактериофаги хорошо сохраняются в лиофилизированном состоянии, но разрушаются при кипячении, УФ-облучении, действии некоторых химических дезинфектантов (в частности, кислот и формалина). Фаги хорошо сохраняются при низких температурах (до −200 °С в глицерине), но быстро инактивируются при 65–70 °С [10].
Взаимодействие с бактериями
Фаги — облигатные внутриклеточные паразиты, так как у них нет механизмов для выработки энергии и рибосом для синтеза белка. Размножение фага происходит только внутри бактерии-хозяина и посредством ее синтетической машинерии. Важным свойством бактериофагов является их специфичность: фаги могут поражать определенный вид бактерий (моновалентные фаги) или же только избранные штаммы/варианты внутри вида (типовые фаги, например, фаги V. cholerae classica и El Tor), но некоторые не столь разборчивы и поражают бактерий разных видов и даже родов (поливалентные фаги) [11]. Тем не менее очень сложно судить о специфичности фагов в природных условиях, поскольку там действуют многочисленные методологические ограничения и популяционные закономерности, и порой один и тот же фаг можно принять как за «генералиста», так и за «специалиста» [12].
По характеру действия на бактерии различают вирулентные и умеренные фаги.
- Взаимодействие вирулентного бактериофага с клеткой происходит по литическому пути и складывается из нескольких стадий: его адсорбции на клетке, проникновения в клетку, биосинтеза компонентов фага и их сборки и выхода вирионов из клетки [13].
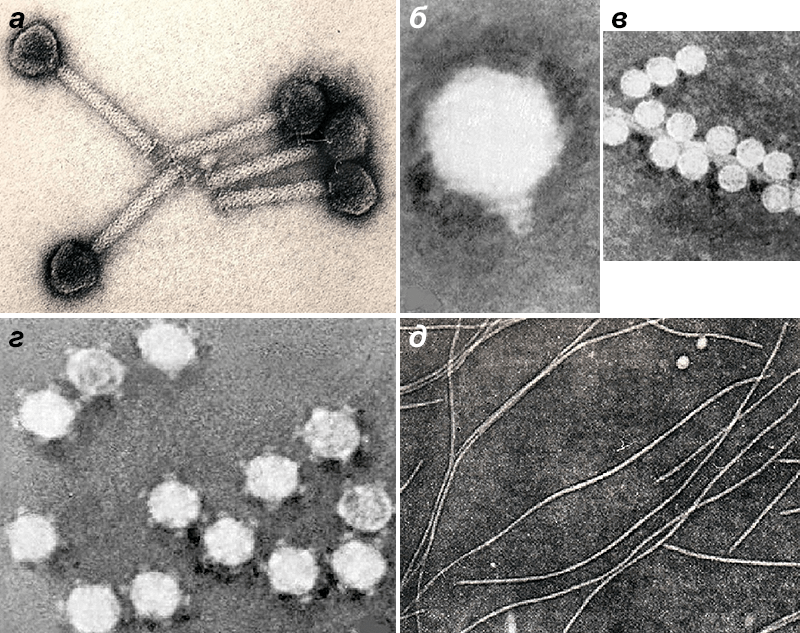
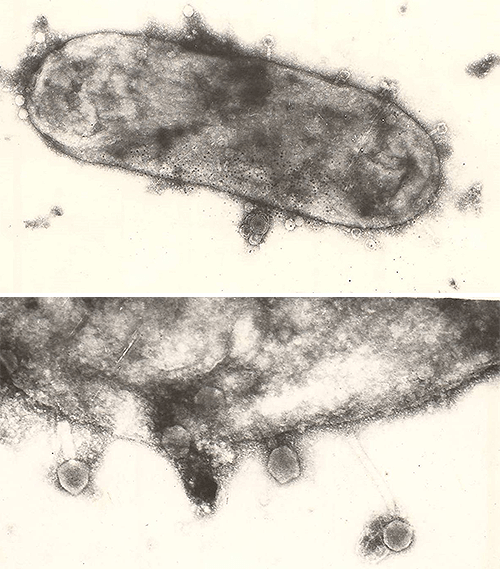
Рисунок 9. Адсорбция фага PIcmlclr 100ts на поверхности Yersinia pestis.
микрофотографии автора статьи
Рисунок 10. Лизис E. coli и выход фаговых частиц. Справа — зрелая форма бактериофага.
микрофотографии автора статьи
Но некоторые фаги способны покидать клетку без лишнего шума. Так делает, например, фаг L2, паразитирующий в бактериях рода Acholeplasma, лишенных клеточной стенки (их знаменитые родственники — микоплазмы). Вначале он проходит все стадии, соответствующие определению «литический цикл» — но за исключением собственно лизиса хозяина: вирионы как бы отпочковываются от бактерии, захватывая небольшие участки ее мембраны, которые становятся оболочкой фага. После такого деликатного литического цикла L2 может приступить к лизогенизации [20].
Рисунок 11. Дефектные фаги — пиоцины (бактериоцины Pseudomonas aeruginosa). Многие бактерии (особенно γ-протеобактерии) экспонируют на своей поверхности тейлоцины (tailocins) — «перевернутых безголовых фагов». Эти фаговые хвосты незаменимы в конкурентной борьбе бактерий с близкими родственниками (такие структуры называют бактериоцинами), а иногда служат для поражения эукариотических клеток (PLTS, фагоподобные структуры для транслокации белков). Гены тейлоцинов бактерии заимствовали у различных профагов семейств Myoviridae и Podoviridae, причем ДНК одной бактерии может содержать несколько генетических кластеров разных тейлоцинов наряду с полноценными родственными либо неродственными профагами, кодирующими все «запчасти» вириона [43]. Размножаться «дефектные фаги» не могут из-за отсутствия головки с ДНК, однако множественные отростки на поверхности клетки-хозяина способны подобно шприцам с токсичным содержимым повреждать клетки жертв.
микрофотография автора статьи
Бактериальный иммунитет
Казалось бы: если бактериофаги атакуют любых бактерий и их численность настолько велика (фаги — самые многочисленные вирусные формы в биосфере Земли, их общее количество — 10 30 –10 32 фаговых частиц [21], что примерно равно количеству бактерий, 4–6×10 30 ), то почему они до сих пор не уничтожили всех бактерий? Ответ очевиден: в процессе эволюционного соразвития бактерии выработали своего рода иммунитет против фагов. Причем иммунитет многослойный. Во-первых, бактерия может быть изначально лишена рецепторов к тому или иному фагу или лишиться их посредством мутаций. Во-вторых, бактерия может быть иммунизирована уже «прописавшимися» в ней профагами, которые с помощью специфических репрессоров просто не дадут вновь прибывшим сородичам размножиться. В-третьих, бактерия (или ее мобильные генетические элементы) кодирует рестрикционно-модификационные системы, которые просто рубят на кусочки нуклеиновые кислоты, не содержащие особых метильных меток — подписей «я свой».
А в-четвертых. В 2005 году стало известно, что функциональной основой бактериального иммунитета является система CRISPR [22], двумя годами позже — что для ее работы критически важен белок Cas, а в 2012-м уже появилась возможность создания инженерных систем на основе CRISPR-Cas9 Streptococcus pyogenes [23]. Работа системы CRISPR-Cas основана на том, что небольшой фрагмент, вырезанный из проникшей в бактериальную клетку фаговой ДНК, вставляется в специальный участок (локус CRISPR) генома бактерии. Каждый локус CRISPR содержит множество таких вставок (спейсеров, разделенных особыми короткими нуклеотидными повторами), представляющих собой фрагменты ДНК встреченных когда-либо фагов и плазмид. На основе спейсеров синтезируются молекулы РНК, комплементарные соответствующему участку фагового (или плазмидного) генома. Эти РНК в комплексе с белками Cas затем опознают и обезвреживают мишень — чужеродную ДНК с комплементарной последовательностью нуклеотидов. Таким образом, если в клетку однажды проникла фаговая ДНК, но клетка выжила и встроила фрагмент чужеродного генома в свой нуклеоид, то последующие попытки таких же фагов эксплуатировать клетку или ее потомков будут неэффективны [24].
Впрочем, бактериофаги за счет случайных мутаций и отбора умеют обходить системы CRISPR-Cas. Чтобы конкретный спейсер потерял эффективность, достаточно даже незначительного изменения комплементарного ему фрагмента фагового генома. Поэтому фаги успешно и довольно быстро преодолевают приобретенный иммунитет бактерий за счет точечных мутаций. С другой стороны, системы CRISPR очень широко распространены у бактерий и, судя по всему, обеспечивают своим обладателям надежную защиту. Эффективность CRISPR обеспечивается тем, что даже две разные бактерии одного и того же штамма встраивают в свой геном разные спейсеры, соответствующие разным участкам генома фага. В результате популяция бактерий быстро приобретает генетическое разнообразие, что значительно повышает их шансы на выживание. Точечные мутации, «обезвреживающие» один спейсер, позволят фагам заразить только небольшую часть бактериальной популяции. К тому же, бактериофаг не может определить заранее, какие спейсеры имеются у конкретной клетки. Поэтому большинство фагов в полиморфной популяции бактерий погибает даже при высокой скорости появления точечных мутаций.
Такой феномен коллективного бактериального иммунитета был продемонстрирован на бактериях P. aeruginosa и фагах DMS3vir [28]. Для начала ученые убедились, что система CRISPR действительно защищает бактерий от данной разновидности фагов, а культуры бактерий с отключенной CRISPR-системой активно этим фагом поражаются, хотя и выработали иную форму защиты: у них распространились мутации, меняющие рецептор, к которому прикрепляется фаг. Такой способ защиты оказался менее эффективным, так как по истечении 30 суток эксперимента бактериофаги всё еще находились в популяции. Чтобы доказать, что разнообразие спейсеров системы CRISPR-Cas — основа эффективности коллективной иммунной защиты, ученые сравнили устойчивость к фагам у бактериальных популяций с разным уровнем разнообразия спейсеров. Оказалось, что фаги в монокультурах бактерий уже в первые сутки приобретали мутации, нейтрализующие соответствующие спейсеры. У фагов же в популяциях, составленных из нескольких клонов бактерий с различными спейсерами, устойчивость формировалась лишь в немногих случаях. В популяциях, сформированных из 24–48 клонов, фаги не смогли преодолеть защиту CRISPR-Cas.
Отсюда следует, что в монокультуре единичная мутация фаговой ДНК, обеспечивающая защиту от конкретного спейсера, позволяет фагу заразить любую бактерию, а в полиморфной культуре из 48 клонов точно такая же мутация обеспечивает успех с вероятностью лишь 1/48. Даже при условии, что ДНК фага встроится в бактерию, защиту которой он преодолел, его потомки снова столкнутся с той же проблемой, и она будет усугубляться по мере снижения численности бактерий, чувствительных к этому фагу.
Таким образом, точечные мутации и отбор — недостаточно эффективная для вирусов эволюционная стратегия, что объясняет успешность систем CRISPR-Cas и их широкое распространение у бактерий. Но тогда почему бактериофаги до сих пор не «вымерли» — раз эта система так эффективна? Не так давно у них обнаружили особые гены, подавляющие работу CRISPR [29]. А что же могут противопоставить бактерии? Ответ, опять же, в разнообразии: существует много разных вариантов системы CRISPR, каждый из которых уязвим только для некоторых анти-CRISPR-генов и защищен от других. Содержать же в своем геноме множество подобных генов бактериофаги не могут, так как отбор у них ведется преимущественно в направлении компактизации генома — в угоду увеличению скорости размножения.
Такая антагонистическая коэволюция фагов и бактерий, протекающая параллельно на разных уровнях и в разных временных масштабах (формирование новых спейсеров бактериями — точечные мутации фагов, выработка новых генов анти-CRISPR — формирование новых вариантов системы CRISPR) позволяет соблюдать баланс в системе «бактериофаг — бактерия» на уровне одной популяции и биоценоза в целом [28], [30].
Получение бактериофагов
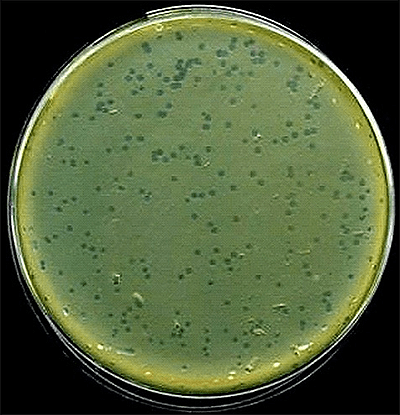
Рисунок 12. Фаговые бляшки (зоны лизиса на культуре E. coli).
Бактериофаги широко распространены в природе. Везде, где есть бактерии — есть фаги. Их можно выделить из открытых полостей организма человека и животных, водоемов, сточных вод, почвы, из соответствующих культур бактерий и т.д. Большое количество бактериофагов находится в выделениях больных людей и животных, особенно в период выздоровления от инфекционных заболеваний.
Таким образом, поиск и выделение новых фагов не представляет трудности. Для выделения бактериофага исследуемый материал (воду, испражнения, гной, почву и др.) засевают в жидкую питательную среду, инкубируют в термостате, и через сутки помутневшую жидкость пропускают через бумажный, а затем через бактериальный фильтры, асбестовые пластины, керамические свечи. Полученный фильтрат исследуют на наличие бактериофага путем совместного посева с подходящей микробной культурой на плотные или в жидкие питательные среды. Если бактериофаг выделился, то после 18-часовой инкубации на поверхности агара вырастает сплошной газон культуры с прозрачными бляшками — зонами лизиса (рис. 12). В бульоне бактериофаг обусловливает просветление среды.
Для выделения чистой культуры бактериофага материал из отдельной бляшки переносят бактериологической иглой в суспензию молодой микробной культуры.
Материал из вновь возникшего стерильного пятна засевают вместе с фагочувствительными микробами в жидкую питательную среду. После 6–18 часов инкубации среду фильтруют и получают чистую культуру бактериофага.
Для изготовления серийного препарата бактериофага применяют только апробированные штаммы и культуры микробов, обладающие типичными морфологическими, биохимическими и серологическими свойствами. Штаммы бактериофагов должны быть музейными и рабочими. Музейные производственные штаммы ежегодно обновляются путем выделения новых или пассажами имеющихся фаговых штаммов через организм больного, а также адаптацией к свежевыделенным, резистентным к данному бактериофагу культурам.
Промышленное получение бактериофага в настоящее время осуществляют в специальных аппаратах — реакторах емкостью 250–1000 л, с применением аэрации как фактора, стимулирующего развитие микроорганизмов. В реактор наливают жидкую питательную среду, которую стерилизуют при температуре 110 °С в течение 40 минут. После стерилизации среду охлаждают до 39 °С и засевают соответствующей микробной культурой и бактериофагом одновременно. Для засева используют 18-часовые агаровые культуры, которые прибавляют из расчета 50 млн микробных клеток на миллилитр среды. Бактериофаг добавляют в количестве не более 0,3 % по отношению к объему питательной среды. Среду с бактериальной культурой и фагом оставляют при температуре 37 °С на 6–18 часов. Фаги активно размножаются внутри бактериальных клеток и вызывают их лизис, что внешне проявляется полным просветлением среды. К полученному лизату добавляют в качестве консерванта хинозол (0,01 %) или фенол (0,25 %) и не позже чем через два часа после этого фильтруют содержимое реактора через бактериальные фильтры для удаления оставшихся микробных клеток.
Полученный препарат бактериофага должен иметь вид совершенно прозрачной жидкости желтого цвета. Он проходит контроль на стерильность, безвредность и литическую активность. Безвредность препарата проверяют путем введения животным. Например, брюшнотифозный и дизентерийный бактериофаги вводят подкожно трем мышам по 1 мл, либо внутривенно одному кролику 5 мл. За животными наблюдают в течение 3–4 суток. Литическую активность бактериофага определяют титрованием в жидкой питательной среде методом Аппельмана, на плотной питательной среде — методом Отто. За титр бактериофага при определении методом Аппельмана принимают то его наибольшее разведение, которое вызывает полный лизис тестовой культуры микроорганизмов.
После проведения контрольных исследований препарат разливают во флаконы нейтрального стекла. Помимо жидких препаратов бактериофага могут изготавливать и сухие. Для их получения фаголизат осаждают сернокислым аммонием, осадок отделяют от жидкой части, добавляют к нему стабилизатор (9 % глюконат кальция), смесь тщательно растирают и лиофилизируют [31].
Биологическое значение бактериофагов
Бактериофаги играют важную роль в круговороте углерода и энергии, контроле численности микробных популяций и эволюции бактерий. Бактериофаги, будучи подвижными генетическими элементами, служат мощным фактором изменчивости бактерий. Например, они осуществляют процесс трансдукции — перенос бактериальных генов из одной клетки в другую: вырезаясь из генома одной бактерии, они могут прихватывать с собой в капсид ее гены и, инфицируя другую клетку, передавать их новому хозяину. Есть все основания предполагать, что большинство бактерий содержит профаги. Многие культуры несут 2–4 и даже более умеренных фагов, то есть являются полилизогенными. Например, многие актиномицеты и клубеньковые бактерии содержат в геноме четырех и более профагов.
Способность фагов менять фенотип бактерий путем привнесения чужеродных (и фаговых в том числе) генов может быть одновременно залогом процветания для бактерий и источником больших проблем для человечества: так бактерии могут приобретать факторы вирулентности и устойчивости — к другим фагам, антибиотикам и прочим воздействиям (если фаг, например, награждает бактерию способностью формировать биопленки) [32]. В 1951 году была описана фаговая конверсия Corinebacterium diphtheriae: оказалось, что ген tox, кодирующий дифтерийный токсин, в геном нетоксигенных бактериальных штаммов привносится умеренным фагом β. В результате коринебактерия производит сильнейший токсин, инактивирующий в человеческих клетках один из компонентов трансляционного аппарата — EF-2 (эукариотический фактор элонгации 2). Подавление синтеза белка проявляется своеобразной дифтерийной симптоматикой. Аналогичные механизмы приобретения патогенных свойств позже выявили у холерных вибрионов, сальмонелл, клостридий и др.
Лабораторное и промышленное применение бактериофагов
Способность фагов к внесению в клетку определенного количества генетического материала, упакованного в капсид, широко эксплуатируется в генной инженерии: их часто используют в качестве векторов различного назначения. Например, для создания библиотек генов нередко конструируют векторы на основе бактериофага λ, содержащего двухцепочечную ДНК. Левое и правое плечи ДНК фага содержат гены, необходимые для литического цикла, а среднюю — несущественную для размножения — часть молекулы можно заменять крупным (примерно до 24 т.п.н.) фрагментом чужеродной ДНК, включая эукариотическую. Такую рекомбинантную ДНК упаковывают в вирионы и заражают ими подходящую культуру бактерий, которая затем многократно воспроизводит фаговую ДНК с интересующими человека фрагментами.
Из-за высокой специфичности многие фаги служат диагностическими инструментами для идентификации бактериальных культур в медицинской, ветеринарной, технической микробиологии и фитопатологии. Метод фаготипирования, основанный на исключительной специфичности определенных фаговых штаммов, позволил распределить на фаготипы ряд штаммов бактерий, неотличимых друг от друга по другим признакам. Фаготипирование с успехом применяют для идентификации типов кишечной палочки, сальмонелл (включая возбудителя брюшного тифа), стафилококков и др. Этот метод дает эпидемиологам возможность отследить цепочку случаев заболевания и определить источник инфекции.
Бактериофаги прекрасно подходят для быстрого обнаружения небольших количеств патогенных бактерий во внешней среде: появляются и множатся хозяева — нарастает титр специфического бактериофага. Определение колифагов стало одним из ключевых мероприятий в санитарном контроле вод, поскольку позволяет выявить фекальное загрязнение даже при малом количестве кишечной палочки, не определяемом бактериологическими методами.
Фаги применяются и в борьбе с бактериальными вредителями различных технических брожений, и в производстве ферментов с помощью бактериальных культур. В то же время, заражая промышленные культуры, бактериофаг вредит «полезным» производственным штаммам (вакцинным, продуцентам антибиотиков, возбудителям молочнокислого, ацетонобутилового и некоторых других брожений), чем вызывает серьезные нарушения технологического процесса.
Применение бактериофагов в медицине
Первый отчет об успешной фаготерапии был опубликован в 1921 году фламандцами Р. Бранохе и Ж. Майсином, которые использовали бактериофаг для лечения кожной стафилококковой инфекции [33].
Как уже было упомянуто, западная медицина c середины ХХ века практически отказалась от использования бактериофагов в терапевтических целях [5], однако в СССР фаги довольно широко применялись. Одним из самых, пожалуй, масштабных примеров практического применения фагов является использование комплексного препарата бактериофагов в Сталинграде во время Великой Отечественной войны. З.В. Ермольева во время работы в Ташкентском институте вакцин и сывороток разработала препарат, содержащий 19 видов бактериофагов, в том числе холерный, брюшнотифозный и дифтерийный. Во время Сталинградской битвы в связи с угрозой эпидемии холеры было налажено производство холерного фага в самом Сталинграде, и препарат ежедневно принимали около 50 тысяч человек [34].
После войны в СССР приступили к промышленному производству фаговых препаратов, которое действует и в настоящее время. В России производством бактериофагов занимаются в основном филиалы НПО «Микроген»: «Иммунопрепарат» (г. Уфа), «ИмБио» (г. Нижний Новгород), «Биомед» (г. Пермь).
На данный момент в РФ зарегистрировано и производится 13 фаговых препаратов (табл. 2).
| Препарат | Применение* | Состав |
|---|---|---|
| Секстафаг®, пиобактериофаг поливалентный жидкий | Для лечения и профилактики заболеваний, вызванных стафилококками, стрептококками, протеями, клебсиеллами, синегнойной и кишечной палочками | Стерильный фильтрат фаголизатов бактерий Staphylococcus, Streptococcus, Proteus (P. vulgaris, P. mirabilis), Pseudomonas aeruginosa, Klebsiella pneumoniae, энтеропатогенных Escherichia coli |
| Интести-бактериофаг | Для лечения и профилактики заболеваний, вызванных стафилококками, стрептококками, протеями, клебсиеллами, синегнойной и кишечной палочками | Смесь стерильных фильтратов фаголизатов Shigella flexneri (сероваров 1, 2, 3, 4, 6), Shigella sonnei, Salmonella enterica (сероваров Paratyphi A, Paratyphi B, Typhimurium, Infantis, Choleraesuis, Oranienburg, Enteritidis), энтеропатогенных Escherichia coli (серогрупп, наиболее значимых в этиологии кишечных инфекций), Proteus vulgaris, Proteus mirabilis, Enterococcus, Staphylococcus, Pseudomonas aeruginosa |
| Пиобактериофаг поливалентный очищенный | Для лечения и профилактики различных форм гнойно-воспалительных заболеваний и инфекций ЖКТ | Стерильный фильтрат фаголизатов Staphylococcus, Streptococcus, Proteus mirabilis, Proteus vulgaris, Escherichia coli, Pseudomonas aeruginosa, Klebsiella pneumoniae |
| Пиобактериофаг комплексный жидкий | Для лечения гнойно-воспалительных заболеваний, обработки операционных и свежеинфицированных ран | Смесь стерильных фильтратов фаголизатов Staphylococcus, Streptococcus, Enterococcus, Proteus (P. vulgaris, P. mirabilis), Pseudomonas aeruginosa, энтеропатогенных Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca |
| Бактериофаг стрептококковый | Для лечения и профилактики заболеваний, вызванных стрептококками | Стерильные фаголизаты Streptococcus spp. |
| Бактериофаг дизентерийный | Для лечения и профилактики дизентерии | Смесь стерильных фильтратов фаголизатов Shigella flexneri (сероваров 1, 2, 3, 4, 6) и Shigella sonnei |
| Бактериофаг стафилококковый | Для лечения и профилактики гнойно-воспалительных и кишечных заболеваний, вызванных стафилококками | Стерильные фаголизаты Staphylococcus spp. |
| Бактериофаг псевдомонас аеругиноза (синегнойный) | Для лечения и профилактики заболеваний, вызванных синегнойной палочкой | Стерильные фаголизаты Pseudomonas aeruginosa |
| Бактериофаг сальмонеллезный групп A,B,C,D,E | Для лечения заболеваний, вызванных сальмонеллами | Стерильный фильтрат фаголизатов наиболее распространенных сероваров Salmonella enterica (Paratyphi А и В, Typhimurium, Choleraesuis, Infantis, Oranienburg, Enteritidis) |
| Бактериофаг клебсиелл поливалентный очищенный | Для лечения и профилактики заболеваний, вызванных клебсиеллами | Стерильная смесь очищенных фильтратов фаголизатов Klebsiella (K. pneumoniae, K. ozaenae, K. rhinoscleromatis) |
| Бактериофаг коли | Для лечения и профилактики заболеваний, вызванных кишечной палочкой | Стерильный фильтрат фаголизатов патогенных штаммов Escherichia coli |
| Бактериофаг протейный жидкий | Для лечения и профилактики гнойно-воспалительных и кишечных заболеваний, вызванных протеями | Стерильный фильтрат фаголизатов Proteus vulgaris и Proteus mirabilis |
| Бактериофаг колипротейный | Для лечения и профилактики гнойно-воспалительных и кишечных заболеваний | Смесь стерильных фильтратов фаголизатов Proteus vulgaris, Proteus mirabilis и энтеропатогенных серогрупп Escherichia coli |
| * Производитель предупреждает, что препараты должны применяться после оценки чувствительности возбудителей болезни к фагам, что означает еще и необходимость идентификации бактерии-возбудителя. Кроме того, в случае тяжелых инфекций фаготерапия допустима только как часть комплексного лечения | ||
Отдельно стоит осветить вопрос применения фаготерапии в странах Запада. Как известно, после открытия антибиотиков работы, связанные с медицинским применением фагов, там были полностью свернуты. Однако в последние годы в связи с тревожной динамикой распространения внутрибольничных инфекций, резистентных к большинству известных антибиотиков, многие биотехнологические компании сделали резкий поворот к изучению возможности создания лекарств на основе бактериофагов. Однако, несмотря на существенные технологические преимущества, для создания эффективных препаратов необходима коллекция бактериофагов, действующих на клинически значимые штаммы возбудителей, и соответствующий опыт их клинического применения, чем эти компании пока не обладают.
В начале 2000-х Гленн Моррис, сотрудник Мэрилендского университета, совместно с НИИ бактериофагов, микробиологии и вирусологии в Тбилиси начал испытания фаговых препаратов для получения лицензии на их применение в США. В итоге в 2006 году использование бактериофагов в США было одобрено — в качестве пищевой антилистерийной добавки (спрей для обработки мяса), а вице-президент США Альберт Гор назвал их «новым оружием для борьбы с болезнетворными бактериями». В некоторых штатах фаготерапию разрешено применять натуропатам или же в качестве дополнительного метода в комплексном лечении, например, ран [35], [36]. В настоящее время на Западе проходят доклинические испытания ряда препаратов природных и генетически модифицированных штаммов бактериофагов, активных в отношении таких коварных бактерий, как Clostridium difficile и Pseudomonas aeruginosa, правда, выход препаратов в продажу планируется только к 2023 году [37]. Есть информация и о прохождении клинических испытаний фаговых препаратов [38].
С терапевтической целью бактериофаги применяют, например, в России, Грузии и Польше, причем самыми разными способами. Для коррекции кишечных дисбиозов жидкие препараты применяют внутрь или per rectum при помощи клизмы. Таблетированные формы принимают внутрь, возможно использование бактериофагов и в составе ректальных свечей. При кожных и раневых инфекциях их применяют в виде примочек на очаги поражения. При фарингитах, ларингитах и тонзиллитах препараты используют для орошения или полосканий, при отитах — закапывают в уши. Для лечения абсцессов в их полость вводят ватный шарик, пропитанный препаратом. Больным, страдающим хроническими остеомиелитами, препарат вводят непосредственно в пораженный участок кости. Также препараты можно вносить в брюшную, плевральную и суставные полости, а также применять в форме аэрозолей при поражениях легких. При инфекциях мочевыводящих путей бактериофаги вливают непосредственно в пораженный орган с помощью зонда. При гинекологических заболеваниях препарат вливают в матку либо применяют влагалищные тампоны, пропитанные фаговым раствором.
А еще их используют в методике под названием фаговый дисплей, которая, в частности, позволяет находить новые антитела для диагностики и терапии заболеваний: «Враг моего врага — мой друг. Как бактерии и вирусы помогают создавать антитела для лечения человека» [39]. — Ред.
Преимущества бактериофагов перед антибиотиками достаточно очевидны.
- Способны уничтожать бактерий, устойчивых к антибиотикам и защищенных биопленками.
- Свободно проникают в кровь и лимфу и выводятся через почки с мочой. Как показано в ряде исследований, после приема 30 мл бактериофага уже через два часа фаговые частицы обнаруживают в моче, их концентрация в ней достигает максимума спустя 6–8 часов после приема [40], [41].
- Не вызывают побочных эффектов и аллергии. Все случаи аллергических реакций при использовании терапевтических бактериофагов были вызваны либо примесями, от которых препарат был недостаточно очищен, либо токсинами, выделяющимися при массовой гибели бактерий (такое явление — реакция Яриша-Герксгеймера — может наблюдаться и при применении антибиотиков).
- Не подавляют рост нормофлоры, не ослабляют иммунитет.
- Подходят для пациентов любого возраста, нет противопоказаний.
- Можно применять как в виде монотерапии, так и в сочетании с антибиотиками, что значительно снижает риск селекции резистентных штаммов бактерий.
- Можно использовать для санации лечебно-профилактических учреждений и для борьбы с госпитальными инфекциями.
- Можно применять для предупреждения инфекционных болезней в эпидемических очагах —вводить лицам с высоким риском заражения и имевшим контакт с больными.
К сожалению, недостатков бактериофаги тоже не лишены.
- Каждый бактериофаг инфицирует только строго определенный вид бактерий или даже определенный штамм, что требует проведения бактериологического исследования биологического материала больного с целью фаготипирования, а следовательно, отсрочивает начало фаготерапии; и хотя в последнее время разрабатываются ускоренные методики определения фаготипа с помощью ПЦР или масс-спектрометрии, внедряются они медленно из-за высокой стоимости и требований к квалификации специалистов.
- Для поддержания активности бактериофаги требуют особых условий хранения и транспортировки.
- Бактериофаги не действуют на внутриклеточных микроорганизмов.
- Многие бактериофаги инактивируются в условиях низкого рН желудка при пероральном применении препаратов, а также ингибируются неспецифическим действием различных факторов в жидкостях организма.
Заключение
Прошло уже 100 лет с момента открытия бактериофагов. Неоправданно забытые на Западе и чудом сохранившиеся в России, они полвека пребывали в тени успеха антибиотиков. Но эпоха триумфа антибиотиков выявила и важнейшую проблему их активного применения — угрожающий рост резистентности к ним среди опасных патогенов, и многие ученые и врачи видят именно в фагах альтернативу антибиотикам. Если на сегодняшний день мы имеем штаммы бактерий, устойчивые даже к антимикробным препаратам «последней надежды», то фаги, благодаря описанным выше механизмам коэволюции с бактериями, никогда не утратят актуальности. За 100 лет они были детально изучены, признаны безопасными и стали незаменимым инструментом в генетике и биоинженерии, санитарной микробиологии и эпидемиологии, промышленности, медицине и даже в космической сфере (да-да, бактерии с профагом используют для оценки защиты обшивки космических кораблей от радиации). И как нельзя лучше характеризует значение фагов для человека древняя пословица: «Враг моего врага — мой друг».
Источник