- Роспотребнадзор (стенд)
- Роспотребнадзор (стенд)
- Иммунитет — основа здоровья — Полезная информация
- Иммунитет — основа здоровья
- Что такое иммунитет?
- Способы защиты организма от генетически чужеродных веществ
- Местный иммунитет (барьерная защита от инфекций)
- Неспецифическая иммунная защита (защита на все возбудители)
- Специфическая иммунная защита (иммунный ответ на конкретный возбудитель)
- Иммунная система человека
Роспотребнадзор (стенд)
Роспотребнадзор (стенд)
Иммунитет — основа здоровья — Полезная информация
Иммунитет — основа здоровья
Иммунитет — основа здоровья
Иммунитет – способность иммунной системы избавлять организм от генетически чужеродных объектов. Иммунитет заложен в человеке с рождения. Эффективность иммунной системы зависит от наследственности, однако правильное питание и здоровый образ жизни могут значительно повысить ее активность.
Иммунная система – это система особых клеток и белков, защищающих организм от болезнетворных микроорганизмов (бактерий, вирусов, грибков, а также от определенных ядов). Иммунная система контролирует развитие раковых клеток, своевременно выявляя и уничтожая те, которые растут бесконтрольно.
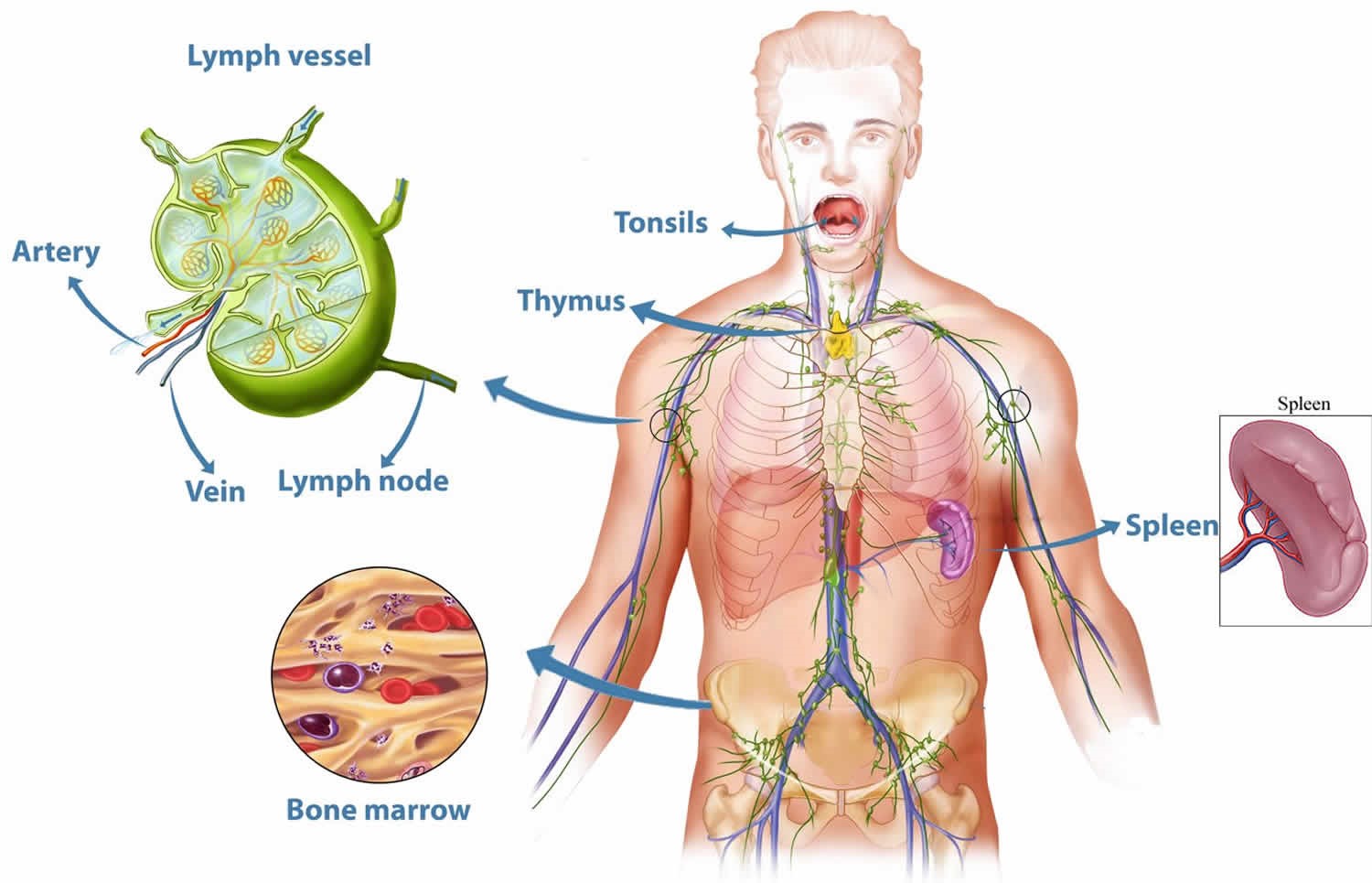
Органы, входящие в иммунную систему: лимфатические узлы, миндалины, вилочковая железа (тимус) костный мозг, селезенка. Ученые установили, что большая часть клеток-защитников располагается в кишечнике – 80%.
Различают врожденный иммунитет и приобретенный (активный, пассивный). Иммунитет начинает формироваться еще до рождения человека – в материнской утробе. Пассивный иммунитет формируется в организме после введения вакцины.
Силы иммунитета на 50% зависят от образа жизни, который ведет человек.
Факторы, негативно воздействующие на иммунитет:
· нерациональное питание (голодание, переедание);
· дефицит витаминов и микроэлементов;
· перенесённые травмы, ожоги, операции;
· загрязнение окружающей среды;
бесконтрольное употребление лекарств.Частые простудные заболевания, герпес на губах, продолжительное повышение температуры, синдром хронической усталости, сонливость или бессонница, болевые ощущения в суставах и мышцах, нарушения сна, частые головные боли, появление высыпаний на коже – всё это признаки снижения иммунной активности.
Что необходимо человеку для поддержания иммунитета?
1. Полноценное здоровое питание.
2. Отказ от курения и употребления алкоголя.
3. Бережное отношение к своей психике.
4. Здоровый сон (не менее 8 часов в сутки в хорошо проветренном помещении).
5. Закаливание (обливания и контрастный душ, посещение бани и сауны). Рекомендовано чередование высоких и низких температур.
6. Регулярные занятия спортом, подвижный образ жизни. Доказано, что чрезмерные нагрузки могут негативно влиять на иммунитет.
По данным ВОЗ — всего 10% людей обладают иммунитетом, который защищает их практически от всех заболеваний. Еще 10% имеют врожденный иммунодефицит: они болеют очень часто. У оставшихся 80% сила иммунной системы зависит от условий и образа жизни.
Всемирный день иммунитета – это ещё одна возможность подчеркнуть важность и значимость здорового образа жизни. Своевременно корректируя нарушения иммунитета, можно предотвратить возникновение заболеваний многих органов и систем. Для хорошего самочувствия и правильной работы внутренних органов необходимо укреплять естественный иммунитет и проводить своевременную вакцинацию.
Источник
Что такое иммунитет?
Слово «иммунитет» происходит от латинского слова immunitas — освобождение от чего-либо.
Иммунитет – это защита организма от генетически чужеродных веществ. Благодаря наличию иммунитета нашему организму удается сохранять постоянство своего внутреннего состояния и преодолевать агрессивные факторы внешней среды, например — атаку различных микроорганизмов (бактерий, вирусов и др.), которые могут вызывать инфекционно-воспалительные заболевания человека – в совокупности их называют патогенами.
Чаще всего патогены проникают в человеческий организм воздушно-капельным путем. Поэтому иммунная система слизистых оболочек дыхательных путей имеет специальные механизмы защиты, которые включают:
- Поддержку нормальной микрофлоры слизистой
- Выработку специальных веществ, препятствующих закреплению микробов на слизистой и их проникновению внутрь (интерферона, ингибиторов микробной адгезии, секреторных антител), разрушающих клеточные стенки микробов – лизоцима, лактоферрина
- Хорошую работу мукоцилиарного транспорта
- Комплекс механизмов, отвечающих за борьбу с возбудителями, проникшими в клетки 2
Однако существуют ситуации, когда даже такую многоуровневую систему защиты патогены преодолевают. Каковы же причины преодоления иммунного ответа патогенами?
- Постоянная адаптация патогенов к действию защитных систем человека
- Комбинированная атака слизистой оболочки разными патогенами
- Незрелый или «скомпрометированный» иммунный ответ, возникающий вследствие: очагов хронической инфекции в дыхательных путях, сопутствующих заболеваний других органов, различных стрессовых факторов
- лизоцим в слезах, носовых выделениях и слюне,
- кислота в желудочном соке,
- продукты расщепления жирных кислот в тонкой кишке,
- спермин и цинк в сперме,
- лактопероксидаза в молоке.
- повреждение и распознавание возбудителей;
- сосудистая реакция – нарушение микроциркуляции крови;
- клеточная реакция – миграция клеток иммунной системы в очаг воспаления.
- Внеклеточное разрушение возбудителя гуморальными факторами защиты (активными белками сыворотки крови).
- Внутриклеточная нейтрализация (фагоцитоз) (поглощение инфицированных клеток нейтрофилами и макрофагами с дальнейшим ферментативным разрушением структуры).
- Система белков комплемента является важнейшим фактором защиты среди циркулирующих белков крови. Этот комплекс в процессе ряда каскадных реакций приобретает способность «продырявливать» клеточную мембрану бактерий и тем самым убивать чужеродные клетки.
- Другие белки сыворотки крови – лизины, убивающие в основном гаммаположительные бактерии, также относятся к гуморальным факторам защиты. Однако активны лизины только в присутствии достаточного количества ионов кальция.
- Естественные антитела всегда имеются в сыворотке крови независимо от проникновения в организм чужеродных микробов. Эти антитела, реагируя с различными микроорганизмами, вызывают нейтрализацию их токсинов.
- Интерфероны производятся лейкоцитами и макрофагами в ответ на воздействие вирусов (а также некоторых простейших, бактерий и риккетсий). Интерфероны – антивирусные агенты широкого спектра действия. Синтезируемый интерферон выделяется в межклеточное пространство, где связывается с рецепторами соседних клеток. Это стимулирует синтез белков, которые блокируют размножение вирусов.
- Внеклеточное разрушение возбудителя может происходить под действием более 60 активных белков, входящих в гранулы лейкоцитов. Активные белки в процессе дегрануляции высвобождаются во внешние ткани из гранул лейкоцитов. Эффект дегрануляции наиболее интенсивно развивается при реакции на крупные чужеродные объекты (гельминты, простейшие), когда фагоцит не способен поглотить этот объект.
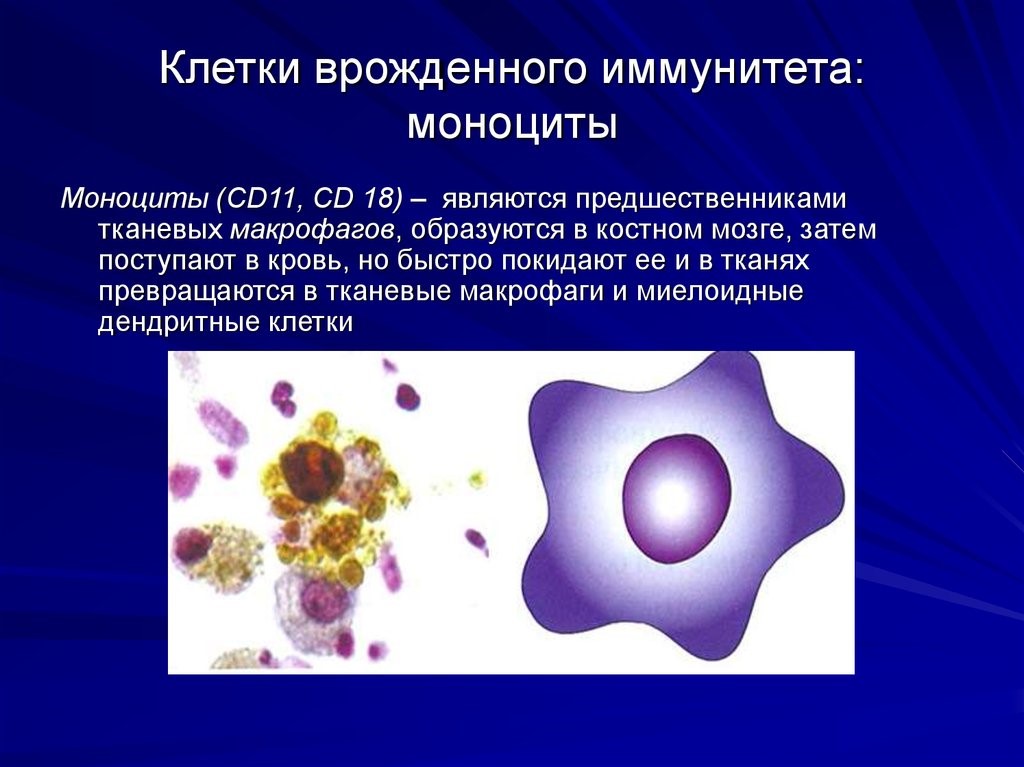
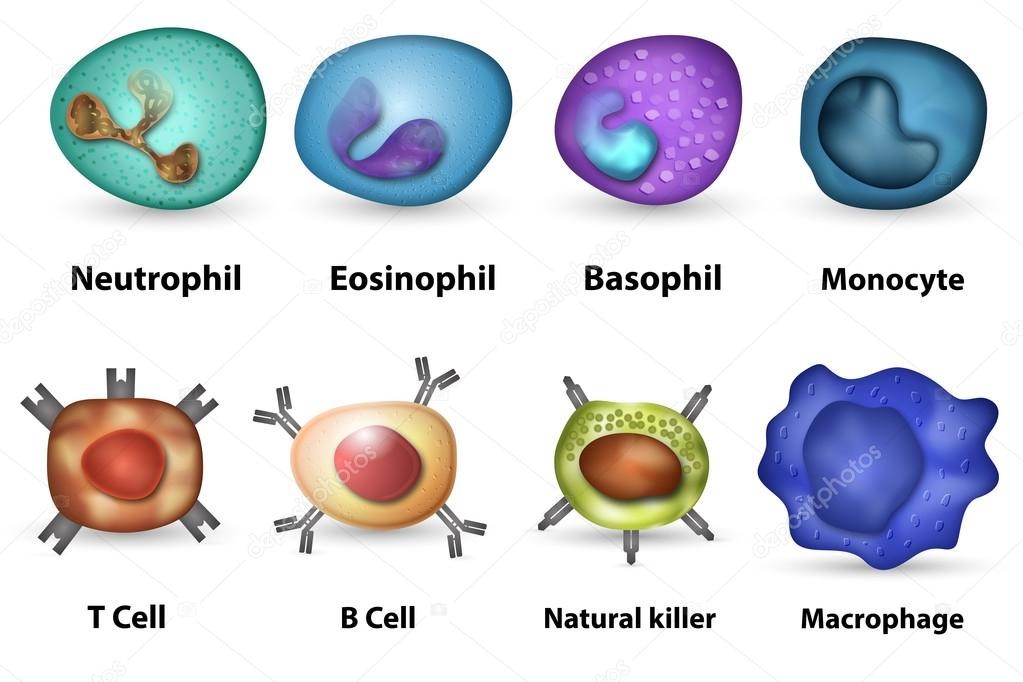
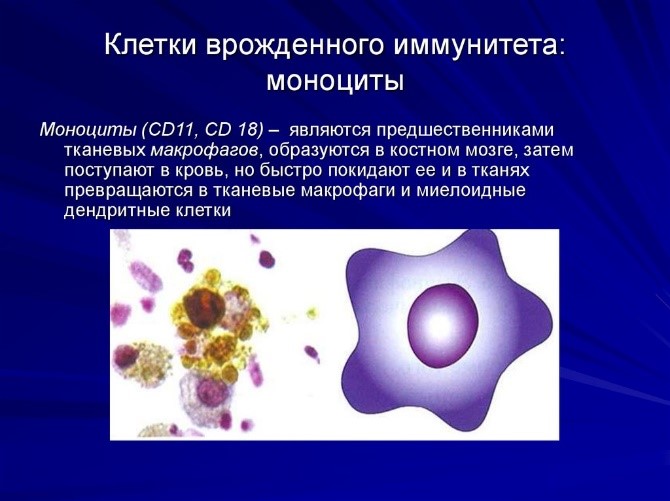
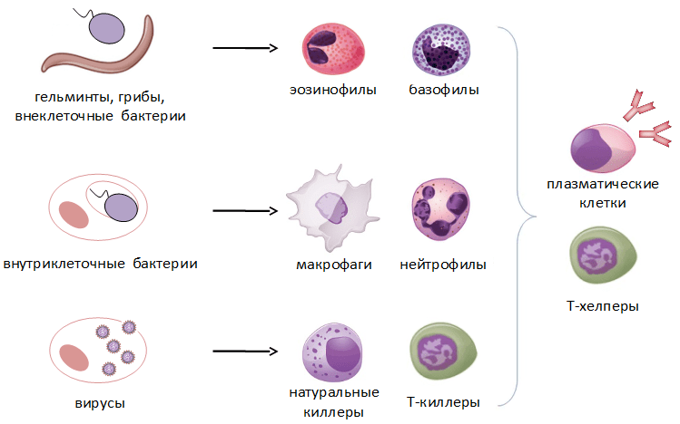
- моноциты – предшественники макрофагов (клетки, пожирающие чужеродные частицы). Образуются в костном мозге, затем поступают в кровь, но быстро ее покидают, превращаясь в тканевые макрофаги и дендритные клетки (рис. 7);
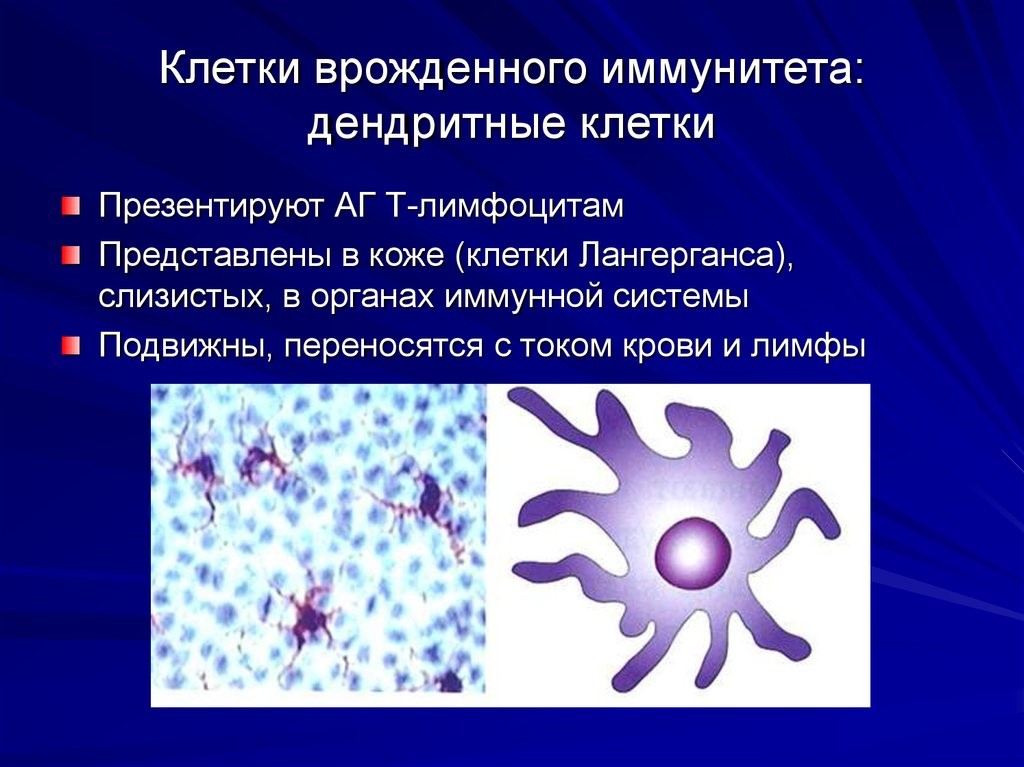
- макрофаги и дендритные клетки расположены в коже, слизистых. Обладают подвижностью, переносятся с током крови и лимфы. Они поглощают (фагоцитируют) патоген, и уже внутри себя при помощи содержимого вакуолей растворяют его. Дендритные клетки ветвятся подобно дереву. Благодаря ветвям-антеннам они работают связистами между врожденным и приобретенным видами иммунитета(рис.8);
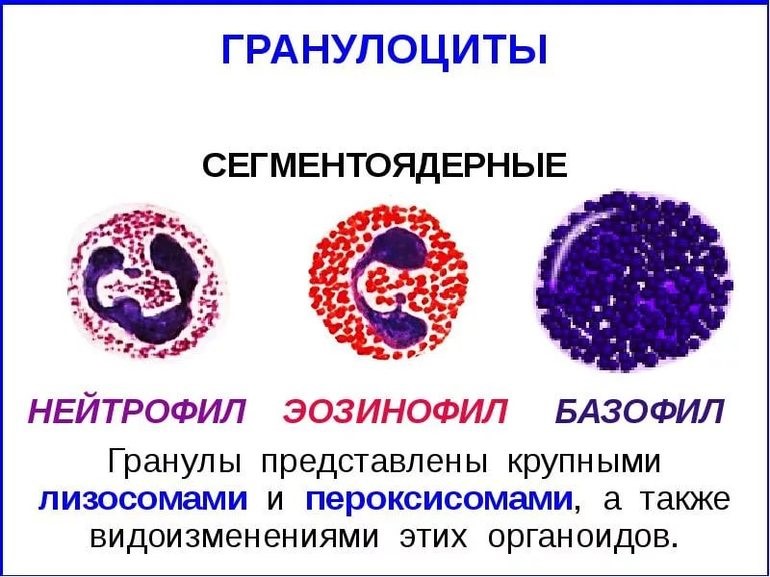
- клетки крови, содержащие в цитоплазме гранулы (гранулоциты): нейтрофилы, эозинофилы и базофилы (рис.9);
- натуральные (естественные) киллеры или NK-клетки (англ. Natural killer cells, NK cells) – тип цитотоксическихлимфоцитов, участвующий в функционировании врождённого иммунитета. Они на высокой скорости уничтожают клетки, инфицированные бактериями и вирусами, а также опухолевые клетки.
- белки, связывающие ионы металлов (железа, цинка), необходимых для жизнедеятельности и размножения патогенов – лактоферрин, кальпротектин, мембранный белок и другие;
- ферменты, генерирующие окислители – кислород и оксид азота:
- ферменты, способные расщеплять клеточную мембрану патогенов – лизоцим, хитиназа, фосфолипаза А2;
- белки и пептиды, нарушающие целостность клеточной оболочки микроорганизма – комплемент, эозинофильный протеин, дефензины и другие.
- распознавание антигенов (как правило чужеродных для организма) с помощью рецепторов;
- удаление (элиминация) распознанных чужеродных агентов (рис. 17);
- формирование иммунологической памяти о контакте с антигеном, позволяющей быстрее и эффективнее удалять этот антиген при повторном его распознавании.
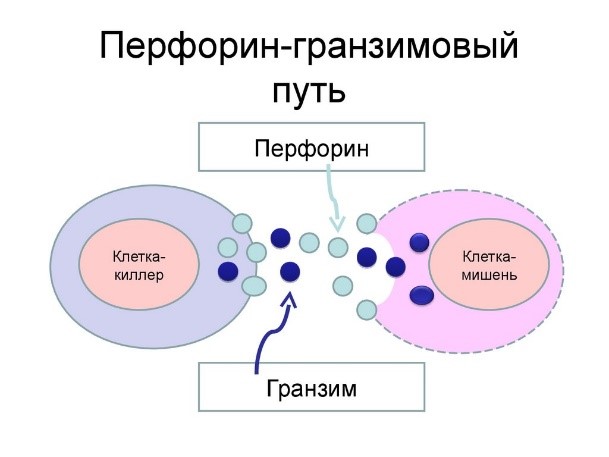
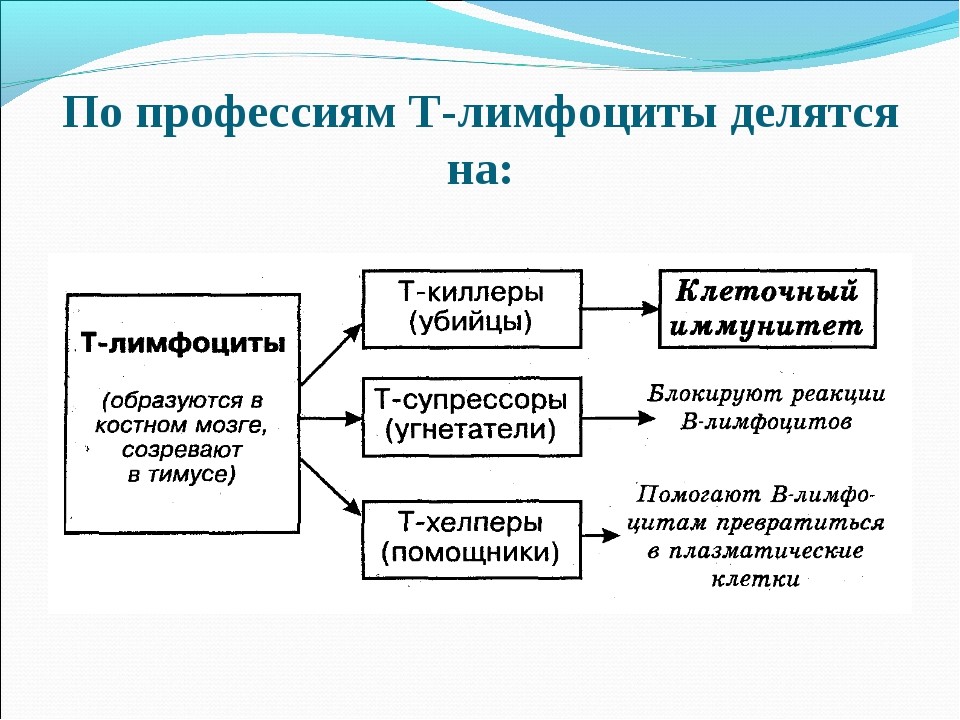
- Т-киллеры (их еще называют CD8+ Т-лимфоциты), которые подобно NK-клетке (натуральному киллеру), выделяет белки перфорин и гранзим, что приводит к лизису клетки-мишени;
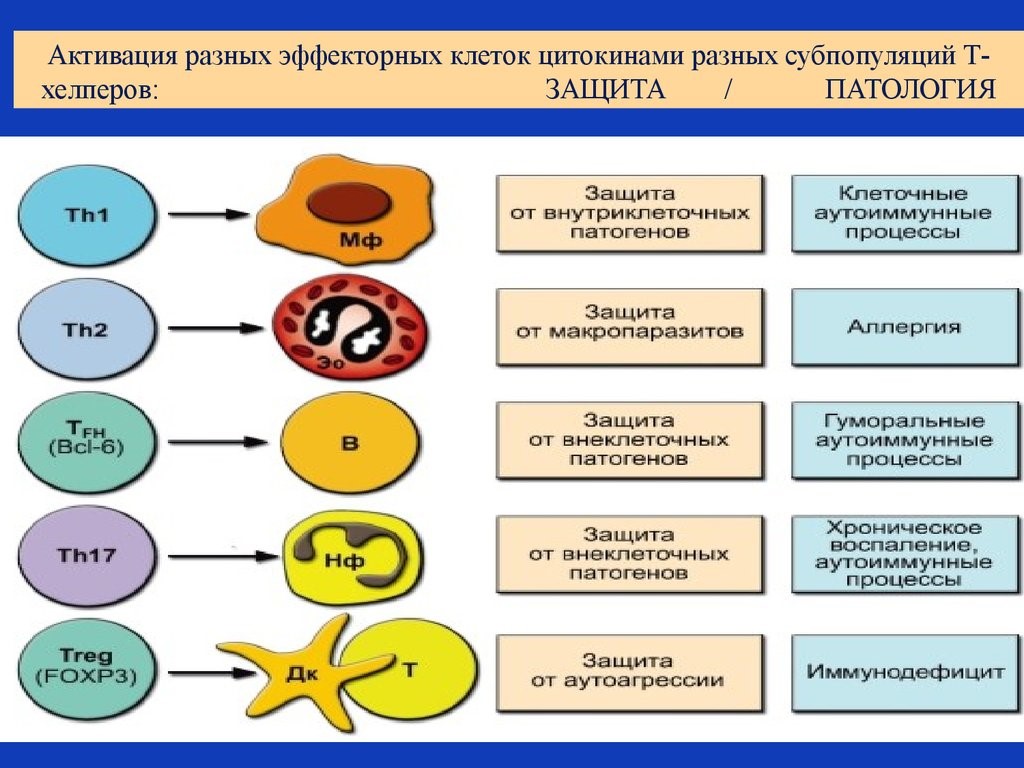
- Т-хелперы (от английского helper – помощник). Они еще обозначаются как Th-клетки, CD4+ T-лимфоциты. Активированные Т-хелперы продуцируют хемокины и цитокины, участвующие в иммунном процессе (рис.19);
- Т-супрессоры (Ts) подавляют (супрессируют) реакции В-лимфоцитов и блокируют Т-хелперы. Притом эти клетки вовсе не устраивают саботаж иммунным процессам и не вредят здоровью. Они просто регулируют силу иммунного ответа, что позволяет иммунной системе сдержанно и с умеренной силой отвечать на раздражители (тушить пожар, а не костер);
- Т-регуляторные клетки (Tr1) влияют на образование зернистых лейкоцитов (гранулоцитов), которых мы уже представляли в качестве макрофагов.
- симптомов, которые могут быть признаками первичных иммунодефицитов:
- 4 и более случаев отита в течение года;
- 2 и более синусита в течение года;
- низкая эффективность антибиотиков в течение двух и более месяцев приема;
- 2 и более случаев пневмонии в течение года;
- невозможность ребенка набирать вес и нормально расти;
- частые и глубокие абсцессы кожи и внутренних органов
- постоянный кандидоз полости рта и кожи;
- необходимость внутривенного введения антибиотиков для разрешения инфекции;
- две и более системных инфекции, включая сепсис;
- наследственная предрасположенность.
- 1-я группа – преимущественно гуморальные, или В-клеточные ПИД;
- 2-я группа – комбинированные ПИД (при всех Т-клеточных иммунодефицитах есть нарушение функции В-клеток);
- 3-я группа – ПИД, обусловленные дефектами фагоцитоза;
- 4-я группа – ПИД, обусловленные дефектами в системе комплемента.
- аутоантитела могут вызывать гибель клеток, активируя на их поверхности систему комплемента или же привлекая макрофаги;
- мишенями для антител могут стать рецепторы на поверхности клетки.
- аутоантитела вместе с растворимыми антигенами могут образовывать иммунные комплексы, которые оседают в различных органах и тканях (например, в почечных клубочках, суставах, на эндотелии сосудов), нарушая их работу и вызывая воспалительные процессы.
- гиперчувствительность I типа включает немедленные анафилактические реакции, часто связанные с аллергией. Реакции этого типа могут как вызывать небольшой дискомфорт, так и приводить к смерти. Основу гиперчувствительности I типа составляют иммуноглобулины E (IgE), которые вызывают дегрануляцию базофилов и тучных клеток;
- гиперчувствительность II типа характеризуется присутствием антител, распознающих его собственные белки и помечающие экспрессирующие их клетки к разрушению. Гиперчувствительность II типа также называют зависимой от антител или цитотоксической гиперчувствительностью, её основу составляют иммуноглобулины G (IgG) и M (IgM);
- гиперчувствительность III типа обусловлена иммунными комплексами, состоящими из антигенов, белков комплемента, IgG и IgM;
- гиперчувствительность IV типа, также известная как отложенная гиперчувствительность, развивается в течение 2-3 дней. Реакции гиперчувствительности IV типа наблюдаются при многих аутоиммунных и инфекционных заболеваниях, а их основу составляют T-клетки, моноциты и макрофаги.
- регулярная вакцинация по скорости и качеству реакции превышает естественный процесс формирования иммунитета на конкретную инфекцию;
- сбалансированное питание, обеспечивающее поддержание нормального обмена веществ;
- регулярные физические нагрузки, обеспечивающие физиологическое функционирование всех систем организма, поддержание оптимальных показателей массы тела;
- отказ от вредных привычек, приводящих к зависимостям (алкогольной, никотиновой, наркотической, токсической, компьютерной);
- режим дня, особенно влияние циркадных ритмов (смена дня и ночи): во время бодрствования пика достигает численность T-киллеров и NK-клеток, а также концентрация противовоспалительных веществ, таких как кортизол и катехоламины; во время сна достигает своего пика формирование Т-клеток памяти.
- прием иммуностимуляторов клинически не оправдан. Если постоянно стимулировать выработку лейкоцитов лекарственными средствами, иммунная система начнет утрачивать свои непосредственные функции. Вот тогда и наступает момент начала серьезных проблем с иммунитетом. Совершенно не влияют на иммунную систему природные адаптогены: лимонник китайский, женьшень, элеутерококк, радиола розовая. Они воздействуют, как усилители синтеза РНК и белков (основу человеческих клеток), активизируют ферменты обмена и работу эндокринной и вегетативной систем;
- прием витаминов явно переоценен. Положительное влияние на иммунную систему оказывает витамин D, который стимулирует образование Т-киллеров. Все остальные группы витаминов прямого участия в функционировании иммунной системы не принимают;
- банные процедуры и сауна на иммунную систему не влияют;
- народные средства, такие как мед и чеснок обладают легким бактерицидным, но не иммуногенным действием.
В современных условиях жители мегаполисов в большой степени подвержены всем перечисленным факторам, и наша система местного иммунитета слизистых часто нуждается в дополнительной поддержке, особенно в период сезонного подъема заболеваемости и перед наступлением этого периода 3 .
Источник
Способы защиты организма от генетически чужеродных веществ
Местный иммунитет (барьерная защита от инфекций)
Первой линией обороны против инфекционных агентов служат кожа и слизистые оболочки, которые препятствуют проникновению микробов в ткани и выделяют вещества, оказывающие бактерицидное действие.
Важным фактором является механическая защита. Так бактерии, попавшие на кожу, удаляются при слущивании эпидермиса (образование перхоти, шелушение при некоторых инфекционных заболеваниях). Слизь, выделяемая стенками многих внутренних органов, действует как защитный барьер, препятствующий прикреплению бактерий к эпителиальным клеткам. Микробы и чужеродные частицы, захваченные слизью, удаляются механическим путем – за счет движения ресничек эпителия, с кашлем и чиханьем. К другим механическим факторам, защищающим поверхности эпителия, можно отнести вымывающее действие слез, слюны и мочи.
Механическая защита дополняется секреторной (выделительной) деятельностью кожных желез: потовых и сальных. Молочная кислота пота и ненасыщенные жирные кислоты сальных желез обладают противомикробным действием. Во многих жидкостях, производимых организмом (секретах организма), также содержатся бактерицидные компоненты:
Специфическую функцию защиты во внешних секретах организма выполняет секреторный иммуноглобулин А (IgA). Он содержится в секретах и на слизистых оболочках слюнных желез, носа, рта, бронхов, влагалища, кишечника, мочеточников, мочевого пузыря. Секреторный иммуноглобулин А блокирует накопление и размножение на слизистой оболочке бактерий путем блокады поверхностных антигенов бактерий, с помощью которых они прикрепляются к слизистой оболочки органов.
Барьерная защита – это своеобразный «скафандр», к сожалению, проницаемый для многих патогенных агентов.
Неспецифическая иммунная защита (защита на все возбудители)
Любой повреждающий агент-фактор, который по силе и длительности превосходит барьерные возможности ткани, вызывает ответную защитную реакцию организма – воспаление. Воспалительная реакция представлена единством трех явлений:
Основная задача воспалительной реакции – уничтожение возбудителя и/или освобождение от собственных разрушенных клеток.
Можно выделить два типа уничтожения возбудителей:
Внутриклеточное уничтожение микробных клеток происходит в внутри фагоцитов. Процесс поглощения возбудителя с дальнейшим ферментативным разрушением его структуры называют фагоцитозом. Этот процесс осуществляют два вида фагоцитов: нейтрофилы и макрофаги. Фагоцитоз является довольно надежным механизмом защиты организма от инфекционных агентов, но «включение» этой системы возможно только при условии сближения фагоцита и микроорганизма, сцепления микроорганизма с поверхностью фагоцита и активации мембраны фагоцита, которая приводит к поглощению микроорганизма. Микробные клетки обычно погибают в фагоцитах в течение нескольких минут.
Внеклеточные механизмы защиты реализуются несколькими путями:
Клеточные и гуморальные факторы активно дополняют друг друга.
Специфическая иммунная защита (иммунный ответ на конкретный возбудитель)
За реакциями воспаления, если они не смогли нейтрализовать возбудителей, развивается более специализированная линия обороны – иммунный ответ, который последовательно запускает многоуровневую иммунную реакцию на возбудителя. Развитие специфических иммунных реакций требует взаимодействия практически всех видов клеток иммунной системы.
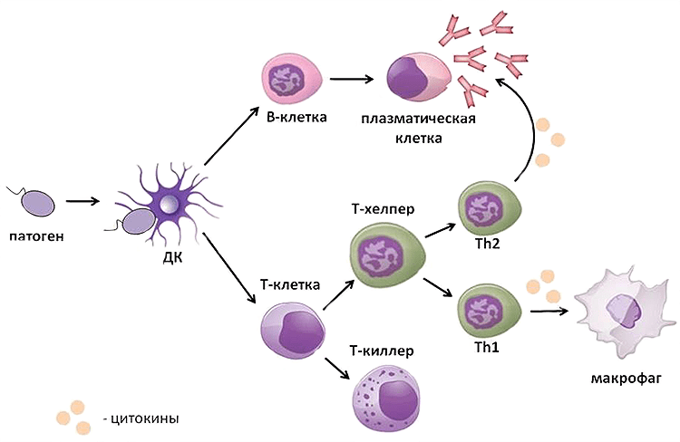
На первом этапе иммунного ответа захваченный в процессе фагоцитоза возбудитель перерабатывается макрофагом и в иммуногенной форме выводится его антиген на поверхность (презентация антигена). Особая роль в дальнейшем принадлежит активации Т-хелперов, которая происходит при распознавании Т-хелпером соответствующего антигенного комплекса на поверхности макрофага (антигенпрезентирующей клетки). В результате данного контакта Т-хелперы начинают делиться и после нескольких делений разделяются на две популяции. Одна активизирует развитие гуморального иммунного ответа (выработку иммуноглобулинов и антител), а другая популяция является необходимым компонентом в активации клеточного иммунитета (цитотоксические Т-лимфоциты).
В дальнейшем цитотоксические Т-лимфоциты постоянно циркулируют по всему организму, чему способствует срок их жизни (месяцы и годы). Благодаря постоянной циркуляции лимфоциты удивительно быстро появляются в «горячих точках», осуществляя разрушение клеток, инфицированных вирусами.
Гуморальный иммунный ответ обеспечивается иммуноглобулинами или антителами, производимыми В-лимфоцитами. Продвигаясь по кровяному или лимфатическому руслу, антитела поражают чужеродные вещества на любой дистанции от лимфоцита. За счет гуморального иммунного ответа происходит уничтожение самих возбудителей и нейтрализация их токсинов, находящихся в межклеточном пространстве и на слизистых. Специфическая нейтрализация осуществляется за счет присоединения антител к антигенам с образованием растворимых и нерастворимых циркулирующих комплексов (ЦИК), которые активируют защитную систему белков комплемента, повышают фагоцитарную активность макрофагов и нейтрофилов, усиливают специфическое цитотоксическое действие Т-лимфоцитов (то есть повышается активность естественных киллеров).
Установлен ряд закономерностей динамики накопления антител после первого и повторного внедрения антигена. Первый пик концентрации антител появляется через несколько дней (скрытый период иммунного ответа) и обусловлен усиленным синтезом главным образом иммуноглобулина М (IgM). После второго внедрения того же антигена амплитуда ответа больше, он продолжается дольше и обусловлен возрастанием преимущественно синтеза иммуноглобулина G (IgG). Формирование стойкого иммунитета к возбудителям связано с образованием антител иммуноглобулина класса G.
Источник
Иммунная система человека
к.м.н. Гольдинберг Б. М., Васюк Я.В.
Городской центр трансфузиологии учреждения здравоохранения «6-я городская клиническая больница», г. Минск,
учреждение здравоохранения «7-я городская детская поликлиника», г. Минск
ИММУНННАЯ СИСТЕМА ЧЕЛОВЕКА
Введение
Группа органов, имеющих общее происхождение, единый план строения и выполняющая общую функцию называется системой органов. Пять из всех десяти систем органов являются регулирующими (управляющими): нервная, кровеносная, эндокринная, лимфатическая и иммунная. Уточним, что лимфатические органы и лимфатических узлы, которых насчитывается около 600, функционально является частью иммунной системы, а к собственно лимфатической системе относится обширная сеть сосудов, которая проходит почти через все наши ткани, обеспечивая движение жидкости, называемой лимфой.
Слово «иммунитет» происходит от латинского «immunis» (на английском – immunity), что означает «чистый от чего-либо», невосприимчивый к чему-либо. Иммунная система появилась вместе с многоклеточными организмами и развивалась, как помощница их выживанию. Она объединяет органы и ткани, которые гарантируют защиту организма от генетически чужеродных клеток и веществ, поступающих из окружающей среды.
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным.
Органы иммунной системы человека
Иммунная система включает центральные и периферические органы.
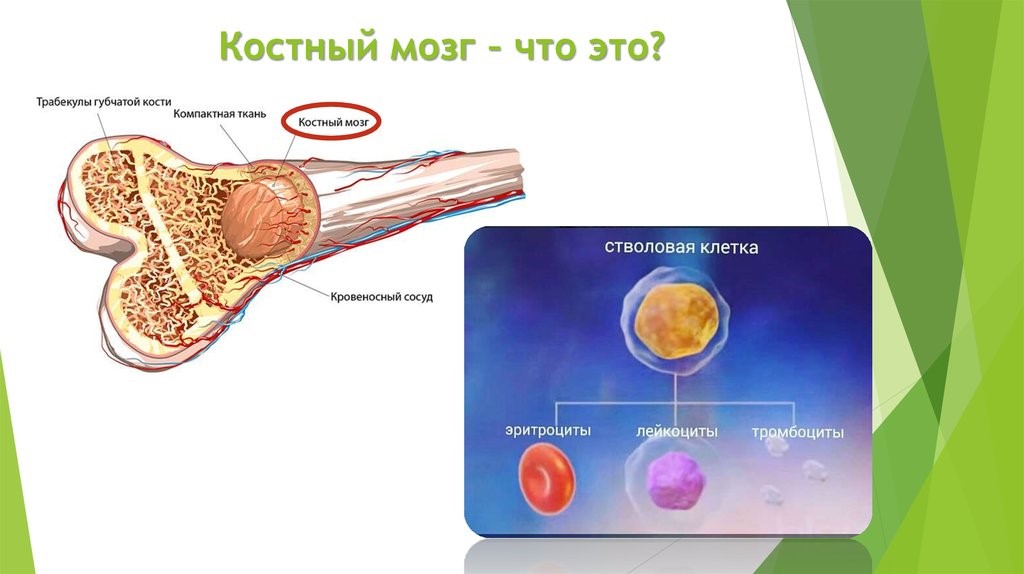
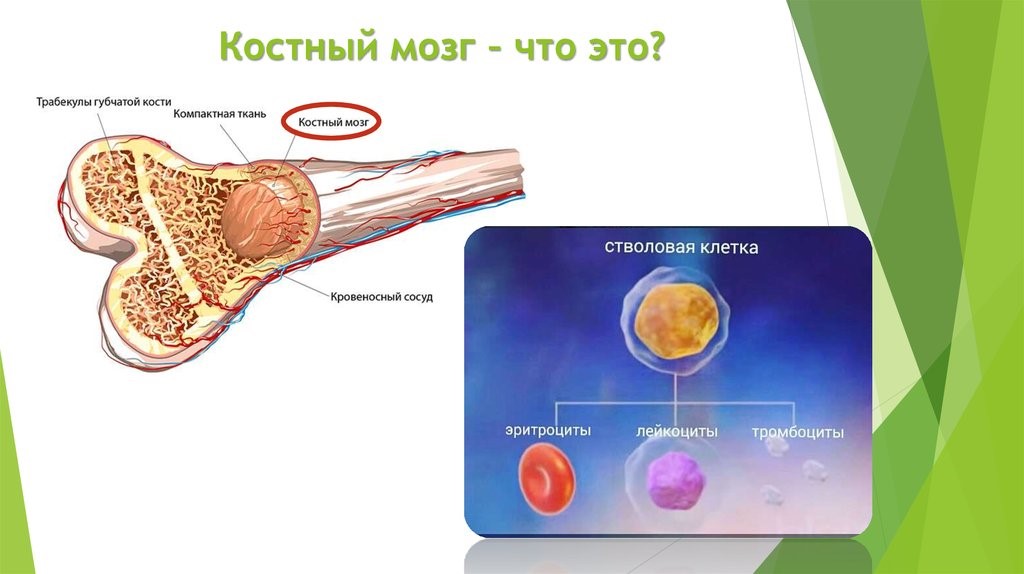
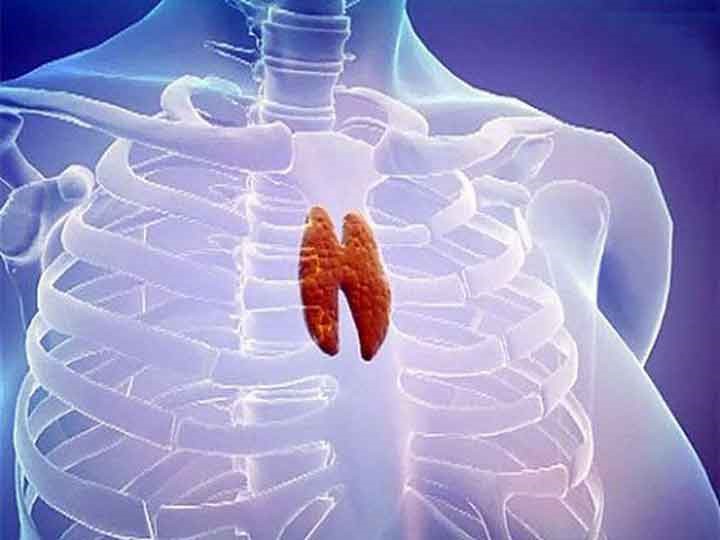
Центральные органы иммунной системы представляют собой красный костный мозг и тимус.
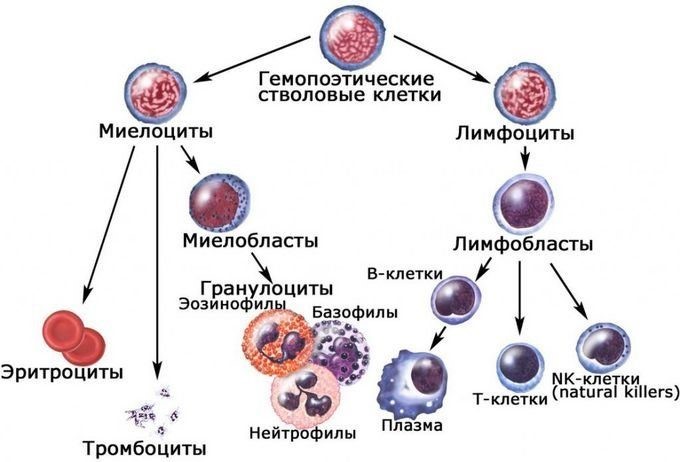
Костный мозг является хранилищем стволовых клеток, из которых образуются клетки крови (рис.1). В зависимости от ситуации, стволовые клетки трансформируются в иммунные В-лимфоциты. При необходимости, определенная часть B-лимфоцитов превращается в плазматические клетки, которые способны вырабатывать антитела.
Рис.1. Костный мозг содержит стволовые клетки
Тимус (или вилочковая железа) – один из главных органов иммунной системы, расположенный у человека за грудиной ниже ключиц, который отвечает за образование Т-клеток иммунной системы в лимфоидных тканях организма (рис.2).
К периферическим органам относятся селезенка, миндалины и лимфоузлы, в которых находятся зоны созревания иммунных клеток.
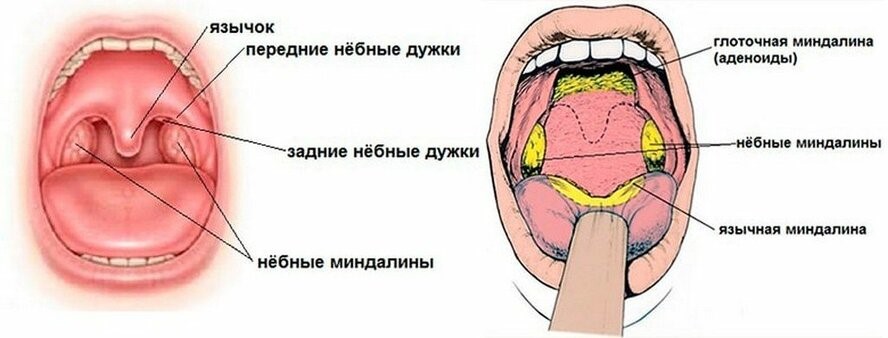
Миндалины, получившие свое название из-за внешней схожести с миндалем, представляют собой скопление лимфоидной ткани в верхней части носоглотки. У человека шесть миндалин: две небные, две грудные и по одной носоглоточной и язычной.
Самыми крупными из них являются небные миндалины, или гланды, которых легко осмотреть самостоятельно в зеркале, если достаточно широко раскрыть рот (рис.3).
Рис. 3. Небные миндалины
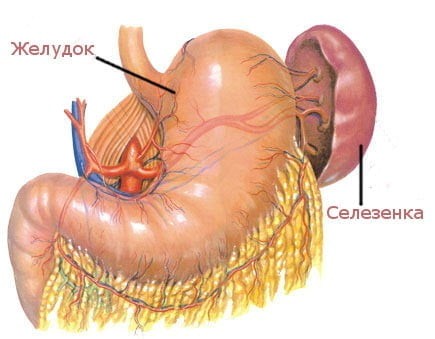
Селезенка является самым крупным лимфоидным органом (рис. 4). Кроме того, она может накапливать некоторое количество крови. В экстренных ситуациях селезенка способна послать свои запасы в общий кровоток. Это позволяет улучшить качество и скорость иммунных реакций организма. Селезенка очищает кровь от бактерий и перерабатывает всевозможные вредные вещества. В ней полностью разрушаются эндотоксины, а также остатки умерших клеток при ожогах, травмах или других повреждениях тканей. У людей, оставшихся по какой-либо причине без селезенки, ухудшается иммунитет.
Рис. 4. Селезенка
Лимфатические узлы представляют собой небольшие образования округлой формы (рис. 5), расположенные в грудной полости (бронхолегочные, бронхотрахеальные) и брюшной полости (пейеровы бляшки, аппендикс и другие), окологрудные на поверхности грудной клетки, на шее и на конечностях. Лимфоузел – это один из барьеров на пути инфекций и раковых клеток, играющий роль своеобразной таможни (рис. 5). В нем образуются лимфоциты – специальные клетки, которые принимают активное участие в уничтожении вредных веществ.
Рис. 5. Лимфоузел
Центральные органы иммунной системы отвечают за образование и созревание клеток, а периферические органы обеспечивают защиту, то есть иммунный ответ. Периферические и центральные органы иммунной системы выполняют свои работу только вместе и если выходит из строя какой-либо один из этих органов, то организм лишится защитного барьера.
Компоненты иммунной системы
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции (сущности).
Врожденный (видовой) иммунитет – наследственно закрепленная система защиты организма человека от патогенных и непатогенных микроорганизмов, а также продуктов тканевого распада. Клетки врожденного иммунитета распознают патоген по специфичным для него молекулярным маркёрам – так называемым «образам патогенности». Эти маркёры не позволяют точно определить принадлежность патогена к тому или иному виду, а лишь сигнализируют о том, что иммунитет столкнулся с возмутителями спокойствия: чужаком или своим, но ставшим для организма предателем (рис.6).
Рис.6. Врожденный иммунитет: главное – спокойствие!
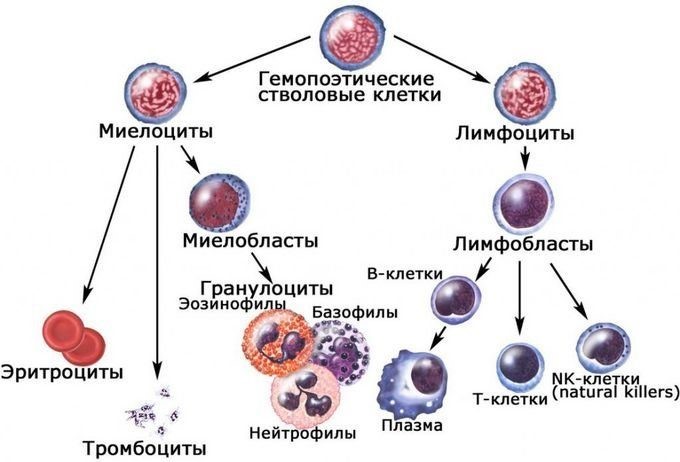
Врожденный иммунитет на клеточном уровне представляют:
Рис.8. Дендритная клетка и
Нейтрофилы – самые многочисленные иммунные клетки в крови человека. Они циркулируют в крови всего 8-10 часов и бόльшую часть своей жизни путешествуют по тканям организма. При встрече с патогеном они его захватывают и переваривают, после чего обычно сами погибают. Из разрушенных нейтрофилов высвобождаются гранулы, содержащие антибиотические вещества.
Гранулы эозинофилов и базофилов осуществляют химическую защиту организма от крупных патогенов, например, паразитических червей, грибов, внеклеточных бактерий. Однако при чрезмерной активности могут участвовать и в развитии аллергической реакции;
Рис.10. Натуральный киллер
Действуют натуральные киллеры с помощью агрессивных веществ перфорина и гранзима, которые наподобие буравчиков «кусают» и разрушают пораженную клетку, ставшую для них мишенью (рис.11)
Рис.11. Проникновение перфорина и гранзима в раковую клетку и ее уничтожение
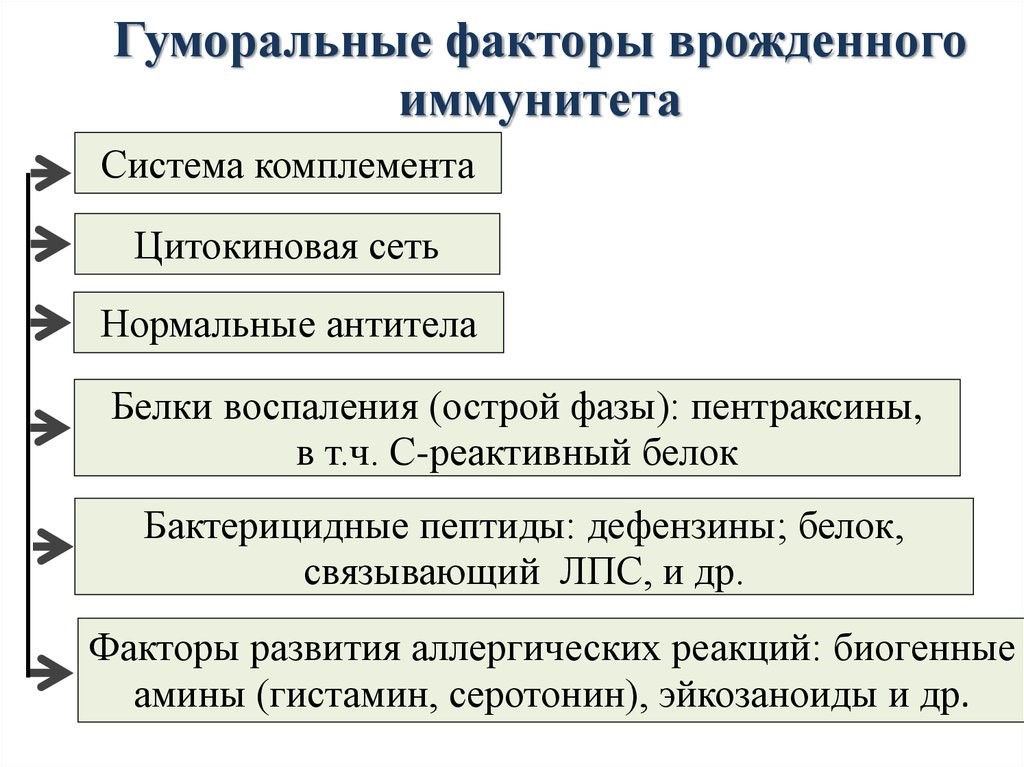
Молекулярными(гуморальные) факторами врожденного иммунитета являются (рис.12):
Рис.12.Гуморальные факторы врожденного иммунитета
Система комплемента – это многокомпонентная самособирающаяся система более 20 сывороточных белков, которые в норме находятся в неактивном состоянии.
После активации проявляются биологические эффекты комплемента: образование мембраноатакающего комплекса для лизиса патогенов, выброса медиаторов воспаления для привлечения фагоцитов и усиления их поглотительной способности.
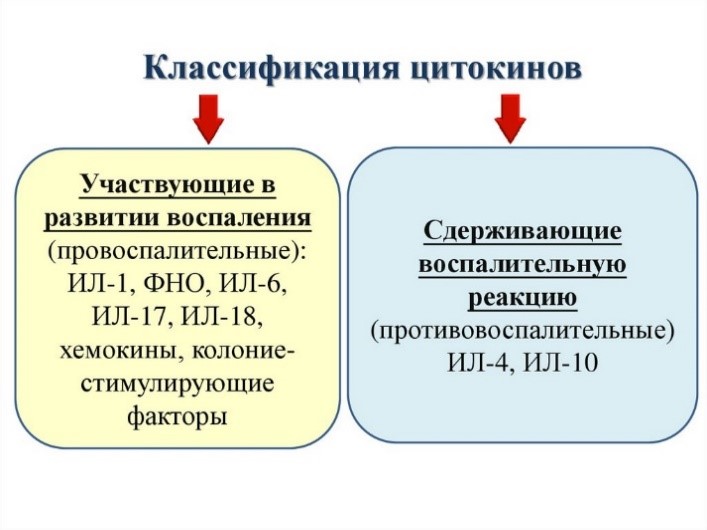
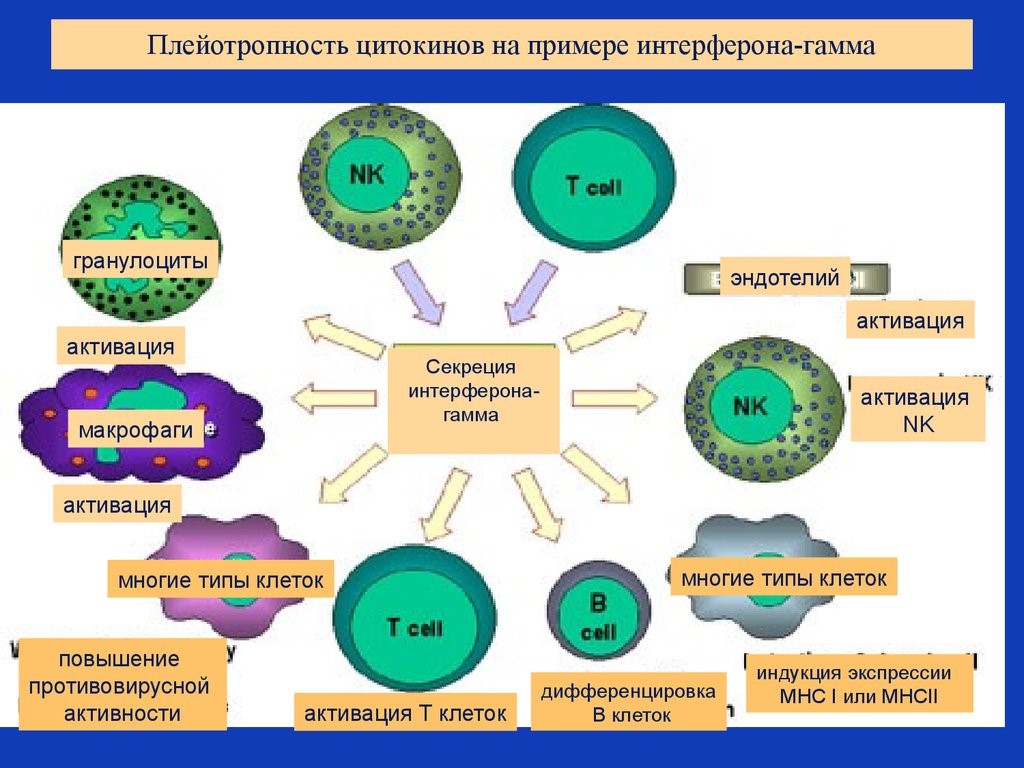
Цитокины – это система низкомолекулярных белков организма, синтезируемых преимущественно активными клетками иммунной и кроветворной систем, регулирующих межклеточные взаимодействия «универсальный» язык для всех клеток), представленные на рис.13 и 14.
Рис. 13. Цитокины: ИЛ – интерлейкины, которых в настоящее время насчитывается 34 разновидности;
Рис. 14. Разнонаправленность действия цитокинов на примере гамма-интерферона
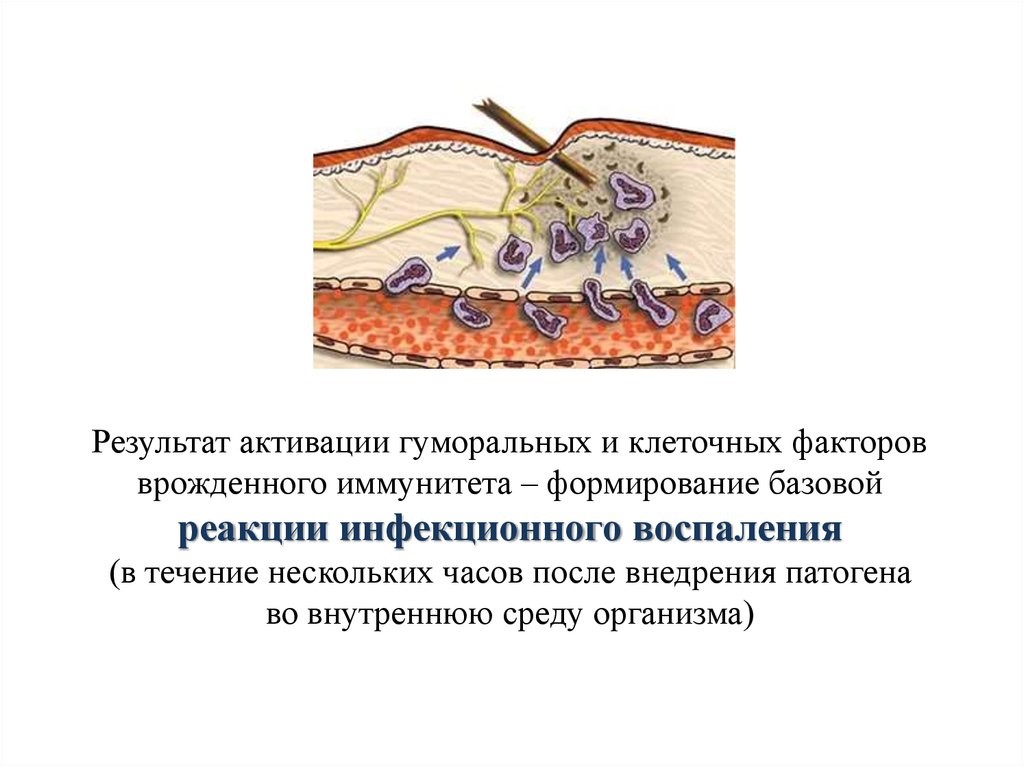
В результате активации гуморальных и клеточных факторов врожденного иммунитета в течение нескольких часов после внедрения патогена во внутреннюю среду организма формируется базовая реакция инфекционного воспаления (рис. 15)
Рис. 15. Инфекционное воспаление ткани на месте внедрения инородного тела с целью его удаления
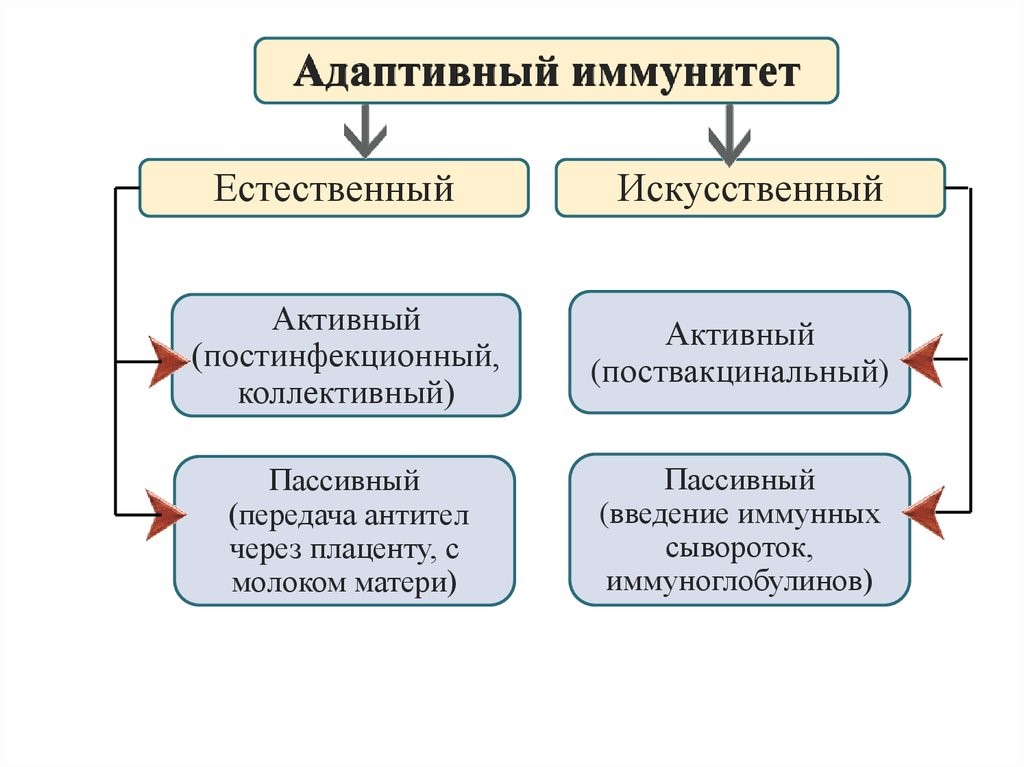
Приобретенный иммунитет (или адаптивный – от франц. adapter «приспосабливать») формируется индивидуально в течение жизни под влиянием антигенной стимуляции и, в свою очередь, подразделяется на естественный и искусственный (рис.16).
Естественный иммунитет формируется при встрече с патогеном, в результате чего в организме вырабатываются защитные иммунные факторы (активный естественный иммунитет), либо они попадают в готовом виде из материнского оргазма в период внутриутробного развития или при грудном вскармливании (пассивный естественный иммунитет).
Искусственный иммунитет создается путем введения вакцин или анатоксинов, которые стимулируют выработку антител против конкретных патогенов или их ядов. При этом с профилактической целью воспроизводится процесс реакции иммунной системы пациента на патоген, но в бессимптомной или легкой клинической форме с сохранением их защитной иммунной силы в течение нескольких месяцев, лет или даже пожизненно (искусственный активный иммунитет). Когда необходимо быстро и на короткое время защитить пациента от реального риска встречи с патогеном во время эпидемии или нейтрализовать уже проникший в его организм патоген применяются иммуноглобулины (антитела) как в очищенном виде, так и в дозированных объемах плазмы или сыворотки, полученных из крови донора (человека или животного). Применение готовых антител формирует пассивный искусственный иммунитет, сохраняющийся 2-3 недели.
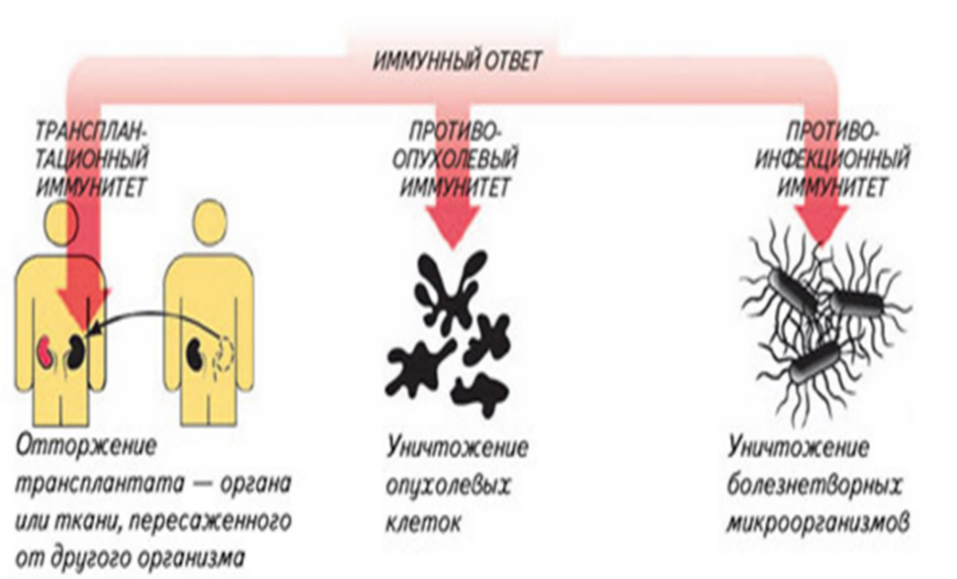
Адаптивный иммунитет основывается на трех главных процессах:
Рис.17.Варианты реагирования иммунной системы на пересадку органов или тканей, возникновение злокачественных новообразований и инфекций
Иммунокомпетентными клетками адаптивного иммунитета являются лимфоциты, которые живут в организме человека от нескольких месяцев до несколько лет. По функциям клетки подразделяются на Т-лимфоциты – 80% и В-лимфоциты – 20%.
То, что Т-лимфоцит распознает только чужеродные антигены, а не молекулы собственного организма, является следствием процесса, называемого селекцией, которая происходит в тимусе, где завершают свое развитие Т-клетки. Суть селекции такова: клетки, окружающие юный, или наивный, лимфоцит, показывают (презентируют) ему пептиды собственных белков. Тот лимфоцит, который слишком хорошо или слишком плохо узнает эти белковые фрагменты, уничтожается. Выжившие же клетки (а это менее 1% всех предшественников Т-лимфоцитов, пришедших в тимус) обладают промежуточным сродством к антигену, следовательно, они, как правило, не считают собственные клетки мишенями для атаки, но имеют возможность среагировать на подходящий чужеродный пептид.
Для активации Т-лимфоцита нужно, чтобы он получил специальные сигналы от рецепторов лейкоцитарной антигенной системы и коктейля из множества провоспалительных цитокинов.
С помощью специальных реагентов определяются маркеры поверхностных белков лейкоцитов определенного типа, которые называются кластерами дифференциации (Сluster of differentiation) – CD. В настоящее время известно 350 CD-антигенов и их подтипов (табл. 1).
Таблица 1. Главные идентификациионные СD-маркёры клеток
Лимфоидная стволовая клетка
CD19, CD72, CD79 и др.
Т-лимфоциты распознают клетки, несущие чужеродные антигены, и уничтожают их после непосредственного контакта (атаки), а также выполняют функцию регуляции иммунного ответа.
Т-лимфоциты имеют подтипы (рис. 18):
Рис. 18. Подтипы Т-лимфоцитов и их функции
Рис. 19. Активация цитокинами разных субпопуляций Т-хелперов
Соотношение количества клеток CD4/CD8 называют иммунорегуляторным индексом (ИРИ). Если у пациента ИРИ повышен (более 2,2), то это говорит о чрезмерной активности T-хелперов и ослаблении регулирующей функции T-киллеров. При таком показателе иммунные клетки могут разрушать собственные ткани организма. Повышенный ИРИ чаще всего отмечается у пациентов с аутоиммунными болезнями (системной красной волчанкой, склеродермией, ревматоидным артритом и др.). Причиной чрезмерной активности T-хелперов может также стать опухоль вилочковой железы. При этой патологии продуцируется избыточное количество лимфоцитов. Высокие показатели ИРИ отмечаются при остром лимфобластном лейкозе. Это тяжелое онкологическое заболевание сопровождается неконтролируемым увеличением количества незрелых лимфоцитов.
Если иммунорегуляторный индекс понижен (менее1,6), то это говорит о серьезном ухудшении работы иммунитета. Низкие показатели ИРИ свидетельствуют о том, что в организме ослаблена функция защитных клеток, а регуляция со стороны T-киллеров чрезмерна. Обычно это отмечается при следующих патологиях, сопровождающихся иммунодефицитом: инфекционных болезнях (в том числе ВИЧ-инфекции); врожденном иммунодефиците; любых затяжных и хронических болезнях; опухолях костного мозга.
В-лимфоциты ответственны за гуморальное звено иммунитета – продукцию антител. После антигенного стимула В-лимфоцит превращается в лимфобласт – клетку, способную к делению. Часть лимфобластов дифференцируется в В-лимфоциты памяти, другая часть превращается в плазматические клетки, которые осуществляют продукцию антител.
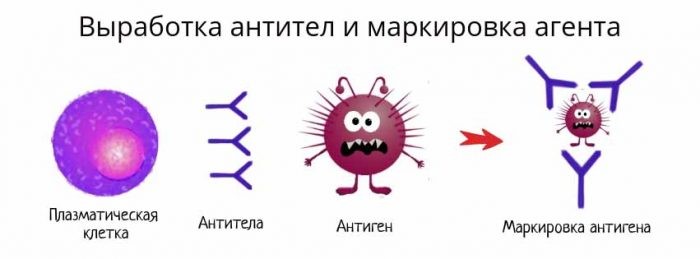
В-лимфоциты несут на своей поверхности В-клеточный рецептор. При контакте с антигеном эти клетки активируются и превращаются в особый клеточный подтип – плазматические клетки, живущие до трех недель и обладающие уникальной способностью секретировать в этот срок тысячи антител.
Антитело имеет сродство к распознаваемому им антигену, как бы «прилипает» к нему. Это дает возможность антителам обволакивать (опсонизировать) клетки и вирусные частицы, покрытые молекулами антигена, привлекая макрофаги и другие иммунные клетки для уничтожения патогена. Антитела также умеют активировать специальный каскад иммунологических реакций, называемый системой комплемента, который приводит к перфорации клеточной мембраны патогена и его гибели.
Рис. 20. Выработка антител и маркировка патогена
Различают несколько классов антител (иммуноглобулинов). Первыми после антигенного раздражения, вызывающих агглютинацию бактерий и нейтрализацию вирусов, появляются иммуноглобулины М (IgM). В длительном иммунитете участвуют иммуноглобулины G(IgG).
В табл.2 представлена интерпретация лабораторных исследований на наличие патогена на молекулярном уровне и с помощью тестов на иммуноглобулины М и G.
Таблица 2. Интерпретация лабораторных исследований на наличие патогена на молекулярном уровне
Результат молекулярного исследования
Тест на антитела
Инфицированный или повторно инфицированный пациент
Ранние стадии инфекции. Требуется дополнительное исследование
Инфекция. Требуется дополнительное исследование
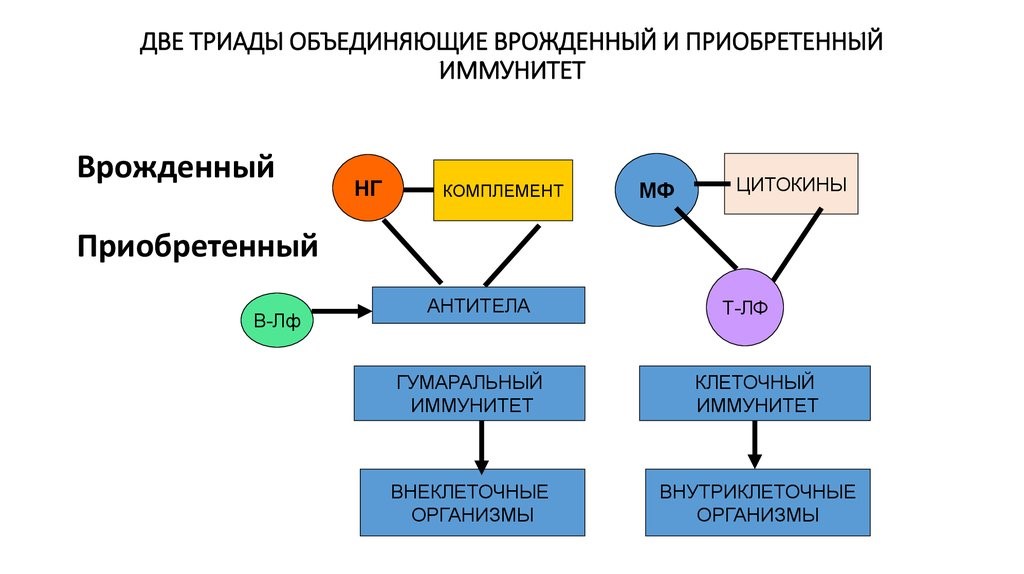
Врожденный и приобретенный виды иммунитета имеют точки соприкосновения, которые представляют две триады (рис.21)
Рис. 21. Две триады, объединяющие врожденный и приобретенный виды иммунитета
Развитие адаптивного иммунного ответа требует достаточно много времени (от нескольких дней до двух недель), и для того чтобы организм мог защищаться от уже знакомой инфекции быстрее, из Т- и В-клеток, участвовавших в прошлых битвах, формируются так называемые клетки памяти. Они, подобно ветеранам, в небольшом количестве присутствуют в организме, и, если появляется знакомый им патоген, вновь активируются, быстро делятся и целой армией выходят на защиту границ (рис.22).
Рис.22. Т-клетки памяти быстро формирует вторичный иммунный ответ
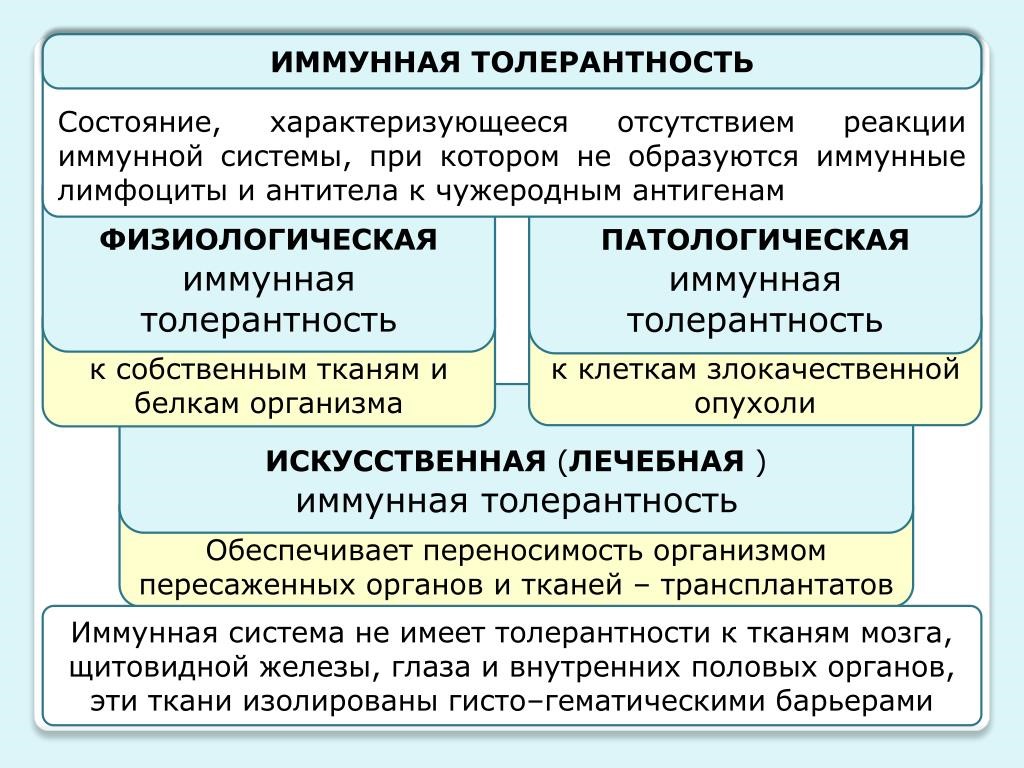
Иммунологическая толерантность
Под иммунологической толерантностью (терпимостью, ареактивностью) понимают отсутствие иммунного ответа на специфический антиген. Перечень антигенов, к которым может развиваться толерантность, практически неотличим от набора антигенов, против которых развивается специфический иммунный ответ (рис.23).
Рис. 23. Иммунная толерантность
Механизмы толерантности необходимы, поскольку иммунная система продуцирует огромное число разнообразных антиген специфичных рецепторов, и некоторые из них оказываются специфичными к собственным антигенам организма; толерантность предотвращает нежелательные реакции против собственных органов и тканей, также для нормального протекания беременности.
Нарушения иммунной системы у человека
Нарушения в работе иммунной системы можно подразделить на три категории: иммунодефициты, аутоиммунные заболевания и реакции гиперчувствительности.
Иммунодефициты
Иммунодефицит – снижение количественных показателей и/или функциональной активности основных компонентов иммунной системы, приводящее к нарушению защиты организма от патогенных микроорганизмов и проявляющееся повышенной инфекционной заболеваемостью.
Первичные иммунодефициты (ПИД) – наследственные заболевания, обусловленные дефектами генов, контролирующих иммунный ответ. В основном ПИД заявляют о себе уже в раннем детском возрасте, но иногда лишь к 30-40 годам жизни.
По механизмам развития выделяют 4 основные группы ПИД (табл.3):
Таблица 3. Некоторые первичные иммунодефициты
Частые бактериальные инфекции
Дефицит или полное отсутствие В-лимфоцитов
Антибиотики, пожизненное введение IgG
Частые респираторные инфекции, отиты
Дефекты Т- и В- лимфоцитов
Антибиотики, пожизненное введение IgG
Атаксия-телеангиоэкстазия (синдром Луи-Бар)
Аномалия двигательной функции, слабость мышц, нарушение речи
Дефицит Т- и В- лимфоцитов
ПИД, обусловленные дефектами фагоцитоза
Хроническая гранулёматозная болезнь
Частые пневмонии, гнойные инфекции
Пожизненная антибактериальная и противогрибковая терапия, интерферон гамма
ПИД, обусловленные дефектами в системе комплемента
Наследственный ангионевротический отек
Отеки губ и век при отсутствии зуда. Отеки гортани, носа, языка опасны для жизни
Низкая концентрация ингибитора эстеразы С1
Введение концентрата ингибитора эстеразы С1
Как следует из табл.3, основным и часто единственным методом лечения большинства пациентов с первичными В-клеточными иммунодефицитами являются иммуноглобулины. Это лекарственные средства, получаемые из плазмы крови человека. Они призваны заменить защитные антитела, отсутствующие в иммунной системе, с целью предотвращения или остановки развития тяжелых инфекционных заболеваний. Сегодня в арсенале врача имеются иммуноглобулины, различающиеся по концентрации активного вещества (5 и 10%), а также по способу введения (внутривенный и подкожный).
ПИД может проявиться в любом возрасте. В зависимости от этого у пациента возникают своеобразные проблемы, требующие определенных видов поддержки на протяжении всей жизни (табл. 4).
Таблица 4. Необходимость в видах поддержки пациента с ПИД в различных возрастных группах
В возрасте от 0 до 14 лет требуется уход со стороны родителей, направленный на профилактику инфекций и на период лечения. Могут потребоваться: обучение на дому; оказание психологической помощи; социальная поддержка в приобретении лекарственных средств.
В подростковом возрасте (14-18 лет) дополнительно могут возникнуть потребности в продолжении непрерывного обучения, профессиональной ориентации, налаживании взаимоотношений со сверстниками, организации досуга.
В возрасте от 18 до 65 лет у пациентов чаще возникают инфекционные осложнения, а с ними и расходы на приобретение лекарственных средств, не подлежащих восполнению, а также проблемы с трудоустройством.
В пожилом возрасте (старше 65 лет) возникают потребности в материальной, социальной и психологической поддержке пациента с ПИД.
Аутоиммунная патология
Повреждение собственных органов и тканей организма иммунной системой называется аутоиммунным процессом. Заболеваниями такого типа страдает около 5% человечества. В организме пациента развиваются боевые действия, напоминающие гражданскую войну: в атаку идут «свои против своих». В этой борьбе победителей нет – одни страдания.
Селекция Т-лимфоцитов в тимусе, а также удаление аутореактивных клеток на периферии (центральная и периферическая иммунологическая толерантность), о которых мы говорили ранее, не могут полностью избавить организм от аутореактивных Т-лимфоцитов. Что же касается В-лимфоцитов, вопрос о том, насколько строго осуществляется их селекция, до сих пор остается открытым. Поэтому в организме каждого человека обязательно присутствует множество аутореактивных лимфоцитов, которые в случае развития аутоиммунной реакции могут повреждать собственные органы и ткани.
В качестве аналога можно привести созданную турками в ХIV веке янычарскую пехоту, в которую набирали юношей-христиан 8-16 лет, воевших против своих сородичей.
Т-клеточная аутоиммуннная агрессия хорошо изучена при ревматоидном артрите, сахарном диабете первого типа, рассеянном склерозе и многих других болезнях.
Такие же клетки-янычары, не помнящие своего родства, прослеживаются среди В-лимфоцитов:
Например, вследствие срыва иммунологической толерантности происходит активация В-лимфоцитов, продуцирующих антитела. Это приводит к выраженному повышению выработки тиреоидных гормонов (Т4 и Т3), а также к увеличению щитовидной железы в размерах (гипертрофии). Патология носит название болезнь Грейвса.
Еще одним примером может быть миастения гравис, которая характеризуется слабостью скелетной мускулатуры вследствие образования аутоантител против структур, отвечающих за холинергическую передачу и сокращение мышечного волокна;
Как правило, аутоиммунное заболевание возникает внезапно, и невозможно точно определить, что стало его причиной. Считается, что триггером для запуска может послужить практически любая стрессовая ситуация, будь то перенесенная инфекция, травма или переохлаждение. Значительный вклад в вероятность возникновения аутоиммунного заболевания вносит как образ жизни человека, так и генетическая предрасположенность – наличие определенного варианта какого-либо гена.
Гиперчувствительность
Под гиперчувствительностью понимают чрезмерный иммунный ответ на какой-либо антиген. Реакции гиперчувствительности подразделяют на несколько типов в зависимости от их длительности и механизмов, лежащих в их основе:
Эффективные методы воздействия на иммунитет:
Спекулятивные методы вокруг иммунитета:
Заключение
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным со сложнейшими взаимодействиями между ними.
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный (адаптивный) виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции, которые представляют собой микроорганизмы, злокачественные опухолевые клетки, пересаженные органы и ткани.
Адаптивный иммунитет основывается на трех главных процессах: распознавание антигенов, их удаление (элиминация) и формирование иммунологической памяти.
Поломки в структуре иммунной системы приводят к развитию иммунодефицитов, аутоиммунным заболеваниям или реакции гиперчувствительности.
Иммунодефицит на генетическом уровне (первичный) или приобретенный (вторичный) может проявиться в любом возрасте и привести к повышенной инфекционной заболеваемости. В последние годы появились средства заместительной терапии, которые продлевают жизнь этим пациентам. Для повышения качества их жизни требуется не только обеспечение дорогостоящим лечением, но и организация поддержки со стороны семьи, психологов и социальных институтов.
Аутоиммунные заболевания и гиперчувствительность – это неспособность организма противостоять разбушевавшейся иммунной системе, которая перепутала свое и чужое.
К сожалению, ни одно из заболеваний иммунной системы медицина еще не научилась излечивать, а только применять заместительную терапию.
Эффективными профилактическими методами воздействия на иммунную систему являются вакцинация и здоровый образ жизни. Купить иммунитет в аптеке пока никому не удалось.
Источник