- Коррозия металлов и способы защиты от нее
- Методы защиты от коррозии
- Защитные покрытия
- Создание сплавов, стойких к коррозии
- Изменение состава среды
- Электрохимические методы защиты
- Коррозия металлов
- Что такое коррозия и её разновидности
- Химическая коррозия
- Электрохимическая коррозия
- Трибохимическая коррозия
- Методы борьбы с коррозией
- Механические поверхностные покрытия
- Химические поверхностные покрытия
- Легирование и металлизация
- Изменение состава окружающей среды
- Кто нам мешает, тот нам поможет
- Коррозия металлов.Способы защиты от коррозии
Коррозия металлов и способы защиты от нее
| Коррозия – это процесс разрушения металлов и металлических конструкций под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе. |
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
- Благородные металлы не подвергаются коррозии из-за химической инертности.
- Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии.
- Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
| Химическая коррозия сопровождается химическими реакциями. Как правило, химическая коррозия металлов происходит при действии на металл сухих газов, её также называют газовой. |
При химической коррозии также возможны процессы:
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Как правило, такие процессы протекают в аппаратах химических производств.
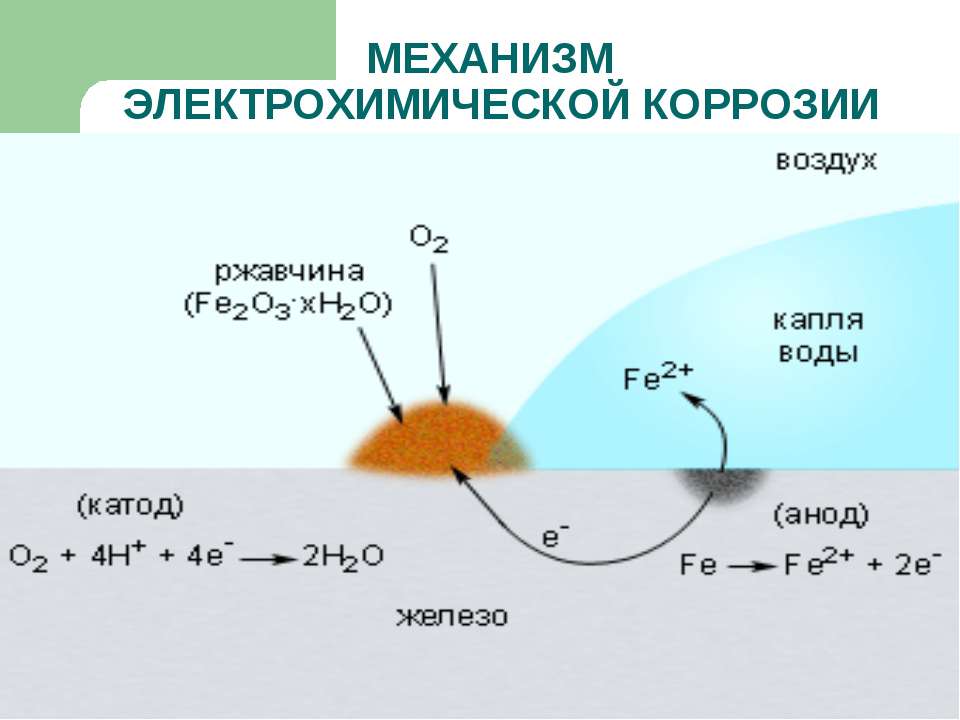
| Электрохимическая коррозия – это процесс разрушения металла, который сопровождается электрохимическими процессами. Как правило, электрохимическая коррозия протекает в присутствии воды и кислорода, либо в растворах электролитов. |
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
При этом электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
В таком загрязнённом металле идёт перенос электронов от железа к олову, при этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe –2e = Fe 2+
На поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
2H + + 2e → H2
O2 + 2H2O + 4e → 4OH –
| Например, при контакте железа с оловом в растворе соляной кислоты происходят процессы: |
Анод: Fe –2e → Fe 2+
Катод: 2H + + 2e → H2
Суммарная реакция: Fe + 2H + → H2 + Fe 2+
Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
Анод: Fe –2e → Fe 2+
Катод: O2 + 2H2O + 4e → 4OH –
Суммарная реакция:
Fe 2+ + 2OH – → Fe(OH)2
4Fe(OH)2 + O2+ 2H2O → 4Fe(OH)3
При этом образуется ржавчина.
Методы защиты от коррозии
Защитные покрытия
Защитные покрытия предотвращают контакт поверхности металла с окислителями.
- Катодное покрытие – покрытие менее активным металлом (защищает металл только неповреждённое покрытие).
- Покрытие краской, лаками, смазками.
- Создание на поверхности некоторых металлов прочной оксидной плёнки химическим путём (анодирование алюминия, кипячение железа в фосфорной кислоте).
Создание сплавов, стойких к коррозии
Физические свойства сплавов могут существенно отличаться от свойств чистых металлов. Добавление некоторых металлов может приводить к повышению коррозионной стойкости сплава. Например, нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью.
Изменение состава среды
Коррозия замедляется при добавлении в среду, окружающую металлическую конструкцию, ингибиторов коррозии. Ингибиторы коррозии — это вещества, подавляющие процессы коррозии.
Электрохимические методы защиты
Протекторная защита: при присоединении к металлической конструкции пластинок из более активного металла – протектора. В результате идёт разрушение протектора, а металлическая конструкция при этом не разрушается.
Источник
Коррозия металлов
Коррозия – разрушение поверхности сталей и сплавов под воздействием различных физико-химических факторов – наносит огромный ущерб деталям и металлоконструкциям. Ежегодно этот невидимый враг «съедает» около 13 млн. т металла. Для сравнения – металлургическая промышленность стран Евросоюза в прошлом, 2014 году произвела всего на 0,5 млн. тонн больше. И это только – прямые потери. А длительная эксплуатация стальных изделий без их эффективной защиты от коррозии вообще невозможна.
Что такое коррозия и её разновидности
Основной причиной интенсивного окисления поверхности металлов (что и является основной причиной коррозии) являются:
- Повышенная влажность окружающей среды.
- Наличие блуждающих токов.
- Неблагоприятный состав атмосферы.
Соответственно этому различают химическую, трибохимическую и электрохимическую природу коррозии. Именно они в совокупности своего влияния и разрушают основную массу металла.
Химическая коррозия
Такой вид коррозии обусловлен активным окислением поверхности металла во влажной среде. Безусловным лидером тут является сталь (исключая нержавеющую). Железо, являясь основным компонентом стали, при взаимодействии с кислородом образует три вида окислов: FeO, Fe2O3 и Fe3O4. Основная неприятность заключается в том, что определённому диапазону внешних температур соответствует свой окисел, поэтому практическая защита стали от коррозии наблюдается только при температурах выше 10000С, когда толстая плёнка высокотемпературного оксида FeO сама начинает предохранять металл от последующего образования ржавчины. Это процесс называется воронением, и активно применяется в технике для защиты поверхности стальных изделий. Но это – частный случай, и таким способом активно защищать металл от коррозии в большинстве случаев невозможно.

Химическая коррозия активизируется при повышенных температурах. Склонность металлов к химическому окислению определяется значением их кислородного потенциала – способности к участию в окислительно-восстановительных реакциях. Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.
Электрохимическая коррозия
Эта разновидность коррозии более коварна: разрушение металла в данном случае происходит при совокупном влиянии воды и почвы на стальную поверхность (например, подземных трубопроводов). Влажный грунт, являясь слабощёлочной средой, способствует образованию и перемещению в почве блуждающих электрических токов. Они являются следствием ионизации частиц металла в кислородсодержащей среде, и инициирует перенос катионов металла с поверхности вовне. Борьба с такой коррозией усложняется труднодоступностью диагностирования состояния грунта в месте прокладки стальной коммуникации.
Электрохимическая коррозия возникает при окислении контактных устройств линий электропередач при увеличении зазоров между элементами электрической цепи. Помимо их разрушения, в данном случае резко увеличивается энергопотребление устройств.
Трибохимическая коррозия
Данному виду подвержены металлообрабатывающие инструменты, которые работают в режимах повышенных температур и давлений. Антикоррозионное покрытие резцов, пуансонов, фильер и пр. невозможно, поскольку от детали требуется высокая поверхностная твёрдость. Между тем, при скоростном резании, холодном прессовании и других энергоёмких процессах обработки металлов начинают происходить механохимические реакции, интенсивность которых возрастает с увеличением температуры на контактной поверхности «инструмент-заготовка». Образующаяся при этом окись железа Fe2O3 отличается повышенной твёрдостью, и поэтому начинает интенсивно разрушать поверхность инструмента.

Методы борьбы с коррозией
Выбор подходящего способа защиты поверхности от образования ржавчины определяется условиями, в которых работает данная деталь или конструкция. Наиболее эффективны следующие методы:
- Нанесение поверхностных атмосферостойких покрытий;
- Поверхностная металлизация;
- Легирование металла элементами, обладающими большей стойкостью к участию в окислительно-восстановительных реакциях;
- Изменение химического состава окружающей среды.
Механические поверхностные покрытия
Поверхностная защита металла может быть выполнена его окрашиванием либо нанесением поверхностных плёнок, по своему составу нейтральных к воздействию кислорода. В быту, а также при обработке сравнительно больших площадей (главным образом, подземных трубопроводов) применяется окраска. Среди наиболее стойких красок – эмали и краски, содержащие алюминий. В первом случае эффект достигается перекрытием доступа кислороду к стальной поверхности, а во втором – нанесением алюминия на поверхность, который, являясь химически инертным металлом, предохраняет сталь от коррозионного разрушения.
Положительными особенностями данного способа защиты являются лёгкость его реализации и сравнительно небольшие финансовые затраты, поскольку процесс достаточно просто механизируется. Вместе с тем долговечность такого способа защиты невелика, поскольку, не обладая большой степенью сродства с основным металлом, такие покрытия через некоторое время начинают механически разрушаться.

Химические поверхностные покрытия
Коррозионная защита в данном случае происходит вследствие образования на поверхности обрабатываемого металла химической плёнки, состоящей из компонентов, стойких к воздействию кислорода, давлений, температур и влажности. Например, углеродистые стали обрабатывают фосфатированием. Процесс может выполняться как в холодном, так и в горячем состоянии, и заключается в формировании на поверхности металла слоя из фосфатных солей марганца и цинка. Аналогом фосфатированию выступает оксалатирование – процесс обработки металла солями щавелевой кислоты. Применением именно таких технологий повышают стойкость металлов от трибохимической коррозии.
Недостатком данных методов является трудоёмкость и сложность их применения, требующая наличия специального оборудования. Кроме того, конечная поверхность изменяет свой цвет, что не всегда приемлемо по эстетическим соображениям.
Легирование и металлизация
В отличие от предыдущих способов, здесь конечным результатом является образование слоя металла, химически инертного к воздействию кислорода. К числу таких металлов относятся те, которые на линии кислородной активности находятся возможно дальше от водорода. По мере возрастания эффективности этот ряд выглядит так: хром→медь→цинк→серебро→алюминий→платина. Различие в технологиях получения таких антикоррозионных слоёв состоит в способе их нанесения. При металлизации на поверхность направляется ионизированный дуговой поток мелкодисперсного напыляемого металла, а легирование реализуется в процессе выплавки металла, как следствие протекания металлургических реакций между основным металлом и вводимыми легирующими добавками.

Изменение состава окружающей среды
В некоторых случаях существенного снижения коррозии удаётся добиться изменением состава атмосферы, в которой работает защищаемая металлоконструкция. Это может быть вакуумирование (для сравнительно небольших объектов), или работа в среде инертных газов (аргон, неон, ксенон). Данный метод весьма эффективен, однако требует дополнительного оборудования — защитных камер, костюмов для обслуживающего персонала и т.д. Используется он главным образом, в научно-исследовательских лабораториях и опытных производствах, где специально поддерживается необходимый микроклимат.
Кто нам мешает, тот нам поможет
В завершение укажем и на довольно необычный способ коррозионной защиты: с помощью самих окислов железа, точнее, одного из них — закиси-окиси Fe3O4. Данное вещество образуется при температурах 250…5000С и по своим механическим свойствам представляет собой высоковязкую технологическую смазку. Присутствуя на поверхности заготовки, Fe3O4 перекрывает доступ кислороду воздуха при полугорячей деформации металлов и сплавов, и тем самым блокирует процесс зарождения трибохимической коррозии. Это явление используется при скоростной высадке труднодеформируемых металлов и сплавов. Эффективность данного способа обусловлена тем, что при каждом технологическом цикле контактные поверхности обновляются, а потому стабильность процесса регулируется автоматически.
Источник
Коррозия металлов.Способы защиты от коррозии
Коррозия – самопроизвольный процесс и соответственно протекающий с уменьшением энергии Гиббса системы. Химическая энергия реакции коррозионного разрушения металлов выделяется в виде теплоты и рассеивается в окружающем пространстве.
Коррозия приводит к большим потерям в результате разрушения трубопроводов, цистерн, металлических частей машин, корпусов судов, морских сооружений и т. п. Безвозвратные потери металлов от коррозии составляют 15 % от ежегодного их выпуска. Цель борьбы с коррозией – это сохранение ресурсов металлов, мировые запасы которых ограничены. Изучение коррозиии разработка методов защиты металлов от нее представляют теоретический интерес и имеют большое народнохозяйственное значение.
Ржавление железа на воздухе, образование окалины при высокой температуре, растворение металлов в кислотах – типичные примеры коррозии. В результате коррозии многие свойства металлов ухудшаются: уменьшается прочность и пластичность, возрастает трение между движущимися деталями машин, нарушаются размеры деталей. Различают химическую и электрохимическую коррозию.
Химическая, коррозия – разрушение металлов путем их окисления в сухих газах, в растворах неэлектролитов. Например, образование окалины на железе при высокой температуре. В этом случае образующиеся на металле оксидные плёнки часто препятствуют дальнейшему окислению, предотвращая дальнейшее проникновение к поверхности металла как газов, так и жидкостей.
Электрохимической коррозией называют разрушение металлов под действием возникающих гальванических пар в присутствии воды или другого электролита. В этом случае наряду с химическим процессом – отдача электронов металлами, протекает и электрический процесс – перенос электронов от одного участка к другому.
Этот вид коррозии подразделяют на отдельные виды: атмосферную, почвенную, коррозию под действием «блуждающего» тока и др.
Электрохимическую коррозию вызывают примеси, содержащиеся в металле, или неоднородность его поверхности. В этих случаях при соприкосновении металла с электролитом, которым может быть и влага, адсорбируемая на воздухе, на его поверхности возникает множество микрогальванических элементов. Анодами являются частицы металла, катодами – примеси и участки металла, имеющие более положительный электродный потенциал. Анод растворяется, а на катоде выделяется водород. В то же время на катоде возможен процесс восстановления кислорода, растворённого в электролите. Следовательно, характер катодного процесса будет зависеть от некоторых условий:
кислая среда: 2Н + + 2ē = Н2 (водородная деполяризация),
нейтральная среда: O2+2H2O+4e − =4OH − (кислородная деполяризация).
В качестве примера рассмотрим атмосферную коррозию железа в контакте с оловом. Взаимодействие металлов с каплей воды, содержащей кислород, приводит к возникновению микрогальванического элемента, схема которого имеет вид
Более активный металл (Fе) окисляется, отдавая электроны атомам меди и переходит в раствор в виде ионов (Fe 2+ ). На катоде протекает кислородная деполяризация.
Способы защиты от коррозии. Все методы защиты от коррозии можно условно разделить на две большие группы: неэлектрохимические (легирование металлов, защитные покрытия, изменение свойств коррозионной среды, рациональное конструирование изделий) и электрохимические (метод проектов, катодная защита, анодная защита).
Легирование металлов – это эффективный, хотя и дорогой метод повышения коррозионной стойкости металлов, при котором в состав сплава вводят компоненты, вызывающие пассивацию металла. В качестве таких компонентов применяют хром, никель, титан, вольфрам и др.
Защитные покрытия – это слои, искусственно создаваемые на поверхности металлических изделий и сооружений. Выбор вида покрытия за- висит от условий, в которых используется металл.
Материалами для металлических защитных покрытий могут быть чистые металлы: цинк, кадмий, алюминий, никель, медь, олово, хром, серебро и их сплавы: бронза, латунь и т. д. По характеру поведения металлических покрытий при коррозии их можно разделить на катодные (например, на стали Cu, Ni, Ag) и анодные (цинк на стали). Катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия. В случае анодного покрытия защищаемый металл играет роль катода и поэтому не корродирует. Но потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия. Так, покрытие стали оловом в растворе H2SO4 – катодное, а в растворе органических кислот – анодное.
Неметаллические защитные покрытия могут быть как неорганическими, так и органическими. Защитное действие таких покрытий сводится в основном к изоляции металла от окружающей среды.
Электрохимический метод защиты основан на торможении анодных или катодных реакций коррозионного процесса. Электрохимическая защита осуществляется присоединением к защищаемой конструкции (корпус судна, подземный трубопровод), находящейся в среде электролита (морская, почвенная вода), металла с более отрицательным значением электродного потенциала – протектора.
Источник




