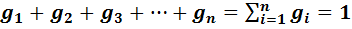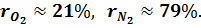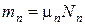Способы задания газовой смеси.



Массовая доля.
Наиболее простой способ определения состава газовой смеси – это определение массового состава смеси, т.е. для каждого газа находим его долю в общей массе смеси – массовую долю:
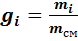
Очевидно, что 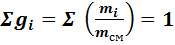
т.е.
Молярная доля.
Можно найти и молярный состав смеси. Действительно, зная молярные массы, находим количество вещества каждого компонента
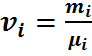
Следовательно, количество вещества в газовой смеси
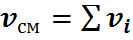
Имея эти данные, находим молярный состав смеси – молярные доли:
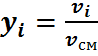
Молярную массу смеси можно определить следующим образом.
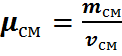
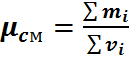
Полученное значение 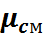
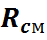
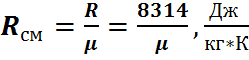
Объёмная доля.
Наиболее часто задается объемный состав смеси, поэтому необходимо ввести понятие о парциальном объёме компонентов.
Пусть имеется газовая смесь из двух компонентов. Если собрать молекулы одного газа в одной части объёма, а молекулы другого газа в другой части. Части объёма каждого газа и называются парциальными. Подбирая соответствующим образом доли от общего объёма, можно добиться того, что каждый газ достигает давления смеси. Объёмы, которые занимают эти газы, называют приведенными, т.е. приведенными к давлению смеси. Сумма приведенных объемов равна объёму смеси (закон Амага):
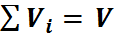
Отсюда может быть определен объёмный состав смеси, причем объёмная доля каждого компонента выражается отношением
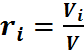
Так как каждый компонент смеси подвергается сжатию при постоянной температуре, то для 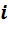
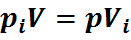
Здесь 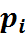
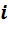
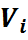
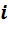
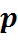
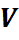
Из уравнения (27) следует:
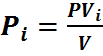
но 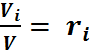
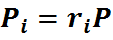
Эта формула позволяет определять парциальные давления компонентов смеси, если известен объёмный состав смеси.
Так как при одинаковых давлениях и температурах молярные объёмы газов одинаковы, то можно написать для 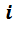
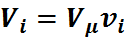
а для всей смеси
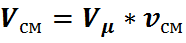
Из этих уравнений находим
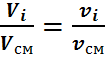
Следовательно, молярные доли численно равны объёмным:
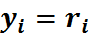
Связь между долями.
Массовые и объёмные (молярные) доли можно связать между собой, если известна плотность 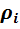
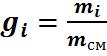
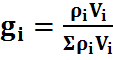
Для определенной газовой смеси массовые и объёмные доли 
Из следствия 2 закона Авогадро известно, что плотности веществ зависят от их молярных (молекулярных) масс, т.е. они пропорциональны молярным массам.
Так, например, для сухого воздуха
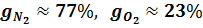
а в объёмных:
Источник
Способы задания состава газовых смесей
Состав газовой смеси может быть задан массовыми, объемными или мольными долями.
Массовой долей называется отношение массы отдельного компонента Мi, к массе смеси М:
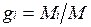
Очевидно, что 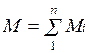

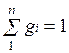
Массовые доли часто задаются в процентах. Например, для сухого воздуха 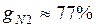
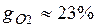
Объемная доля представляет собой отношение приведенного объема газа V, к полному объему смеси V: 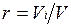
Приведенным называется объем, который занимал бы компонент газа, если бы его давление и температура равнялись давлению и температуре смеси.
Для вычисления приведенного объема запишем два уравнения состояния i-го компонента:
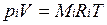
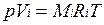
Первое уравнение относится к состоянию компонента газа в Смеси, когда он имеет парциальное давление pi и занимает полный объем смеси, а второе уравнение — к приведенному состоянию, когда давление и температура компонента равны, как и для смеси, р и Т. Из уравнений следует, что
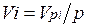
Просуммировав соотношение (2.2) для всех компонентов смеси, получим с учетом закона Дальтона 
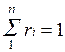
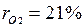
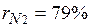
Иногда бывает удобнее задать состав смеси мольными долями. Мольной долей называется отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси N.
Пусть газовая смесь состоит из N1 молей первого компонента, N2 молей второго компонента и т. д. Число молей смеси 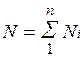
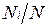
В соответствии с законом Авогадро объемы моля любого газа при одинаковых р и Т, в частности при температуре и давлении смеси, в идеально газовом состоянии одинаковы. Поэтому приведенный объем любого компонента может быть вычислен как произведение объема моля 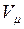
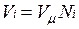
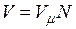
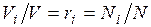
Источник
ЛЕКЦИЯ 3. Способы задания состава смеси
Способы задания состава смеси. Соотношения между ними
Смеси идеальных газов. Закон Дальтона
В ТТД чистым веществом наз. вещество, все молекулы которого одинаковы. Смесь, состоящая из нескольких чистых веществ наз. раствором. Чистыми веществами явл., например, вода, этиловый спирт, азот, аммиак и т.п. Чистые вещества, составляющие смесь, наз. компонентами.
При рассмотрении смесей газов исходят из того, что смесь идеальных газов, не вступающих в химическое взаимодействие друг с другом, так же явл. идеальным газом и подчиняется таким же законам. При этом каждый газ, входящий в состав газовой смеси, ведет себя так, как будто он один при данной температуре Т занимает весь объём смеси, т.е. равномерно распространяется по всему объёму смеси и оказывает на стенки сосуда своё давление, наз. парциальным.
В 1801г. английский учёный Дальтон экспериментально установил связь между парци- альными давлениями отдельных газов и давлением смеси. При постоянной температуре полное давление смеси нескольких газов равно сумме их парциальных давлений:

где pі— парциальное давление i-го газа; n-количество газов, составляющих газовую смесь.
Газовая смесь может быть задана массовыми, объёмными и мольными долями.
Газовая смесь, заданная массовым составом, характеризуется массовыми долями. Массовой долей компонента gi наз. отношение массы отдельного компонента mi, входящего в смесь, к массе всей смеси Мсм, т.е.
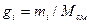
Очевидно, что масса газовой смеси равна сумме масс всех входящих в неё газов:

Определим сумму массовых долей отдельных газов:
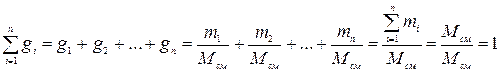
Массовые доли часто задаются в процентах (%).
Газовая смесь, заданная объёмным составом, характеризуется объемными долями (ri). Объёмная доля каждого газа выражается отношением приведенного объёма газа Vi к полному объёму смеси Vсм.
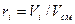
Приведенным Vi наз. объём, который занимал бы компонент газа, если бы его давление рi и температура Тi равнялись давлению рсм и температуре Тсм.
Парциальный объём каждого газа определяется по закону Бойля-Мариотта. При T=const.=Tсм

Из уравнений (2.26) имеем: 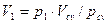
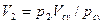
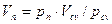
Сложив отдельно левые и правые части уравнений (2.27), получим:

По закону Дальтона 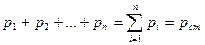
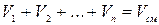
составляющих смесь, равна объёму смеси газов (закон Амала).
Сумма объёмных долей газов, составляющих смесь, равна единице
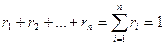
Объёмные доли часто задаются в процентах (%).
Газовая смесь, заданная мольным составом, характеризуется мольными долями. Мольной долей 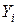
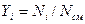
Вполне очевидно, что сумма молей всех газов, составляющих смесь, равна общему числу молей газовой смеси, т.е. 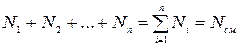
Сумма мольных долей смеси газов равна единице: 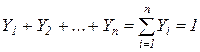
Если известен массовый состав смеси, то по нему можно найти её мольный состав. Массы отдельных газов mi и полную массу смеси Мсм можно выразить через число молей следующем образом: 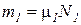
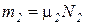
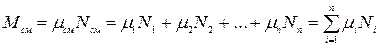
2.8. Теплоёмкость. Массовая, объёмная и молярная теплоемкости.
Теплоемкости при постоянных объёме и давлении
Теплоёмкостью наз. количество теплоты, необходимое для повышения температуры тела на один градус. Теплоёмкость не является постоянной величиной и в общем случае изменяется с изменением температуры и давления. Теплоёмкость единицы количества вещества наз. удельной теплоёмкостью. Удельная теплоёмкость тела зависит от химического состава, параметров состояния рабочего тела, а также от вида процесса, в котором телу сообщается
теплота, поскольку теплота есть функция процесса. Размерность удельной теплоёмкости:
Дж/(кг(м 3 , (моль))) К).
В ТТД различают удельные массовую с, (Дж/(кг К)), объемную с’ , (Дж/(м 3 К)) и мольную сµ (Дж/(моль К)) теплоёмкости.
Зависимости между удельными теплоёмкостями устанавливаются из следующих выражений:
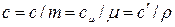
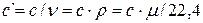
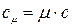
Различают истинную и среднюю теплоёмкости.
Истинной теплоёмкостьюназ. производная от количества теплоты, подведённой к телу, по температуре этого тела и определяется выражением:
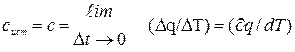
То есть истинная теплоёмкость тела – это его теплоёмкость при данной температуре.
Средней теплоёмкостью наз. теплоёмкость в интервале температур Т2 – Т1, она обозначается Сm. При уменьшении разности температур средняя теплоёмкость приближается к истинной.
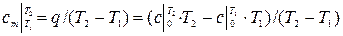
Удельной изохорной теплоемкостью 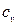
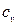
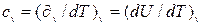
Удельной изобарной теплоемкостью 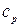
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник