Высушивание и фиксация мазков препаратов
Изготовленные мазки высушивают при комнатной температуре или в термостате. Тонкие мазки быстро высыхают на воздухе, более толстые можно высушивать над пламенем горелки или спиртовки. Предметное стекло при этом держат пинцетом (или за ребра 1-м и 2-м пальцами правой руки) мазком кверху. Чтобы не допустить денатурации белков бактерий и нарушения их внутренней структуры степень нагревания контролируют, прикасаясь к тыльной стороне ладони – должно ощущаться легкое чувство жжения.
Высушенные препараты необходимо фиксировать к поверхности стекла. Для того, чтобы убить и закрепить бактерий на стекле, предотвратив их смывание в процессе окраски. К тому же убитые микроорганизмы значительно лучше окрашиваются, а также не представляют опасности для работающих.
В лабораторной практике самым распространенным методом фиксации мазков является фламбирование — то есть фиксация в пламени газовой горелки или спиртовки. При этом мазок держат так же, как при высушивании и трижды проводят его через пламя. Весь процесс фиксации длится 5-6 с, а действие температуры — 2 с. Более длительная фиксация уменьшает качества препарата, а недофиксированный мазок при следующей обработке смывается и таит в себе опасность заражения.
При изучении некоторых структур микробных клеток, а также мазков крови, отпечатков органов, которые деформируются при высокой температуре фиксируют химическим способом, при помощи одной из фиксирующих жидкостей: этанолом (на протяжении 10-15 мин), метанолом (5 мин), ацетоном (5 мин), смесью Никифорова (10-15 мин), парами формалина или осмиевой кислоты (несколько секунд). При такой осторожной фиксации значительно лучше сохраняются и просмотриваются все структуры клеток и бактерий.
Окраска препаратов
Существуют простые и сложные методы окраски. При окраске простым методом используется только один краситель, позволяющий отличить клетки от неокрашенного фона, Простой метод окрашивания дает возможность исследовать общую морфологию микробов, их размеры, форму, количество, локализацию, взаимное расположение клеток и т. п.. Но с его помощью невозможно изучать внутреннюю структуру бактерий и их разное отношение к нескольким красителям.
Простым окрашиванием называют такое, при котором применяют лишь один краситель. Чаще всего используют основной разведенный фуксин Пфейффера и щелочную метиленовую синьку Леффлера. Фуксином красят 1-2 мин, а синькой 3-5 мин. Препараты, которые содержат, кроме бактерий, тканевые и клеточные элементы макроорганизма, лучше окрашивать метиленовой синькой, которая красит фон препарата сравнительно слабо, а бактерии значительно интенсивнее.После истечения времени окрашивания препарат промывают дистиллированной водой до тех пор, пока стекающая вода не станет бесцветной. Затем мазки высушивают на воздухе или между листами фильтровальной бумаги и микроскопируют с использованием иммерсионного объектива.
При окраске сложным методом используют несколько последовательно наносимых красителей, фиксатор и проявитель (окраска по методу Грама и др.).
Различия в окраске по Граму связаны с некоторыми особенностями строения клеточной стенки бактерий. В однослойной клеточной стенке грамположительных микробов имеется несколько рядов пептидогликана (до 80 % от массы клеточной стенки), поры которого при обработке этиловым спиртом сужаются и препятствуют выходу комплекса, образуемого при взаимодействии красителя генцианового фиолетового с компонентами клетки в присутствии йода, входящего в состав люголя. Также в поверхностном слое клетки находится магниевая соль рибонуклеиновой кислоты, которая в присутствии йода в кислой среде образует прочное соединение с основным красителем – генциановым фиолетовым. Поэтому грамположительные микробы прочно удерживают первый наносимый краситель – генциан-виолет и окрашиваются в фиолетовый цвет.
У грамотрицательных микроорганизмов имеется двуслойная клеточная стенка. Во внутренний слой входят всего один-два ряда пептидогликана. Верхний слой представлен наружной мембраной, включает фосфолипиды, белки и липополисахарид (ЛПС). Отсутствует магниевая соль рибонуклеиновой кислоты. В связи с этим не образуется прочного соединения компонентов клеточной стенки с основным красителем. Они легко обесцвечиваются этиловым спиртом. Поэтому клетки бактерий окрашиваются в цвет последнего наносимого на их поверхность красителя (водный фуксин) – в красный.
Техника окраски по Граму:
1. Фиксированный мазок кладут на рельсы и накрывают бумажкой по Синеву с генцианфиолетовым, заливают ее водой или наливают на мазок генциан-виолетом через фильтровальную бумагу. Экспозиция 2 мин.
2. Снимают бумажку и наливают раствор Люголя на 1 -2 минуты.
3. Сливают Люголь в кювету, на мазок наливыют с 96˚ этиловый спирт до прекращения отхождения «струею» красителя, примерно 10-15 сек.
4. Промывают проточной водой, стряхивают воду.
5. Наносят фуксин Пфейффера.Экспозиция 2 мин.
5. Промывают проточной водой и сушат в вертикальном положении.
6. Микроскопируют с помощью иммерсионной системы микроскопа.
Отличительные признаки
Дата добавления: 2018-04-05 ; просмотров: 1347 ; Мы поможем в написании вашей работы!
Источник
Медицина 2.0
Приготовление препаратов-мазков
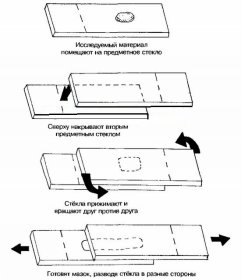
I. Собственно мазок. При приготовлении мазка с плотной питательной среды на обезжиренное предметное стекло нанести петлей небольшую каплю воды. В правую руку взять бактериологическую петлю, в левую — пробирку с культурой. Простерилнзовать петлю, внося ее в пламя горелки в вертикальном положении. После того как петля накалится докрасна, провести конец петледержателя через пламя. Вынуть пробку из пробирки, захватить ее мизинцем правой руки. Обжечь на спиртовке крал пробирки. Внося петлю в пробирку, охладить ее, касаясь стенок пробирки. Затем петлей с поверхности среды снять очень небольшое количество культуры. Не касаясь стенок пробирки, вынуть петлю, еще раз обжечь края пробирки над спиртовкой и закрыть ее пробкой. Захваченную петлей культуру внести в приготовленную ранее каплю воды, хорошо размешать и равномерно распределить по стеклу в виде небольшого круга или овала (1-1,5 см в диамет-ре). По окончании приготовления мазка вновь простерилнзовать петлю.
Для приготовления мазка из бульонной культуры на предметное стекло нанести 1-2 петли исследуемого материала и равномерно распределить по стеклу (не требуется использование воды). С обратной стороны стекла карандашом по стеклу записать шифр препарата и обвести мазок,
Высушивание. Высушивание мазка производится на воздухе. Для ускорения высушивания предметное стекло с мазком, обращенным кверху, подержать в струе теплого воздуха, высоко над пламенем спиртовки, не внося препарат в пламя.
Фиксация. Используют физический и химический методы фиксаций. Физический — фиксация мазка над пламенем горелки или спиртовки в течение нескольких секунд мазком вверх. Эту операцию проводят достаточно быстро, стараясь не перегреть мазок так как при перегревании могут произойти необратимые изменения в клетке. Химический метод фиксации — более мягкий по сравнению с фиксацией на пламени. В качестве фиксаторов используют этанол, ацетон, смесь Никифорова (этанол + эфир 1:1), метанол, фйрмалин. После фиксации мазок можно окрашивать.
Окраска мазка. На мазок нанести несколько капель раствора красителя так, чтобы весь мазок был покрыт краской. Оставить краску на определенное время. Промыть препарат водой, просушить фильтровальной бумагой.
Рассматривать препарат с использованием иммерсионной системы. Каплю иммерсионного масла можно наносить только на сухой мазок.
Отношение микроорганизмов к красящим веществам называется тинкториальным свойством. Наибольшее применение имеют основные краски: метиленовый синий, основной фуксин, генцианвиолет, кристаллический фиолетовый и другие.
Окраска микроорганизмов имеет большое диагностическое значение, так как дает возможность установить морфологические и тинкториальные особенности микроба. В некоторых случаях этого достаточно для постановки микробиологического диагноза.
Окраска микроорганизмов представляет собой сложный физико-химический процесс, в механизме которого существенную роль играют явления адсорбции, капиллярности, химического сродства между красителем и окрашиваемым объектом и рН среды, в которой они находятся.
Различают простые и сложные методы окраски
К простым относятся методы с использованием одного вида красителя, к сложным — нескольких красителей.
Простые методы окраски:
метиленовым синим — окраска в течение 3-5 мин;
генцнанвиолетом — окраска в течение 1 -2 мин;
фуксином водным — окраска в течение 1-2 мин.
Простыми методами окраски пользуются для обнаружения в микроскопируемом материале микробов, определения их количества, формы и расположения.
Сложные методы окраски используют для дифференциации микробов по морфологическим и тинкториальным свойствам.
Источник
Приготовление препаратов для микроскопирования
 |  | |
 | Практические советы Витальное окрашивание Прижизненное окрашивание Домашняя лаборатория Занимательная микроскопия Изготовление микропрепаратов Камера Горяева Классификация и маркировка объективов микроскопов Комбинации цветных стекол для выделения спектра Методы микроскопирования Методы исследования простейших Методы и приемы биологического эксперимента Микроскопия для начинающих Микроскопические измерения Модификации контрастной окраски по Граму Необходимое оборудование Общие методы заключения препаратов Организация и оснащение гистологической лаборатории Освещение по Келлеру Подготовка предметных стекол Поляризационная микроскопия Правила работы с микроскопом Правила ведения лабораторного журнала Приобретение микроскопа Приготовление микропрепаратов членистоногих Техника приготовления гистологических препаратов Фототубус для цифровых камер Формидрон инструкция по применению |  |
 |  |
 |  | |
 | |  |
 |  |  |
 |  | |
 | |  |
 |  |  |
 |  | |
 | |  |
 |  |  |
 |  | ||||||||||
 |
|  | |||||||||
 |  |
 |  | ||||||
 |
|  | |||||
 |  |  | |||||
 |  | |
 | |