Способы выражения составов многокомпонентных смесей
Состав многокомпонентной смеси — раствора, смеси газов или паров, многокомпонентного твёрдого вещества — и, в частности, содержание в ней какого-либо компонента, может выражаться разными способами: как с помощью безразмерных единиц — долей или процентов, так и через размерные величины — концентрации.
В теории массообмена наиболее употребительны следующие величины, выражающие содержание компонента в системе:
1. Объёмная доля — безразмерное отношение объёма компонента «А» ко всему объёму системы.
Обозначение объёмной доли компонента — «j».
Формально доля — безразмерное отношение, но фактически единицей измерения объёмной доли является: [(м 3 А)/(м 3 смеси)].
2. Молярная доля — безразмерное отношение количества вещества компонента «А» к количеству вещества системы.
Обозначения: молярная доля компонента в жидкой фазе — «х», в газовой (паровой) фазе — «у».
В строгой записи у символа доли «х» или «у» (впрочем, как и у символа объёмной доли «j»), должен фигурировать нижний индекс «А».
Фактическая единица измерения молярной доли: [(моль А)/(моль смеси)].
3. Массовая доля — безразмерное отношение массы компонента «А» ко всей массе системы.
Обозначения: массоваядоля компонента в жидкой фазе — « 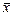

Заметим, что в теории массообмена используются специфические обозначения массовой доли: не «w», как это принято в химии, а « 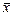

Фактическая единица измерения массовой доли: [(кг А)/(кг смеси)].
4. Молярная концентрация — величина, равная отношению количества вещества компонента «А» ко всему объёму системы.
Используемый в химии термин «молярность» – синоним термина «молярная концентрация», – в теории массообмена не применяется.
Обозначения: молярная концентрация компонента в жидкой фазе — «сх», в газовой (паровой) фазе — «су».
Единица измерения молярной концентрации: [(моль А)/м 3 ].
5. Массовая концентрация — величина, равная отношению массы компонента «А» ко всему объёму системы.
Обозначения: массовая концентрация компонента в жидкой фазе — « 

Как видим, в теории массообмена для обозначения массовой концентрации принят символ « 
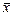

Единица измерения массовой концентрации: [(кг А)/м 3 ].
6. Молярное отношение — безразмерное отношение количества вещества компонента «А» к количеству других веществ системы.
Обозначения: молярное отношение компонента в жидкой фазе — «Х», в газовой (паровой) фазе — «Y».
Фактическая единица измерения: [(моль А)/(моль В)], где символом «В» обозначены все вещества смеси за исключением «А».
7. Массовое отношение — безразмерное отношение массы компонента «А» к массе остальных компонентов системы.
Обозначения: массовое отношениекомпонента в жидкой фазе — « 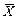

Фактическая единица измерения: [(кг А)/(кг В)].
Разнообразие в способах выражения составов фаз продиктовано тем, что, в силу специфики того или иного массообменного процесса, его расчёт удобнее выполнять с использованием определённого выражения содержания компонента. В то же время, исходная информация может быть представлена в иных единицах измерения концентрации.
Так, например, содержание компонента в газовой фазе часто указывается в объёмных долях потому, что именно в объёмных долях отградуированы шкалы многих приборов – газоанализаторов.
Соотношения между различными способами выражения составов многокомпонентных смесей
Установить соотношения между различными способами выражения содержания компонента в системе несложно.
Если содержание компонента «А» в газовой фазе задано как объёмная доля, то в 1 м 3 газовой смеси содержится jА [м 3 компонента «А»] и (1 – jА) [м 3 компонента «В»]. В этом случае объёмное отношение компонента «А»:

Следовательно, массовое отношение компонента «А» в смеси:

Поскольку для определения плотности газа при рабочих условиях почти всегда используются справочные данные о плотности при нормальных физических условиях (r 0 ) и уравнение Клапейрона – Менделеева, то

Тогда молярное отношение компонента «А» в газовой смеси:

где МА и МВ – молярные массы компонентов «А» и «В», соответственно.
Если же рассматривается 1 кг смеси, в котором массовая доля компонента «А» составляет 
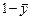

Отсюда следует, что
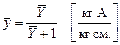
Подставляя сюда выражение для 

Проводя аналогичные рассуждения для 1 моль газовой смеси, в которой молярная доля компонента «А» равна у [(моль А)/(моль смеси)], а доля компонента «В» — (1 – у) [(моль В)/(моль смеси)], имеем:


Подставляя сюда выражение для Y из (2.4), получаем

Фигурирующее в формулах (2.4) и (2.10) отношение 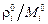

Если считать, что молярный объём любого газа при физически нормальных условиях примерно одинаков ( 
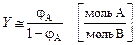
а из формулы (2.10) —
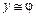
то есть, в отдельных случаях допустимо считать, что молярная доля компонента в газовой фазе приблизительно равна его объёмной доле.
Если для отдельных компонентов и для газовой смеси в целом применимо уравнение Клапейрона – Менделеева, то можно записать:


где nA – количество вещества компонента «А»;
п – количество вещества смеси;
R = 8314,41 Дж/(кмоль∙К) – универсальная газовая постоянная;
р – общее давление в системе;
pA – парциальное давление компонента «А» газовой смеси.
Разделив уравнение (2.14) на (2.15) и сократив равные величины, получаем:

Отношение 

В то же время в формуле (2.14) отношение 
В результате имеем соотношение:

Формулы (2.1), (2.5), (2.6), (2.8), (2.9) могут применяться не только к газовым, но и к жидким смесям, только, разумеется, с заменой в этих формулах букв «игрек» на буквы «икс».
Отношения как способ выражения состава смеси
Итак, содержание компонента в смеси может быть выражено по-разному — и через концентрации, и через доли (объёмные, массовые, молярные).
Может возникнуть вопрос: «Зачем вводить ещё какие-то “отношения”, когда и так существует немало различных способов выражения состава?»
Ответ был дан выше. Здесь повторим: в некоторых случаях в силу специфики массообменного процесса его анализ или расчёт удобнее всего выполнять, применяя именно отношения.
Вот простой пример.
Пусть имеются газовая фаза, состоящая из азота и аммиака, и жидкая фаза, состоящая из воды и аммиака.
Как известно, аммиак в воде растворяется очень хорошо. (Впрочем, также хорошо аммиак улетучивается из водного раствора. Каждому химику, и не только химику, знаком запах нашатырного спирта.) Азот в воде растворим чрезвычайно мало; в дальнейшем считаем, что азот совсем не растворяется в воде. Также полагаем, что молекулы Н2О не испаряются и не попадают в газовую фазу.

В аппарат сверху непрерывно подаётся жидкий поглотитель — вода с небольшим содержанием растворённого в ней аммиака, то есть слабый (неконцентрированный) раствор. Так же непрерывно жидкая фаза отводится из аппарата снизу в виде обогащённого [аммиаком] поглотителя.
Пусть в тот же аппарат снизу непрерывно подаётся газовая смесь азота и аммиака. Пройдя через аппарат, газовая фаза отводится из аппарата сверху.
Очевидно, при условиях проведения процесса содержание NH3 в жидкой фазе увеличивается от верхнего сечения аппарата до нижнего; увеличивается и расход жидкой фазы в целом (как массовый расход, так и расход количества вещества). Содержание NH3 в газовой фазе от нижнего до верхнего сечения аппарата уменьшается; уменьшается и расход газовой фазы.
В реальных аппаратах фазы каким-то образом распределены друг в друге. Например, газовая фаза распределена в виде пузырей в жидкой фазе. Фазы отделены друг от друга (потому они и называются «фазами») хаотично изменяющейся поверхностью раздела.
Теперь представим тот же аппарат в виде условного объекта, в котором имеется фиксированная поверхность раздела фаз А‑А (рисунок 2), так что по одну сторону от неё (слева на рисунке) движется сплошная жидкая фаза, а по другую (справа на рисунке) — сплошная газовая фаза
 |
 |  |
|
|



 |




|
|


|

|
На рис. 2 ширина окрашенной фигуры в том или ином горизонтальном сечении пропорциональна расходу. На том же рисунке интенсивность окраски фигуры соответствует содержанию аммиака в фазе.
Как видно из этого рисунка, в нижнем сечении аппарата расходы обеих фаз максимальны, а в верхнем сечении — минимальны.
Далее представим, что в каждом сечении мы отсортировали молекулы NH3 от молекул Н2О в жидкой фазе, и молекулы NH3 от молекул N2 в газовой фазе (рисунок 3).
На этом рисунке молекулы NH3 имеют условную красную окраску, молекулы H2O — синюю, а молекулы N2 — жёлтую.
Из рисунка 3 видно, что как количество молекул Н2О, так и их масса в каждом сечении одинаковы, поскольку принято, что молекулы Н2О не испаряются и не попадают в газовую фазу.
Количество и масса молекул N2 так же неизменны в каждом сечении аппарата, так как принято, что азот совсем не растворяется в воде.
По этой причине в расчётах удобнее всего оперировать постоянными расходами так называемых инертных [к массообмену] носителей (в данном примере — расходами именно Н2О в жидкой фазе и N2 в газовой фазе). Очевидно, в расчётных уравнениях будут фигурировать только два параметра — два постоянных расхода носителей, вместо четырёх параметров: расходов жидкой фазы на входе в аппарат и на выходе из него и расходов газовой фазы на входе и на выходе из аппарата.
Содержание распределяемого компонента (NH3) в фазах при этом следует выражать в отношениях.
В данном примере массовые отношения аммиака в фазах 

[1] Закон открыт нем. учёным А. Фиком (A. Fick, 1855).
Источник





