Способы выражения состава смесей газов
Для того чтобы воспользоваться уравнением Менделеева-Клапейрона для смеси газов
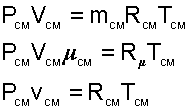 |
необходимо знать газовую постоянную RСМ и молярную массу (условную) смеси µСМ. Для смеси, как для любого идеального газа, эти две величины связаны соотношением RСМ=8314/µСМ (Дж/(кг•К)). Чтобы рассчитать эти величины, необходимо знать состав смеси газов, т.е. какие газы и в какой пропорции входят в смесь.
Состав смеси может быть задан массовыми, объемными или мольными долями.
Массовой долей gi данного газа называется отношение его массы к массе всей смеси:
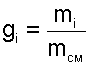 |
где mi – масса отдельного газа, входящего в смесь;
mСМ – общая масса смеси.
Очевидно, что сумма массовых долей всех газов смеси равна единице:
 |
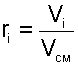 |
где Vi – объем данного газа при ТСМ и РСМ, м 3 .
Объем Vi называют парциальным объемом, это искусственно введенная величина, поскольку каждый газ, входящий в смесь, занимает весь объем смеси. Парциальный объем можно рассчитать по уравнению Менделеева – Клапейрона:
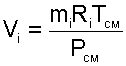 |
 |
можно получить еще одно расчетное выражение для объемной доли, поделив правые и левые части этих уравнений одно на другое:
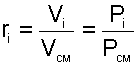 |
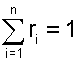 |
 |
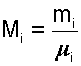 |
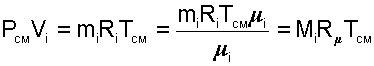 |
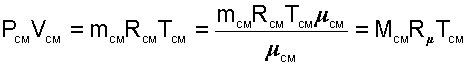 |
получим еще одно расчетное выражение для мольной доли:
 |
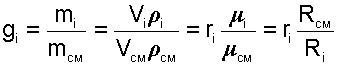 |
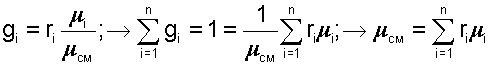 |
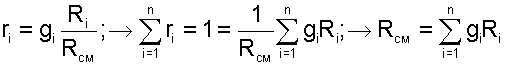 |
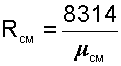 |
Для определения парциального давления данного газа в смеси можно воспользоваться выражением (4.71). В соответствии с ним
Источник
Способы выражения состава
Нефтяной газ представлен в виде смеси углеводородов, поэтому для оценки его физико-химических свойств необходимо знать способы выражения состава смеси.
Массовая (весовая) доля (gi) – величина, нормированная на 1 (в долях) или на 100 % и характеризует, отношение массы i-го компонента (mi), содержащегося в системе к общей массе системы:
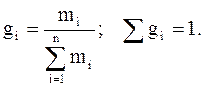
Молярная (мольная) доля (Ni) – величина, нормированная на 1 или на 100 % и характеризует, отношение числа молей i-го компонента (ni) к общему числу молей компонентов в системе:
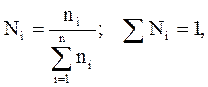
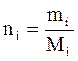
где mi – масса i-го компонента;
Мi – молекулярный вес i-го компонента.
Из соотношений 2.4–2.5 легко найти выражения для пересчетов массового и мольного составов:
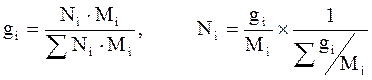
Объёмная доля – величина, нормированная на 1 или на 100 % и характеризует долю (Vi), которую занимает компонент в объёме системы. С учетом выражений 2.4–2.6 можно выразить взаимосвязь объёмной доли с массовыми и мольными долями:
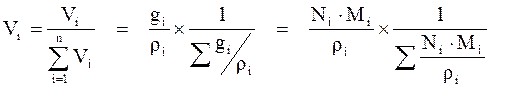
Для идеального газа соблюдается соотношение: объёмная доля компонента (Vi) равна мольной доли компонента (Ni), т. е. Vi = Ni, как следствие закона Авогадро. Для идеальной системы, как нефтяной газ, состав его можно рассчитать на основе любых данных: масс компонентов, объёмов, плотностей, парциальных давлений и др.
Рассмотрим пример. Дан объёмный состав нефтяного газа (Vi, %):
Найти: массовый состав (gi, в долях) газа?
Решение. Для идеального газа величины объёмных (Vi) и мольных (Ni) долей равны. Для расчета состава газа в массовых долях воспользуемся выражением (2.6). Учитывая молекулярные массы (кг/кмоль) компонентов нефтяного газа: CH4 – 16; C2H6 – 30; C3H8 – 44; C4H10 – 58; C5H12 – 72, найдем:
gCH4 = 61,3 •16 / (61,3•16 + 15,4•30 + 12,1• 44 + 6,8•58 + 4,4•72) =
980,8 / 2686,4 = 0,365,
Сумма всех долей массового состава равна 1.
Источник
Способы выражения состава
Нефтяной газ представлен в виде смеси углеводородов и неуглеводородных компонентов, поэтому для оценки его физико-химических свойств необходимо знать способы выражения состава смеси.
Массовая доля, весовой состав(gi) i-го компонента – величина, нормированная на 1 в долях или на 100 %. Она характеризует отношение массы i-го компонента (mi) в системе к общей массе системы:

Молярная доля, мольный состав (Ni) i-го компонента – величина, нормированная на 1 в долях или на 100 %, характеризует отношение числа молей i-го компонента (ni) к общему числу молей компонентов в системе:
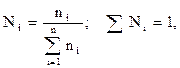

где mi – масса i-го компонента;
Мi – молекулярный вес i-го компонента.
Из соотношений (2.13–2.14) легко вывести выражения для пересчётов массового и мольного составов:

Объёмная доля i-го компонента – величина, нормированная на 1 или на 100 %, характеризует долю (Vi), которую занимает компонент в объёме системы. С учётом выражений (2.13–2.15) можно показать взаимосвязь объёмной доли с массовой и мольной долями:

Для идеального газа соблюдается соотношение – объёмная доля компонента (Vi) равна мольной доли компонента (Ni) → Vi = Ni. Этот постулат есть следствие закона Авогадро.
Нефтяной газ рассматривается как идеальная система и его состав можно рассчитать на основе любых данных: масс компонентов, объёмов, плотностей, парциальных давлений и других величин.
Рассмотрим пример.
Дан объёмный состав нефтяного газа (Vi, %): CH4 – 61,3 %;
Найти: какой будет массовый состав (gi, в долях) газа?
Решение. Для идеального газа величины объёмных (Vi) и мольных (Ni) долей равны. Для расчета состава газа в массовых долях воспользуемся выражением (2.6).
Учитывая молекулярные массы (г/моль) компонентов нефтяного газа: CH4 – 16; C2H6 – 30; C3H8 – 44; C4H10 – 58; C5H12 – 72, находим: gCH4 = 61,3·16/(61,3·16 + 15,4·30 + 12,1·44 + 6,8·58 + 4,4·72) =
Сумма всех долей массового состава равна 1.
Уравнение состояния
Для определения многих физических свойств природных газов используется уравнение состояния.
Уравнением состояния называется аналитическая зависимость между параметрами, описывающими изменение состояние вещества. В качестве таких параметров используются давление, температура, объём.Состояние газа при нормальных и стандартных условиях описывается уравнением Менделеева–Клапейрона:

где Р – абсолютное давление, Па;
Q – количество вещества, моль;
Т – абсолютная температура, К;
R – универсальная газовая постоянная, Па×м 3 /(моль×град).
На основе уравнения состояния газа можно рассчитывать многие параметры нефтяного газа: плотность, мольный объём, количество молекул, число молекул, парциальные давления и другие, если рассматривать количество вещества в уравнении состояния газа (2.17), равное 1 молю (Q = 1 моль).
С учётом этого, уравнение состояния газа можно преобразовать следующим образом:
Если сумма молей равна единице (∑N = 1 моль), следует, что уравнение приобретает вид Þ Р·V = R·T.
Зная, что масса (m) одного моля идеального газа равна его молекулярной массе (М), умножив левую и правую части на молекулярную массу и массу газа, соответственно, получим:
Поделив обе части на V·R·T и преобразовав (2.19), получим выражение для расчёта плотности:
Р·M/R·T = m/V, m/V = M·Р/R·T, r = M·Р/R·T. (2.20)
Рассмотрим пример.
Дан один моль метана CH4.
Найти: какова будет плотность метана при н.у. и с.у.?
Решение. Зная, что молекулярная масса метана равна 16,04 г/моль и один моль метана занимает объём при н.у. 22,414 л, а при с.у. 24,055 л, находим:
Из выражения (2.20) и расчётов следует, что плотность газа с возрастанием давления будет расти, а с возрастанием температуры уменьшаться.
Плотность смеси газовых компонентов рассчитывают с учётом средней молекулярной массы смеси газа (Mсм) как отношение молекулярной массы смеси газа к его мольному объёму (Vм).
Например, для нормальных условий плотность газа будет рассчитываться по выражению:
Если плотность газа (ρо) задана при атмосферном давлении, равном 0,1013 МПа, то пересчёт её величины с учётом другого давления (Р) при той же температуре для идеального газа выполняется по формуле:
Рассмотрим другой пример.
Плотность метана при н.у. равна 0,716кг/м 3 . Определить плотность метана (СН4) при избыточном давлении, например при давлении 500 кПа и температуре 0 °С.
Решение. В этом случае общее давление (1 атм = 101,325 кПа) в системе будет равно Р = (500 + 101,325) = 601,325 кПа.
Зная, что молекулярная масса метана = 16,04 г/моль (кг/кмоль), универсальная газовая постоянная (R) = 8,314 Дж/(К·моль), температура (T) = 273,15 К, находим плотность метана по (2.20 и 2.22):
rCH4 = Р·М/R·T = 601,325·16,04/8,314·273,15 = 4,25 (кг/м 3 ),
Относительная плотность газов величина, рассчитанная по отношению к плотности воздуха, определенного при тех же условиях:
Плотность воздуха (ρвозд) при н.у. равна » 1,293 кг/м 3 , а при с.у. » 1,189 кг/м 3 .
Рассмотрим пример.
Для условий задачи, рассмотренной выше (пример раздела 2.2), рассчитать абсолютные (r) и относительные (ρ о см) плотности смеси газов, используя правое выражение (2.12) для расчета молекулярной массы (г/моль):
Мсм = 100/(36,5/16 +17,2/30 +19,8/44 +14,7/58 +11,8/72) = 26,874;
rсм = 26,874/22,414 = 1,119 (кг/м 3 );
ρ о см (н.у.) = 1,119/1,293 = 0,927.
Аналогично из (2.20) находится и выражение для мольного объёма:
Мольный объём при давлениях, равных или близких атмосферному и, для физических процессов, когда не происходит изменения числа молей в системе, оценивается соотношением:
где R – универсальна газовая постоянная;
Т – температура, К.
Рассмотрим пример.
Найти вид зависимости изменения мольного объёма газа от температуры → V = f(T).
Решение. Воспользуемся выражением (2.25) и получим объём, занимаемый одним молем идеального газа для условий задачи:
Vн.у. = 0,08206·273,15 = 22,414 (м 3 ,);
Vс.у. = 0,08206·293,15 = 24,055 (м 3 ).
Любой газ при н.у. (Т = 0 о С и Р = 100 кПа, 760 мм рт. ст.) занимает объём, равный 22,414 м 3 , а при с.у. (Т = 20 о С и Р = 100 кПа) занимает объём равен 24,055 м 3 .
С увеличением температуры мольный объём газа увеличивается. Мольный объём газов с возрастанием температуры будет расти, а с возрастанием давления уменьшаться(2.24).
У этого уравнения есть свои граничные условия. Оно справедливо для описания поведения газов при давлениях, близких к атмосферному (от 0,1 до 1,0–1,2 МПа), и при температурах ≈ 0–20 о С. При повышенном давлении газ сжимается и его состояние отличается от поведения идеальных газов.
Источник




