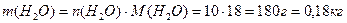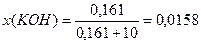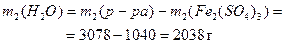Растворы. Способы выражения концентрации растворов
Материалы портала onx.distant.ru
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0%
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
Мольный процент представляет мольную долю, умноженную на 100:
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0
Объёмный процент представляет собой объёмную долю, умноженную на 100.
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см 3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4 в кислой среде | ? | 0,03 М KMnO4 в нейтральной среде | ? |
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4 в нейтральной среде | 0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см 3 .
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см 3 .
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см 3 ), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см 3 .
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см 3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
Источник
I.Способы выражения состава раствора



РАСТВОРЫ
Методические указания по решению задач
индивидуального и контрольного заданий
для студентов I курса всех специальностей
Методические указания разработаны к.т.н., доцентом В.Н.Зыряновой
Утверждены методической комиссией СТФ
-Н.А Старцева, к.х.н., доцент кафедры химии (НГАСУ).
Индивидуальное задание и контрольная работа по теме «Растворы» включают следующие разделы: способы выражения состава раствора; коллигативные свойства разбавленных растворов неэлектролитов и электролитов; водородный и гидроксильный показатели растворов; гидролиз солей.
К выполнению индивидуального задания и контрольной работы следует приступать после изучения раздела курса химии «Растворы» и примеров решения типовых задач, приведенных в данном пособии.
Решение задач и ответы на вопросы должны быть четко обоснованы; необходимо приводить весь ход решения, используемые формулы и математические преобразования.
I.Способы выражения состава раствора.
Раствор – гомогенная (однофазная) термодинамически устойчивая система переменного состава, состоящая из двух (растворитель и растворенное вещество) или более компонентов. Свойства раствора определяются многими факторами, один из них — количество растворенного вещества в растворе. Количественный состав раствора определяют с помощью концентраций.
Массовая доля растворенного вещества ω(В):
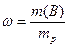
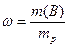
m(B) – масса растворенного вещества, г
mp – масса раствора, г

либо mp= 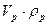
Vp— объем раствора, мл
ρ – плотность раствора, г/мл
Молярная доля растворенного вещества x(B):
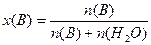
n(B), n(H2O) – количество вещества (В) и количество вещества растворителя, моль
Молярная концентрация с(B):
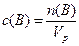
n(B) – количество растворенного вещества, моль
Vp— объем раствора, л
Молярная концентрация эквивалентов сэк(B):
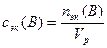
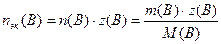
nэк(B) – количество вещества эквивалентов, моль-эк
z(B) – число эквивалентности
M(B) – молярная масса растворенного вещества, г/моль
Моляльная концентрация сm(B):
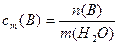
n(B)- количество растворенного вещества, моль
m(H2O)- масса растворителя, кг
Титр раствора Т(В):
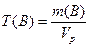
m(B)-масса растворенного вещества, г
Vp— объем раствора, мл
Пример 1. Раствор образован из 10 моль воды и 9г KOH. Определите моляльную концентрацию, массовую и молярную долю КОН в растворе.
Решение. 1) Расчет моляльной концентрации раствора КОН по формуле (6):
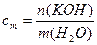
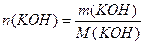
М(КОН) = 56 г/моль, М(Н2О) = 18 г/моль,
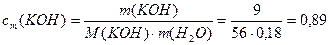
2) Расчет массовой доли КОН в растворе по формуле (1):
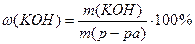
m(р-ра)= 9+10×18=189 г, ω(KOH)= 9×100/189=4,76%
3) Расчет молярной доли КОН в растворе по формуле (3):
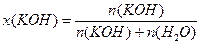
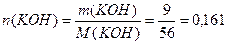
Пример 2. Определите молярную и молярную концентрацию эквивалентов раствора, содержащего 500г воды и 12г соляной кислоты, если плотность раствора равна 1,01г/мл.
Решение. 1) Определим молярную концентрацию раствора по формуле (4):
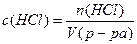
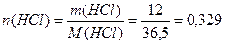
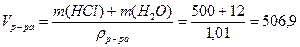
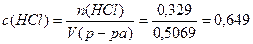
2) Определим молярную концентрацию эквивалентов раствора HCl по формуле (5):
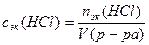
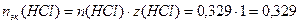
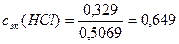
Пример 3.1 л 30%-ного раствора NaOH с плотностью ρ1=1,328г/мл разбавили водой до 6 л, полученный раствор имеет плотность ρ2=1,055 г/мл. Определите молярную, моляльную концентрацию и титр раствора после разбавления.
Решение. 1) Определим состав раствора до разбавления водой:
Зная, что ω(NaOH) = 30%, составим пропорцию и определим m(NaOH): в 100 г раствора содержится 30г NaOH

m(NaOH)= 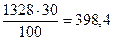
2) Определим состав раствора после разбавления:
3) Определим моляльную концентрацию раствора после 
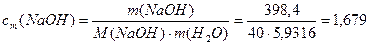
4) Определим молярную концентрацию раствора после разбавления:
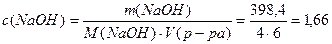
5) Определим титр раствора NaOH после разбавления: 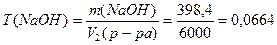
Пример 4.К 3 л 0,8 М раствора сульфата железа (III) (ρ1= 1г/мл) добавили 0,2 моль кристаллического Fe2(SO4)3. Определите моляльную, молярную концентрации и массовую долю в полученном растворе, если ρ2= 1,026 г/мл.
Решение. 1) Определим состав исходного раствора:
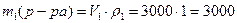
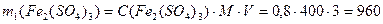
2) Определим состав конечного раствора:
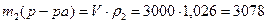
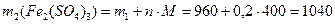
3) Определим концентрации конечного раствора:

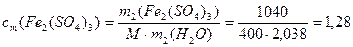
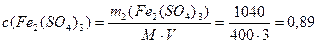
Источник