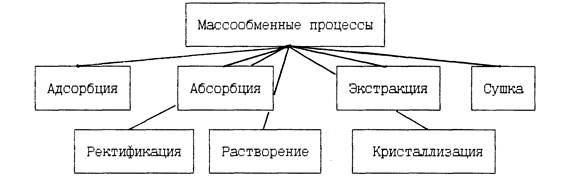
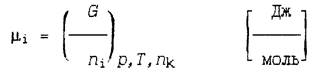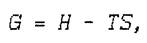16. Классификация массообменных процессов.
1.Абсорбция— поглощение газового компонента из смеси газов жидким поглотителем, обратный процесс называется десорбция.
2.Экстракция— разделение гомогенных жидких смесей другой жидкостью, в которой одна из смесей растворяется, а остальные не смешиваются (не реагируют).
3.Перегонка и ректификация— это разделение гомогенной жидкой смеси путем перевода пар-жидкость. Перегонка- однократный переход. Ректификация- многократный переход. Продукт ректификации называется — ректификат.
4.Адсорбция-поглощение компонента газа, пара или жидкости твердым поглотителем, то есть переход распределяемого компонента из газовой или жидкой фазы в твердую. Обратный процесс-десорбция.
Если процесс адсорбции происходит с ионным обменом то он называется ионосорбция .
Если процесс адсорбции происходит с химической реакцией то он называется хемосорбция.
Пример адсорбции- (противогаз) активированный уголь, селикогель.
5.Кристаллизация— выделение твердой фазы из растворов или расплавов. Обратный процесс- растворение или расплавление.
6.Сушка— процесс удаление влаги из твердого материала путем ее испарения при повышенной температуре, обратный процесс- увлажнение.
Компонент, переходящий из одной фазы в другую называется распределяемым компонентом.
Распределяемое вещество внутри каждой фазы переносится путем диффузии, поэтому массообменные процессы часто называют диффузионными. Из теории переноса следует, что количество вещества, диффундирующее в пределах фазы прямо пропорционально поверхности раздела фаз и движущей силе переноса.
Движущей силой массообменных процессов является разность химических потенциалов, поскольку распределяемый компонент переносится от точки с большей концентрацией к точке с меньшей концентрацией; в газовой фазе может быть выражена через парциальные давления, либо для всех случаев- разность концентраций.
Любой массообменный процесс стремится к равновесию— когда движущая сила становится равной нулю. В массообмене принимают участие минимум две фазы и распределяемый компонент, который переносится из фазы в фазу.
2.2. Способы выражения состава фаз.
Концентрация распределяемого компонента в газовой фазе обозначается- (

Концентрации бывают: массовые и мольные, мольные обозначаются чертой над знаком концентрации.
1.Объемные концентрации обозначаются буквой (С)- это есть масса распределяемого компонента приходящаяся на единицу объема фазы.

2.Массовая или мольная доля — обозначается (
компонента, отнесенная к массе всей фазы (


3.Относительные концентрации: Y,X- масса распределяемого компонента, отнесенная к массе носителя, то есть одной фазы, [

Правило фаз Гиббса.
17. Равновесие при массообмене
При равновесии достигается определенная зависимость между предельными или равновесными концентрациями распределяемого вещества в фазах для данных температуры и давления при которых осуществляется процесс массопередачи. Равновесная концентрация обозначается (*) звездочкой.
В условиях равновесия некоторому значению 







Отношение концентраций фаз при равновесии называется коэффициентом распределения (
Коэффициент распределения выражает тангенс угла наклона линии равновесия и для кривой линии равновесия, является величиной переменной.


Л


ид функции 

Источник
Способы выражения состава фаз. Законы фазового равновесия
Классификация массообменных процессов и их общая характеристика
Классификация массообменных процессов и их общая характеристика. Способы выражения состава фаз. Законы фазового равновесия
В химической технологии широко применяются процессы, протекающие при непосредственном соприкосновении различных фаз исопровождающиеся переходом вещества из одной фазы в другую. Такие процессы получили название массообменных(Лазарев).
Процессом массообмена называется диффузионный переход одного или нескольких компонентов бинарных и многокомпонентных смесей из одной фазыв другую(Гельперин).
Различают два варианта массообмена:
В первом случае процесс завершается переходом вещества из одной фазы в другую, во втором — встречным переходом веществ из каждой фазы в другую.
Различают следующие массообменные процессы (см. рис.1.1):
Рис.1.1. Основные массообменные процессы
Абсорбция — поглощение газов иди паров жидким поглотителем (абсорбентом) . При абсорбции вещество переходит из газовой или паровой фазы в жидкую. Обратный процесс выделения газа из жидкости называется десорбцией.
Экстракция — извлечение вещества из жидкого или твердого тела другой жидкостью. При экстракции вещество переходит или из жидкости в жидкость, или из твердого тела в жидкость. В последнем случае процесс называется выщелачиванием.
Ректификация — разделение гомогенных жидких смесей путем многократного взаимодействия между жидкой и паровой фазами. При ректификации вещества переходят из жидкой фазы в паровую и из паровой в жидкую.
Адсорбция — процесс поглощение газа, пара или вещества из раствора твердым пористым поглотителем (адсорбентом). При адсорбции вещество переходит из газовой (паровой) или жидкой фазы в твердую. Обратный процесс — десорбция. Разновидностью адсорбции является ионный обмен — процесс разделения, основанный на способности некоторых твердых веществ (ионитов) обменивать свои подвижные ионы на ионы растворов электролитов.
Сушка — удаление влаги из твердых материалов главным образом путем ее испарения. В этом процессе влага переходит из твердой фазы в газовую или паровую.
Кристаллизация — выделение твердой фазы в виде кристаллов из растворов или расплавов. Кристаллизация характеризуется переходом вещества из жидкой фазы в твердую вследствие изменения его растворимости.
Растворение — процесс обратный кристаллизации, характеризуется переходом твердой фазы в жидкую (растворитель).
Для всех названных процессов общим является переход вещества из одной фазы в другую.
Подобно теплообмену, который включает в себя более узкие понятия — теплоотдачу и теплопередачу, массообмен также подразделяется на массоотдачу и массопередачу.
Массопередача — представляет собой сложный процесс, включающий перенос вещества (массы) в пределах одной фазы, перенос его через поверхность раздела фаз и его перенос в пределах другой фазы.
Массоотдача— перенос вещества из фазы к границе раздела фаз или в обратном направлении, т.е. в пределах одной фазы.
Процессы массопередачи можно разделить на две группы.
К первой группе относятся процессы (абсорбция, экстракция и др.), в которых участвуют минимально три вещества: одно образует первую фазу, другое — вторую фазу, а третье представляет собой распределяемое между фазами вещество. Вещества, составляющие каждую из фаз, являются лишь носителями распределяемого вещества и сами не переходят из фазы в фазу. Так, например, при поглощении аммиака водой из его смеси с воздухом, вода и воздух служат носителями распределяемого вещества — аммиака.
Ко второй группе относятся процессы (например, ректификация), в которых вещества, составляющие две фазы, обмениваясь компонентами, сами непосредственно участвуют в массопередаче и уже не могут рассматриваться как инертные носители распределяемого вещества.
Распределяемое вещество внутри каждой фазы переносится путем диффузии, поэтому процессы массопередачи называются также диффузионными процессами.
Напомним, что диффузия — это распространение вещества в какой-либо среде в направлении убывания его концентрации, обусловленное тепловым движением ионов, атомов, молекул, а также более крупных частиц.
Для диффузионных процессов принимают, что количество переносимого вещества пропорционально поверхности раздела фаз и движущей силе.
Движущая сила характеризуется степенью отклонения системы от состояния динамического равновесия, выражаемой наиболее точно разностью химических потенциалов распределяемого вещества.
Отсюда еще одно определение массообмена как самопроизвольного, необратимого процесса переноса массы какого-либо компонента из одной фазы в другую иди в пределах одной фазы в направлении уменьшения химического потенциала этого компонента.
Под химическим потенциалом понимают функцию состояния, используемую для описания термодинамической системы с переменным числом частиц. В общем случае, химический потенциал многокомпонентной, гомогенной системы (или какой-либо фазы гетерогенной системы) равен приращению изобарно-изотермического потенциала G системы (фазы), обусловленному увеличением на единицу количества ni i-го компонента при условии, что давление, температура и количество всех остальных компонентов системы остаются неизменными.
Изобарно-изотермический потенциал (энергия Гиббса, свободная энтальпия) равен
где Н — энтальпия;
T — термодинамическая температура.
Диффундирующее в пределах фазы вещество, перемещается от точки с большей к точке с меньшей концентрацией, а в расчетах движущую силу процессов массообмена выражают приближенно через разность концентраций распределяемого вещества в данной фазе и в состоянии равновесия с другой контактирующей фазой.
Процессы массопередачи избирательны (селективны) в тех случаях, когда поглотитель извлекает только один (или несколько компонентов) исходной смеси и практически не извлекает остальных ее компонентов.

Процессы массопередачи большей частью обратимы, т.е. могут протекать в противоположных направлениях в зависимости от температуры, давления и других условий их проведения. При этом направление перехода вещества из фазы в фазу определяется концентрациями распределяемого вещества в фазах и условиями равновесия.
Обычно количественный состав фаз выражают (см. табл.1.1):
— в объемных концентрациях, принимая за единицу массы 1 кг или 1 кмоль; объемная концентрация представляет собой число килограммов (или киломолей) данного компонента, приходящееся на единицу объема фазы (в кг/м 3 или кмоль/м 3 );
— в массовых (весовых) или мольных долях, представляющих собой отношение килограммов (или киломолей) данного компонента к массе всей фазы, выраженное общим числом килограммов или киломолей соответственно;
— в относительных концентрациях, т.е. в виде отношения килограммов (или киломолей) данного компонента, являющегося распределяемым веществом к числу килограммов (или киломолей) компонента-носителя, количество которого остается постоянным в процессе массопередачи.
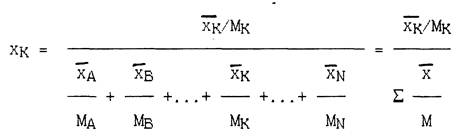
Пересчет массового состава в мольный или наоборот производится следующим образом.
Пусть имеется смесь, состоящая из компонентов А, В. K. N, массовые доли (или массовые проценты) которых в смеси хA, хB, . хK , . хN и молекулярные веса равны МA,, МB,, . , МK,, . ,МN..
Число молей любого компонента, например, компонента K, приходящееся на 1 кг смеси, составляет хK/МK . Соответственно содержание этого компонента в смеси (в мольных долях) составит
Источник