Способы выражения концентраций в титриметрическом анализе
В титриметрическом анализе используют следующие основные способы выражения концентраций растворов.
Молярная концентрация с(А) —- количество растворенного вещества А в молях, содержащееся в одном литре раствора:

где m(А) — масса растворенного вещества А, г
М(А.) — молярная масса растворенного вещества А, г/моль.
Молярная концентрация эквивалента с(1/Z А), или нормальность (старое название),— количество растворенного вещества А в молях, соответствующее эквиваленту А, содержащееся в одном литре раствора:

где 1/Z — фактор эквивалентности; рассчитывается для каждого вещества на основании стехиометрии реакции;
M(1/ZА) — молярная масса эквивалента растворенного вещества А, г/моль.
Титр T(А) растворенного вещества А — это масса растворенного вещества А в граммах, содержащаяся в одном миллилитре раствора:

где объем раствора V измеряется в мл.
Титр раствора по определяемому веществу X, или титриметрический фактор пересчета t (Т/ Х), — масса титруемого вещества, взаимодействующая с одним миллилитром титранта Т:

Поправочный коэффициент К — число, выражающее отношение действительной (практической) концентрации c(1/zA) вещества А в растворе к его заданной (теоретической) концентрации с(1/zА)теор:
К = c(1/zA)пр/c(1/zA)теор
Лабораторная работа № 1
Определение содержания Na 2 CO 3 и NaHCO 3
При их совместном присутствии
Для своего варианта рассчитать навеску вещества с заданной концентрацией в требуемом объеме.
| № | Соединение | mн, г | См | Сн | % | Т×10 3 | r, г/см 3 | V, л или m, кг |
| 1 | NaHCO3 Na2CO3 | 0,05 0,05 | 0,5 | |||||
| 2 | NaHCO3 Na2CO3 | 0,03 0,06 | 0,5 | |||||
| 3 | Na2CO3 NaHCO3 | 0,4 0,5 | 3,0 6,0 | 0,5 кг | ||||
| 4 | Na2CO3 NaHCO3 | 5,0 5,0 | 0,25 | |||||
| 5 | NaHCO3 | 7,0 | 0,25 | |||||
| 6 | Na2CO3 | 0,6 | 0,25 кг | |||||
| 7 | NaHCO3 | 0,05 | 0,25 | |||||
| 8 | NaHCO3 Na2CO3 | 0,06 0,05 | 0,25 | |||||
| 9 | NaHCO3 Na2CO3 | 0,055 0,045 | 0,25 | |||||
| 10 | NaHCO3 Na2CO3 | 0,2 0,8 | 0,25 кг | |||||
| 11 | Na2CO3 NaHCO3 | 8,0 2,0 | 0,2 | |||||
| 12 | Na2CO3 NaHCO3 | 4,0 6,0 | 0,25 | |||||
| 13 | Na2CO3 NaHCO3 | 7,0 3,0 | 0,25 | |||||
| 14 | Na HCO3 | 0,45 | 0,25 кг | |||||
| 15 | NaНCO3 | 0,1 | 0,25 | |||||
| 16 | Na2CO3 | 0,1 | 0,25 | |||||
| 17 | NaHCO3 Na2CO3 | 0,01 0,09 | 0,2 | |||||
| 18 | NaHCO3 | 0,38 | 0,25 кг | |||||
| 19 | NaHCO3 Na2CO3 | 1,0 6,0 | 0,25 | |||||
| 20 | Na2CO3 NaHCO3 | 3,0 7,0 | 0,25 | |||||
| 21 | Na2CO3 NaHCO3 | 1,5 6,5 | 0,5 | |||||
| 22 | Na2CO3 | 0,42 | 0,25 кг | |||||
| 23 | NaHCO3 | 0,1 | 0,25 | |||||
| 24 | Na2CO3 | 0,08 | 0,2 | |||||
| 25 | NaHCO3 | 7,0 | 0,25 | |||||
| 26 | Na2CO3 | 0,6 | 0,25 кг | |||||
| 27 | NaHCO3 | 0,05 | 0,25 | |||||
| 28 | NaHCO3 Na2CO3 | 0,06 0,05 | 0,25 | |||||
| 29 | NaHCO3 | 0,38 | 0,25 кг |
Результаты занести в таблицу и показать преподавателю. После его разрешения приступить к приготовлению раствора.
| Соединение | mн, г | См | Сн | % | Т, г/мл | r, г/см 3 | V, л или m, кг |
| NaHCO3 Na2CO3 |
Приготовление раствора солей нужной концентрации
Рассчитанную навеску солей (или одной соли) взвешивают на аналитических весах и количественно переносят в мерную колбу заданного объема (200 мл, 250 мл или 500 мл). Мерную колбу заполняют наполовину дистиллированной водой и растворяют навеску путем перемешивания. После растворения солей (или одной соли) доливают дистиллированную воду до метки мерной колбы и тщательно перемешивают.
Раствор переливают в пластмассовую бутылку и подписывают.
Содержание солей определяют путем титрования приготовленного раствора соляной кислотой, используя два индикатора: фенолфталеин и метиловый оранжевый. При титровании наблюдаются две точки эквивалентности: первая, когда «наполовину» нейтрализован Na2CO3, вторая, когда нейтрализован NaHCO3, содержащийся в исходной смеси и полученный в результате нейтрализации Na2CO3. В этот момент наступает полная нейтрализация смеси Na2CO3.
NaHCO3 + HCl ® NaCl + CO2 + H2O (метиловый оранжевый)
Кислота хлористоводородная, НСl 0,1н раствор;
Индикаторы: фенолфталеин, метиловый оранжевый.
В бюретку до значения «0» заливают 0,1 н раствор HCl.
В коническую колбу емкостью 250 мл пипеткой переносят аликвотную часть приготовленного раствора, добавляют 2-3 капли фенолфталеина (раствор окрашивается в малиновый цвет) и по каплям приливают из бюретки 0,1 н раствор HCl до полного обесцвечивания раствора. Записывают объем раствора НС1, пошедший на титрование V ф. Затем в эту же колбу добавляют 2-3 капли метилового оранжевого (раствор окрашивается в желтый цвет) и продолжают тировать 0,1 н НС1 до перехода окраски в красновато-оранжевый цвет. Записывают объем раствора соляной кислоты, пошедший на титрование V мо.
Проводят три параллельных опыта. В формулу для расчета подставляют среднее арифметическое значение трех параллельных определений: 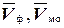
Содержание карбоната натрия и гидрокарбоната натрия определяют по формулам:


где NHCl — нормальность раствора соляной кислоты;
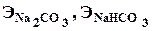
Vк и Vп — объемы соответственно мерной колбы и мерной пипетки, мл.
Принято экспериментальные данные и результаты расчетов выражать только значащими цифрами. Значащими называют все достоверно известные цифры плюс первая из недостоверных, т.е. все результаты следует округлять до первой недостоверной цифры.
Например, объем титранта, пошедший на титрование V = 12,5 мл.
Содержание определяемого вещества (г) записывают до трех значащих цифр. Например, 0,204; 0,0258 или 1,23. Нули, стоящие в начале числа всегда незначимы и служат лишь для указания места запятой в десятичной дроби.
Лабораторная работа № 2
Определение содержания Na ОН и Na 2 CO 3
Дата добавления: 2019-09-13 ; просмотров: 435 ; Мы поможем в написании вашей работы!
Источник
2.1.Титриметрический метод анализа.
Титриметрия или титриметрические методы количественного анализа основаны на точном измерении объема раствора реактива, израсходованного на реакцию с определяемым веществом. Раствор реактива (титрант, рабочий раствор) должен при этом иметь точную концентрацию, обеспеченную условиями приготовления раствора (рабочий раствор с приготовленным титром) или установленную по другому раствору с точно известной концентрацией (рабочий раствор с установленным титром).
Титр — способ выражения концентрации раствора, определивший название метода, и показывающий массу растворенного вещества в граммах в 1 см 3 (или 1 мл) раствора. Процесс постепенного добавления титранта к раствору определяемого вещества называют титрованием. При титровании наступает момент, когда рабочий раствор В и определяемое вещество А прореагируют между собой в эквивалентных количествах, т.е. в строгом соответствии со стехиометрией реакции. В таком случае справедлив закон эквивалентов, составляющий основу расчетов в титриметрии:
При титровании важно зафиксировать конец реакции, называемый точкой стехиометричности или точкой эквивалентности (ТЭ). Для экспериментального установления конечной точки титрования (КТТ), по возможности наиболее близкой к теоретической ТЭ, используют изменение окраски индикатора или какого-либо физического свойства раствора.
К химической реакции титрования предъявляются следующие требования:
1) строгая стехиометричность, отсутствие побочных реакций;
2) высокая скорость;
3) практическая необратимость (Кр > 10 7 ), обеспечивающая количественное превращение реагирующих веществ в продукты реакции;
4) наличие подходящего индикатора или другого способа фиксирования ТЭ.
В титриметрии используют точную мерную посуду: мерные колбы — для приготовления растворов; пипетки — для точного измерения определенного объема раствора при перенесении в другой сосуд
Пипетки: градуированная и простая
Пипетки-дозаторы: а) унипипетка и б) варипипетка
и бюретки — для измерения объема титранта
Бюретки: а) с зажимом Мора, б) со стеклянным затвором-шариком, в) со стеклянным краном
Микробюретки: а) с прямым краном и б) с боковым краном.
Титриметрические методы характеризуются быстротой анализа, простотой оборудования, возможностью автоматизации определения. Чувствительность индикаторных методов титриметрии составляет 10 -3 -10 -4 моль/л, относительная погрешность более 0,1 %.
Классификация титриметрических методов анализа
Методы титрования. В титриметрии используют реакции всех типов — с переносом протона, электрона, электронной пары, процессы осаждения. В соответствии с типом реакции (видом химического равновесия) титриметрические методы разделяют на 4 группы, в каждой из которых выделяют отдельные группы по названию применяемых титрантов.
Приемы титрования. Различают прямое, обратное и титрование заместителя.
При прямом титровании титрант В непосредственно добавляют из бюретки к титруемому веществу А. Прием используют только при выполнении требований к реакции титрования. В случае их невыполнения или в практических целях используют прием обратного титрования, для осуществления которого необходимы два рабочих раствора титрант В1 и титрант В2. Первый добавляется к определяемому веществу А в избытке для доведения реакции до конца, а остаток В1 оттитровывается титрантом В2 для определения непрореагировавшего титранта В1. В этом случае n(А) рассчитывается по разности эквивалентных количеств двух рабочих растворов:
Пример. Ион NH4 + , являющийся в воде очень слабой (Ка=5,68*10 -10 ) кислотой, нельзя оттитровать рабочим раствором NaOH приемом прямого титрования из-за высокой обратимости реакции. Поэтому, к пробе, содержащей соль аммония, добавляют определенный объем титрованного раствора NaOH (В1), обеспечивающий избыточное количество щелочи по отношению к ионам аммония, после чего удаляют аммиак и избыток NaOH титруют рабочим раствором НСl (B2), т.е. последовательно выполняются две реакции:
Титрование заместителя используют при отсутствии подходящего индикатора, при несоблюдении стехиометричности, при медленном протекании реакции и др. В этом случае к определенному объему А добавляют избыток вспомогательного реагента, стехиометрически взаимодействующего с веществом А, а получающийся в эквивалентном количестве продукт реакции оттитровывают рабочим раствором В. Закон эквивалентов при титровании заместителя имеет выражение, как при прямом титровании:
Например, для определения соли аммония проводят реакцию с формальдегидом:
Выделившееся эквивалентное количество ионов H + (заместителей NH4 + ) оттитровывают рабочим раствором NaOH.
n(NH4 + ) = n(NaOH) Способы титрования. При проведении параллельных определений, используют способ отдельных навесок или способ пипетирования (аликвот). В способе пипетирования пробу (навеску или объем), содержащую определяемое вещество А, переводят в мерную колбу вместимостью Vм.к., а на титрование отбирают пипеткой равные объемы Vп — аликвоты. В способе отдельных навесок пробу помещают в колбу для титрования (навеску растворяют) и проводят титрование, точно измеряя при этом объем израсходованного титранта VВ. Способ пипетирования является более экспрессным и менее трудоемким, но и менее точным, чем метод отдельных навесок. Расчетные формулы для разных приемов и способов титрования приведены в табл. 4.
Способы выражения концентрации растворов в титриметрии
Все расчеты в титриметрии связаны с законом эквивалентов и понятием эквивалент. Эквивалентом называют реальную или условную частицу вещества, которая в данной реакции равноценна (эквивалентна) одному иону водорода или одному электрону. Например, эквивалент NaOH, НСl, NaCl — реальная частица, соответствующая молекуле этих веществ. Эквивалент Н3PO4 , в зависимости от числа участвующих в реакции протонов, может представлять реальную молекулу Н3PO4 и условную часть молекулы: 1/2Н3PO4 или 1/3Н3PO4. Дробь, показывающую, какая часть молекулы или иона является эквивалентом, называют фактором эквивалентности fэкв. Фактор эквивалентности рассчитывают на основе стехиометрии реакции. Число, показывающее, сколько эквивалентов содержится в молекуле, называют числом эквивалентности и обозначают z * : fэкв = 1/z * . Молярная масса эквивалента вещества — это масса одного моля эквивалента этого вещества, равная произведе-нию фактора эквивалентности на молярную массу вещества. На-пример, для вещества В:
Молярная масса эквивалента вещества может быть различной, в зависимости от протекающей реакции с его участием.
Условные обозначения и размерности концентрации. В титриметрии обычно используют следующие способы выражения концентрации:
с(В) — молярная концентрация раствора вещества В, моль/л (или моль/дм 3 );
с(fэквВ) — молярная концентрация эквивалента вещества В, моль/л (моль/дм 3 ). с(fэквВ) = n(fэквВ)/V(B),
где V(B) — объем раствора (л), содержащего n молей эквивалентов B. Соответствует старому названию «нормальная концентрация».
Не рекомендуется использовать термины «молярность» и «нормальность» раствора. Разрешаются сокращенные обозначения, например 0,025 М H2SO4 — 0,025 молярный раствор H2SO4, т.е. в одном литре раствора содержится 0,025 моль вещества H2SO4. Можно представлять концентрацию и таким образом: 0,050 н. H2SO4 — 0,050 нормальный раствор H2SO4, т.е. в одном литре раствора содержится 0,050 моль эквивалента вещества H2SO4.
Т(В) — титр раствора вещества В, г/мл (г/см 3 ) – показывает массу вещества В в одном миллилитре раствора:
Т(В/A) — титр рабочего раствора В по определяемому веществу А, г/мл – показывает, какая масса вещества А эквивалентна одному миллилитру рабочего раствора В. Например, Т(KMnO4/Fe) = 0,001396 г/мл означает, что 1 мл такого раствора KMnO4 эквивалентен (оттитровывает) 0,001396 г Fe.
Такой способ выражения концентрации удобен при серийных анализах, поскольку:
От одного способа выражения концентрации можно перейти к другому:
Пример. Из 2,500 г Na2CO3 приготовлено в мерной колбе 500 мл раствора. Вычислить для этого раствора: а) Т(Na2CO3), б) молярную концентрацию, в) молярную концентрацию эквивалента Na2CO3, если предполагается титрование приготовленного раствора рабочим раствором НСl с индикатором метиловым оранжевым, г) определить молярную концентрацию НСl и Т(НСl/Na2CO3), если на титрование 25,00 мл раствора соды израсходовано 23,35 мл раствора НСl.
в) реакция Na2CO3 с HCl при титровании с метиловым оранжевым протекает до Na2CO3, т.е. с участием двух эквивалентов карбоната натрия:
Поскольку с(fэквВ) = Т(В/A)*1000/М(fэкв(А)А),
В анализе чаще всего пользуются рабочими растворами с концентрациями 0,005 — 0,1 моль/л. Не применяются 1 М растворы, так как в этом случае велика капельная ошибка титрования, т. е. ошибка при добавлении одной лишней капли титранта. Удобство использования в титриметрии с(fэквВ) — связано с тем, что при одинаковых концентрациях растворов веществ А и В реакции идут между равными их объемами согласно закону эквивалентов n(A) = n(B) или: с(fэквВ)*V(B) = с(fэквА)*V(А).
Выражение закона в устаревших обозначениях:
Указания к оформлению работ
Отчет по лабораторной работе должен содержать:
1) дату, название работы;
2) краткое описание метода, приема и способа титрования;
3) сущность методики с обязательным приведением всех уравнений реакций и указанием условий анализа;
4) цифровой материал для расчетов (привести используемые объемы мерных колб, пипеток; навески веществ, необходимые значения молярных масс или молярных масс эквивалентов; полученные экспериментальные данные параллельных измерений объемов титранта);
5) расчетные формулы и результаты расчетов согласно заданию лабораторной работы;
6) результаты расчетов абсолютной и относительной погрешностей – при анализе контрольных образцов;
7) оценку воспроизводимости (сходимости) результата выборочной совокупности и границ доверительного интервала.
Источник




