Растворы. Способы выражения концентрации растворов
Материалы портала onx.distant.ru
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0%
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
Мольный процент представляет мольную долю, умноженную на 100:
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0
Объёмный процент представляет собой объёмную долю, умноженную на 100.
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см 3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4 в кислой среде | ? | 0,03 М KMnO4 в нейтральной среде | ? |
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4 в нейтральной среде | 0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см 3 .
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см 3 .
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см 3 ), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см 3 .
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см 3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
Источник
Глава 6. Способы выражения концентраций растворов



После изучения этой темы вы должны усвоить:
— основные понятия: раствор, растворитель, растворенное вещество;
— способы выражения концентраций растворов.
Растворыпредставляют собой гомогенную (однородную) систему, состоящую из двух или более компонентов и продуктов их взаимодействия. Растворителемсчитают тот компонент, количество которого в растворе преобладает.
Концентрацией раствора называется содержание растворенного вещества в определенной массе или определенном объеме раствора (или растворителя). Существует несколько способов выражения концентрации раствора: процентная концентрация, молярная, моляльная, нормальная, т.е. концентрация моль-эквивалентов.
Процентная концентрация(w) раствора показывает, сколько граммов растворенного вещества содержится в 100 г раствора. Математическое выражение для расчета процентной концентрации раствора:
Растворы характеризуются еще одной важной величиной – плотностью раствора. Плотность (r) – это масса одной единицы объема. Плотность обычно измеряют в г/см 3 или г/мл.
Молярная концентрация (См) – показывает число молей растворенного вещества, содержащихся в 1 литре раствора.
1 Моль это такое количество вещества (n), которое содержит 6,02 . 10 23 структурных единиц (атомов, молекул, ионов). 6,02 10 23 — число Авогадро. Молярная масса (М) вещества (масса одного моля) численно равна молекулярной массе.Она рассчитываетсякак отношение массы вещества (m) к его количеству: М = m/n (г/моль).
Моляльная концентрация (Cm) – показывает число молей растворенного вещества содержащихся в 1000 г растворителя.
Вещества вступают в реакции в эквивалентном количестве. Например, 1 моль H2SO4 эквивалентен 2 молям NaOH в реакции
Нормальная концентрация (Сн) – показывает число моль-эквивалентов растворенного вещества, содержащегося в 1 литре раствора.
Эквивалентом (Э) вещества (атом, молекула, ион)называют такое его количество, которое соединяется с 1молем атомов или ионов водорода или замещает то же количество атомов водорода в химической реакции. Масса одного эквивалента вещества выражается в граммах, называется эквивалентной массой. Для вычисления эквивалентной массы элемента его атомную массу (А) делят на валентность (В):
Эm(эл-та) = А\В , например ЭСа = 40\2 = 20 г/моль . экв.
Эквивалентные массы сложных веществ:
Эm(кислоты) = М\кол-во атомов Н
Эm(основания) = М\кол-во групп ОН
Эm(соль) = М \ В(Ме) . n(Ме) , где n – число атомов металла в молекуле
В случае окислительно-восстановительных процессов молекулярную (атомную) массу вещества делят на число отданных или принятых электронов, например ЭmKMnO4 = M/5, если KMn +7 O4 
Закон эквивалентов. Массы реагирующих веществ прямопропорциональны их эквивалентным массам: m1\m2= Эm1\Эm2
Примеры расчета
Задача 1. Провести расчет массы кристаллогидрата СuSO4 . 5H2O и объем воды для приготовления 500 г раствора с wCuSO4 5% (r=1,1г/cм 3 ).
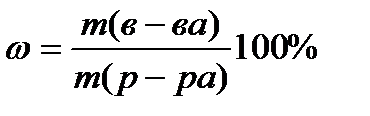
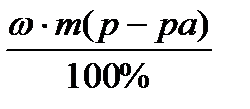
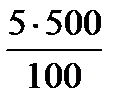
Расчет массы кристаллогидрата СuSO4 . 5H2O:
1 моль СuSO4 . 5H2O – 250г
1 моль СuSO4 . – 160г Þ составим пропорцию:
160г безводного СuSO4 . содержится в 250г СuSO4 . 5H2O
х = 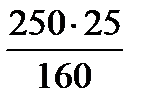
Расчет объема воды:
Ответ: Для приготовления 5% раствора из кристаллогидрата (СuSO4 . 5H2O) берем навеску вещества 39,06г и растворяем в 461мл воды.
Задача 2. Из данного раствора приготовить 200 мл 0,1 молярного раствора.
Рассчитаем массу СuSO4 . соответствующую концентрации См = 0,1 моль/л на объем колбы 200 мл:
0,1моль/л соответствует m = nМ = 0,1 . 160 = 16 г/л СuSO4
16 г СuSO4 содержится в 1000 мл раствора
х = 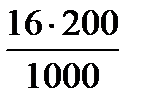
Найдем объем (V) 5% раствора, который содержит массу 3,2 г СuSO4:
| m p-pa |
5% из определения процентной концентрации это 5 г – 100г (р-ра).
Vр-ра = 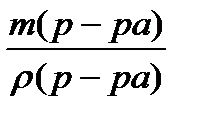
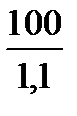
5г СuSO4 содержится в 90,91 мл раствора
х = 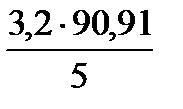
Ответ: Для приготовления 0,1 молярного раствора на объем колбы 200 мл берем мерным цилиндром 58 мл (5% раствора СuSO4) и доводим раствор до метки водой.
Задача 3. Провести расчет нормальной концентрации данного 5% раствора СuSO4.
Найдем число моль эквивалентов 5% раствора:
Масса одного моля эквивалента равна Эm = 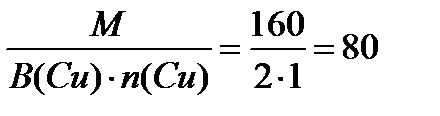
1моль эквивалент СuSO4 содержит 80 г

х моль эквивалент //—— // —— //——// -5 г (5%)
х = 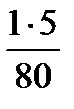
0,06 моль эквивалентов содержится в 90,91 мл раствора
х = 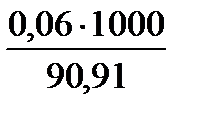
Ответ: Данный 5% раствор СuSO4 соответствует Сн =0,66 моль·экв/л.
Рекомендуемая литература: [1], с.216-221
Источник







